РНК-содержащий вирус гепатита С (ВГС) является этиологическим агентом воспалительного процесса в печени, который в 50–80% случаев переходит в хроническую форму [1] и в конечном итоге может привести к циррозу или гепатокарциноме. Основным путем передачи ВГС является парентеральный путь [2]. Трансфузии компонентов донорской крови являются неотъемлемой частью терапии заболеваний системы крови и одним из ведущих факторов риска вероятного инфицирования ВГС [3].
Особенностью ВГС является чрезвычайно высокая изменчивость генома. Наибольшей иммуногенностью обладают вирусные белки, кодированные гипервариабельным участком генома. Высокая степень гетерогенности этого локуса приводит к неэффективности гуморального ответа [1]. Наличие консервативной 5’-нетранслируемой области генома позволяет проводить генотипирование вируса. К настоящему времени выявлено 7 генотипов ВГС, в каждом из которых выделяют отдельные субтипы [2]. В России циркулируют преимущественно субтипы 1b и 3a [1, 4–10]. Согласно данным последних лет [1, 11–14], генотип вируса определяет как характер течения заболевания, так и ответ на противовирусную терапию. Течение инфекции, вызванной вирусом субтипа 1b, считается наиболее агрессивным и плохо поддается терапии [11–14]. Для других субтипов вируса характерно более мягкое течение и быстрое достижение устойчивого вирусологического ответа на лечение. Таким образом, определение субтипа ВГС у пациента является важным этапом при определении стратегии лечения.
На территории Российской Федерации специалисты регулярно изучают географическое распространение субтипов ВГС [4–10]. Так, в 1997 г. отмечено преобладание субтипа 1b (73,3%). Более редкими оказались субтипы 3а (11,6%), 1а (9,6%), а также сочетание субтипов 2а + 2b (5,1% случаев) [4–10]. К 2002 г. в Москве и Санкт-Петербурге доля субтипа 3а в структуре субтипов ВГС увеличилась до 39,5 и 65% соответственно, что, по-видимому, было связано с ростом числа потребителей инъекционных наркотиков [6, 7]. Также до 35% увеличилась доля субтипа 3а у пациентов, находящихся на стационарном лечении в лечебно-профилактических учреждениях Москвы и Санкт-Петербурга [6, 7, 10]. В разных субъектах РФ распространение субтипов ВГС приблизительно одинаково [4, 5, 8–10], однако имеются некоторые отличия. В Московской и Владимирской областях субтип 1b обнаруживали соответственно у 52,9 и 48,2% лиц с ВГС-инфекцией, а 3а – у 33,0 и 36,2%. Иная ситуация наблюдалась в Санкт-Петербурге, Новосибирске, Хабаровске и Барнауле, где доля субтипа 3а была выше (50–54%), чем доля 1b (25–46%). В Хабаровске высока доля субтипа 2а (25%). В Томской области субтип 3а (34,3%) преобладал над субтипом 1b (27,6%), и была высока доля образцов, в которых одновременно выявляли более одного субтипа – 34% [9].
Все вышеперечисленные данные получены в популяционных исследованиях среди лиц, инфицированных ВГС. Изучение распространения субтипов ВГС у реципиентов компонентов донорской крови представляет несомненный эпидемиологический интерес, однако работа в этом направлении практически не проводилась ни на территории РФ, ни за рубежом. Доказано, что ведущим фактором риска инфицирования ВГС пациентов с заболеваниями системы крови является высокая трансфузионная нагрузка от большого числа доноров. Частота выявления маркеров ВГС среди реципиентов множественных трансфузий, по данным литературы [15, 16], превышает аналогичные показатели в общей популяции населения России почти в 2 раза.
Реактивация ВГС-инфекции негативно сказывается на результатах лечения основного заболевания и общей выживаемости пациентов с заболеваниями системы крови, может являться причиной временной или даже полной отмены химиотерапии [16]. В настоящее время активно ведутся разработки новых специфических препаратов и схем терапии, эффективных для лечения разных субтипов ВГС [13, 17, 18]. В этой связи определение субтипа вируса крайне актуально.
Предыдущие исследования, проведенные в Гематологическом научном центре Минздрава России (далее – ГНЦ) в 2001–2003 г., выявили преобладание у пациентов-реципиентов множественных трансфузий тех же субтипов ВГС, что и у жителей России в целом: 1b (51,8%) и 3а (22,8%). Реже встречались субтипы 1а (3,6%), 2 (2,4%) и одновременное присутствие нескольких субтипов (1,2%). Кроме того, в 18,1% РНК ВГС-позитивных образцов определить субтип не удалось [19].
Целью настоящей работы был анализ профиля субтипов ВГС у инфицированных лиц, в том числе реципиентов компонентов донорской крови.
Материалы и методы
Проанализированы данные обследования 811 лиц, инфицированных ВГС, в период с 2004 по 2011 г. В группу повышенного риска инфицирования ВГС вошли пациенты клиник ГНЦ – реципиенты компонентов донорской крови (1-я группа; n = 550). В контрольную группу были включены ВГС-инфицированные пациенты без трансфузиологического анамнеза, направленные из других стационаров Москвы для определения генотипа ВГС (2-я группа; n = 261).
Проведен сравнительный анализ полученных данных и результатов исследований, выполненных в период 2001–2003 гг. [19].
Пробоподготовку образцов крови проводили по методике, описанной в предыдущих работах [19–21]. Наличие РНК и субтип ВГС определяли с помощью коммерческих наборов реагентов «АмплиСенс» (ООО «ИнтерЛабСервис», Россия)
Для выделения РНК использовали наборы «РИБО-золь» и «РИБО-преп».
Для амплификации РНК ВГС в клиническом материале применяли следующие наборы:
- для получения кДНК на матрице РНК – «Реверта-R»;
- для амплификации кДНК с электрофоретической детекцией продуктов амплификации в 2% агарозном геле – «АмплиСенс-100-R HCV-240/440-ВКО»;
- для проведения реакции обратной транскрипции РНК и амплификации кДНК с гибридизационно-флуоресцентной детекцией в режиме «реального времени» – «АмплиСенс HCV-FRT»; линейный диапазон от 500 до 5 х 107 МЕ/мл);
- для проведения реакции обратной транскрипции РНК и амплификации кДНК с гибридизационно-флуоресцентной детекцией в режиме «реального времени» – «АмплиСенс HCV-FL»; линейный диапазон от 300 до 1 х 108 МЕ/мл).
 Амплификацию кДНК ВГС проводили с помощью приборов «Perkin-Elmer 2400» («Perkin-Elmer Corporation», США) с последующим анализом в 2% агарозном геле методом горизонтального электрофореза, «Rotor-Gene 3000» и «Rotor-Gene-6000» («Corbett Research», Австралия) с регистрацией в режиме «реального времени».
Амплификацию кДНК ВГС проводили с помощью приборов «Perkin-Elmer 2400» («Perkin-Elmer Corporation», США) с последующим анализом в 2% агарозном геле методом горизонтального электрофореза, «Rotor-Gene 3000» и «Rotor-Gene-6000» («Corbett Research», Австралия) с регистрацией в режиме «реального времени».
Заявленная аналитическая чувствительность тест-систем при выделении РНК из 100 мкл образца составляет для «АмплиСенс-100-R HCV-240/440-ВКО» 300 МЕ/мл, для «АмплиСенс HCV-FRT» – 100 МЕ/мл, для «АмплиСенс HCV-FL» – 100 МЕ/мл.
Для идентификации субтипов ВГС (1a, 1b, 2, 3a) использовали ПЦР-наборы «АмплиСенс HCV-генотип-EPh» (заявленная аналитическая чувствительность – 1000 МЕ/мл).
Статистическую обработку данных проводили с применением программного обеспечения Public Domain Software for Epidemiology and Disease Survellance (Epi Info Version 5.00 – april 1990). Достоверность различий оценивали, используя точный критерий Фишера. Различия между группами считали статистически значимыми при р < 0,05.
Результаты и обсуждение
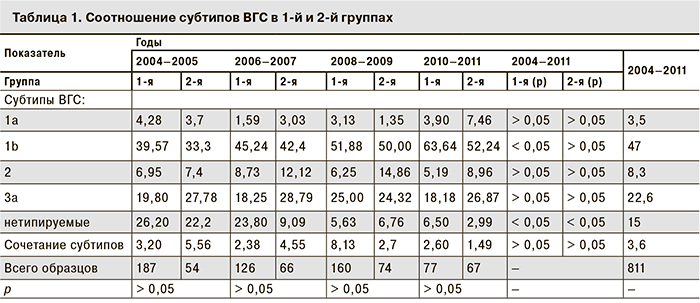
Результаты генотипирования ВГС в образцах крови, исследованных в период с 2004 по 2011 г., представлены в табл. 1.
При анализе результатов исследования были выявлены общие тенденции. В период наблюдения сохранялось преобладание субтипа 1b (п = 381; 47%). В 1-й группе отмечено статистически значимое увеличение доли субтипа 1b с 39,57 до 63,64% (р = 0,0026). К 2010–2011 гг. во 2-й группе доля субтипа 1b составила 52,24%. При сравнении с показателями 2001–2003 гг. установлено почти трехкратное увеличение доли субтипа 2: в 1-й группе – с 2,4 до 8,73% в период 2006–2007 гг., во 2-й – с 5,3 до 14,86% в период 2008–2009 гг. К концу периода наблюдения в обеих группах отмечено снижение доли этого субтипа до 5,19 и 8,96% соответственно. Во 2-й группе к 2010–2011гг. доля субтипа 1а увеличилась до 7,46%. В целом соотношение встречаемости субтипов 1а, 2 и 3а в 1-й и 2-й группах не имело статистически значимых отличий за весь период наблюдений.
Доля нетипируемых образцов статистически значимо снижалась за период исследования с 26,2 до 6,50% в 1-й группе и с 22,20 до 2,99% во 2-й группе (р < 0,05), что является следствием улучшения качества лабораторной диагностики, в том числе повышения чувствительности тест-систем для генотипирования.
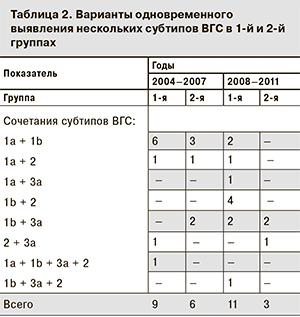
Одновременное выявление двух или более субтипов ВГС в одном образце крови – явление редкое. Единичные образцы объединены и проанализированы за периоды 2004–2007 и 2008–2011 гг. Отмечены определенные тенденции в структуре сочетаний субтипов ВГС (табл. 2). В 1-й группе с 2004 г.
С 2004 по 2007 гг. в 1-й группе обнаружено 9 образцов, в которых выявлены одновременно 2 или более субтипов ВГС в четырех сочетаниях. Доминировал вариант 1b + 1а (п = 6). В 2008–2011 гг. было выявлено 11 образцов с несколькими субтипами вируса и количество сочетаний субтипов ВГС увеличилось до 6 вариантов. Изменился и доминирующий вариант – им стал 1b + 2 (п = 4).
Во 2-й группе в 2004–2007 гг. выявлено 6 образцов, в которых одновременно идентифицировано 2 и более субтипов ВГС. Как и в 1-й группе, здесь доминировал вариант 1b + 1а (п = 3). В 2008–2011 гг. число проб, содержащих 2 субтипа вируса, уменьшилась вдвое (п = 3). Доминирующим стал вариант 1b + 3а (п = 2).
Разнообразие комбинаций субтипов ВГС в 1-й группе может быть обусловлено высокой трансфузионной нагрузкой с использованием компонентов крови от большого числа доноров, а также наличием у больных иммуносупрессии. Считается, что при недостаточной эффективности иммунитета появляется возможность кратковременного существования нескольких субтипов ВГС в пределах одного организма [22, 23], что косвенно подтверждают полученные нами данные.
В 1-й группе было выявлено 2 случая одновременного содержания более 2 субтипов: 1b + 3а + 2 и 1b + 3а + 2 + 1а. В 261 пробе от пациентов 2-й группы за весь период наблюдения не было зарегистрировано одновременного присутствия более двух субтипов вируса. Принимая во внимание этот факт, можно предположить ко- или суперинфицирование реципиентов за счет множественных трансфузий компонентов крови от большого числа доноров.
Выводы
- Выявлено сохраняющееся превалирование субтипа 1b (47%) у инфицированных ВГС лиц, в том числе статистически значимое увеличение доли субтипа 1b в группе реципиентов компонентов донорской крови, в период с 2004 по 2011 гг. (р < 0,05).
- Не установлено значимых отличий в профилях выявляемых субтипов ВГС у пациентов 1-й и 2-й групп.
- Улучшение качества лабораторной диагностики позволило статистически значимо снизить долю ВГС-позитивных образцов, не поддающихся генотипированию, с 26,20 до 6,50% в 1-й группе и с 22,20 до 2,99% – во 2-й (р < 0,05).
- В группе инфицированных ВГС пациентов-реципиентов трансфузий компонентов крови доноров отмечены 2 случая одновременного выявления трех и четырех субтипов ВГС.


