Реактивация инфекции вируса гепатита В (HBV-инфекции) является хорошо известным осложнением химиотерапии у больных с лимфомой. У носителей маркеров HBV поражение печени вследствие реактивации вируса может выявиться после отмены иммуносупрессивных препаратов, сопровождаясь фульминантной формой острого или хронического гепатита у 25% больных. Верификация реактивации вирусной инфекции позволяет своевременно назначить противовирусную терапию, тем самым сохранить схемы химиотерапии с доказанной эффективностью, предотвратить дальнейшее прогрессирование поражения печени и упрощает дифференциальную диагностику с лекарственным гепатитом – нередкой формой поражения печени в ходе химиотерапии. Первое описание нежелательных явлений иммуносупрессивной терапии при хронической HBV-инфекции опубликовано 37 лет назад [1]. У больных с миелопролиферативными или лимфопролиферативными заболеваниями, получавших химиотерапию, отмечено снижение титра HBsAb и обратная сероконверсия в HBsAg. У HBsAg-положительных больных до начала химиотерапии было отмечено нарастание концентрации HBsAg в сыворотке крови. У большинства больных с серологическими изменениями выявляли значительный рост уровня аминотрансфераз сыворотки, у части из них развивалась тяжелая печеночная недостаточность после прекращения химиотерапии, проводимой по поводу лейкоза или хориокарциномы [1, 2]. В дальнейшем стали отмечать выраженное обострение вирусной инфекции у больных, получающих химиотерапию по поводу гематологических опухолей, особенно В-клеточной лимфомы, а также рака яичков и шейки матки, мелкоклеточного рака легких, гепатоцеллюлярной карциномы и нейроэндокринных опухолей [3]. Известно, что частота HBV-инфекции среди больных с гематологическими опухолевыми заболеваниями значительно выше, чем в популяции. Проблема реактивации вирусных инфекций при иммуносупрессии привлекла к себе внимание в последние годы в связи с появлением в клинической практике мощных иммуносупрессантов, моноклональных антител, биологических препаратов и широкого их использования в онкологии, гематологии, трансплантологии и т. д. Особенно высока вероятность реактивации HBV-инфекции при длительной цитотоксической терапии с использованием глюкокортикостероидов и ритуксимаба [3–6]. Большинство исследователей отмечают эффективность противовирусной терапии в профилактике реактивации HBV-инфекции у больных, получающих химиотерапию. В последние годы отмечено преимущество энтекавира по сравнению с другими нуклеот(з)идными аналогами (НА) в контроле реактивации вирусной инфекции у больных с В-клеточной лимфомой, получающих химиотерапевтическое лечение [7, 8]. Для пациентов с продвинутой стадией хронического гепатита В (ХГВ) – компенсированным или декомпенсированным циррозом печени – энтекавир относится к препаратам первой линии терапии [9, 10].
Реактивации HBV-инфекции: клинические и вирусологические признаки у иммуносупрессированных больных
Реактивация HBV-инфекции характеризуется повышением уровня HBV ДНК в сыворотке крови с последующим нарастанием уровня АЛТ, отражающим острое гепато-клеточное повреждение. Большинство авторов оценивают реактивацию HBV-инфекции на основании вирусологического мониторинга, так как клинические признаки острого гепатита, как правило, появляются спустя 1–11 нед после роста виремии; у ряда больных реактивация протекает бессимптомно. Кроме того, HBV ДНК у больных может снижаться вплоть до нефиксируемых уровней в период нарастания АЛТ в сыворотке крови. Поэтому мониторинг HBV ДНК проводится в динамике высокочувствительным методом ПЦР. Четкие диагностические признаки реактивации не выработаны. Ряд авторов предлагают рассматривать в качестве признака реактивации 5-кратное повышение уровня АЛТ от первоначального уровня, другие – 3-кратное. Большинство исследователей оценивают 3 признака:
– развитие гепатита с повышением уровня HBV ДНК в сыворотке крови более чем на 1 log10 копий/мл от исходного уровня;
– абсолютное увеличение вирусной нагрузки свыше 6 log10 копий/мл;
– появление HBV ДНК в сыворотке при ее отсутствии до начала химиотерапии [5, 6, 11].
Таким образом, оценка вирусной нагрузки и уровня АЛТ в динамике являются ключевыми в диагностике и мониторинге реактивации. Биопсия печени позволяет получить дополнительную важную информацию, провести дифференциальный диагноз с другими причинами поражения печени и выявить гистологические признаки HBV-инфекции.
Реактивация в большинстве случаев развивается вслед за прекращением химиотерапии, однако может появиться и в период лечения [3, 8, 11]. Как правило, обострение развивается в срок от 4 до 36 нед (в среднем через 16 нед) от начала лечения.
HBV-реактивация проходит 3 стадии. Первоначально вследствие иммунной супрессии под влиянием химиотерапии нарастает виремия, которая может быть оценена при количественном определении HBV ДНК в сыворотке. Увеличение вирусной нагрузки в крови предшествует росту АЛТ в сыворотке в среднем за 3–4 нед. На 1-й стадии реактивации у неактивных носителей HBsAg может появиться HBeAg, у больных с латентной формой инфекции, имеющих в сыворотке крови только «изолированные» суммарные HBcAb, – выявиться HBsAg и снизиться титр HBsAb [11].
На 2-й стадии происходит восстановление иммунной системы хозяина при отмене химиотерапии, что в течение нескольких недель или даже месяцев у большинства больных приводит к резкому обострению гепатита В вследствие разрушения гепатоцитов, инфицированных HBV. На этой стадии нарастает уровень АЛТ в сыворотке крови, в ткани печени развиваются массивные некрозы, которые сопровождаются выраженной желтухой, признаками декомпенсации заболевания печени и печеночно-клеточной недостаточности. Реактивация HBV-инфекции чаще протекает в виде острого вирусного или даже фульминантного гепатита с классическими признаками (слабость, анорексия, желтуха, энцефалопатия, асцит и коагулопатия), возможен летальный исход заболевания [7, 8, 11]. У некоторых больных на короткий период может снизиться уровень HBV ДНК в сыворотке крови. У отдельных больных клиническая картина реактивации HBV-инфекции проявляется рецидивом активности ХГВ с повышением активности АЛТ в 3 и более раз от исходного уровня, что фиксируется при повторном исследовании с интервалом в 5 дней. У больных с недиагностированным циррозом печени быстро развивается печеночная недостаточность, при этом уровень смертности составляет от 4 до 41%. У части больных реактивация HBV-инфекции может протекать бессимптомно, с повышением уровня HBV ДНК в сыворотке крови, но при отсутствии клинических проявлений острого гепатита или обострения ХГВ.
На 3-й стадии наступает реконвалесценция, отмечается клиническое разрешение гепатита и возврат к исходным маркерам HBV. У больных с тяжелым течением 2-й стадии реактивации реконвалесценция может не наступить, у них сохраняется клиника ХГВ с нарушением печеночно-клеточной функции [11].
Дифференциальная диагностика реактивации HBV-инфекции
Острое повреждение печени может быть индуцировано HBV-генотипическими мутациями, например precore-мутациями или мутациями ДНК-полимеразы. Для верификации реактивации HBV-инфекции необходимо исключить другие причины острого гепатита, в том числе суперинфекцию гепатотропными вирусами [например, гепатитов А, С и D, цитомегаловирусом, вирусами простого герпеса (HSV) 1-го и 2-го типа, опоясывающего герпеса (VZV), Эпштейна-Барр или аденовируса). Суперинфекция вирусами гепатита D у HBsAg-носителей, гепатита С и даже А является причиной 20–30% острых гепатитов у больных, получающих химиотерапию. Химиотерапевтические агенты могут вызывать лекарственное поражение печени и синдром обструкции синусоидов (веноокклюзионную болезнь – ВОБ). Следует также исключать реакцию отторжения трансплантата у больных после трансплантации органов и костного мозга и наличие опухолевого поражения печени в рамках основного заболевания (табл. 1). Причинами развития дисфункции печени могут стать пелиоз и стеатоз печени, нодулярная регенераторная гиперплазия (НРГ). Следует исключать и экзогенные факторы: злоупотребление алкоголем, длительное парентеральное питание, а также обострение некалькулезного холецистита, радиационную токсичность. До 12% случаев повышения уровня АЛТ в сыворотке крови остаются нераспознанными.
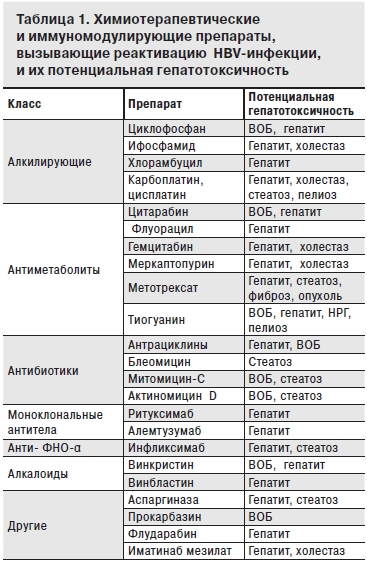
Реактивация HBV-инфекции повышает риск смертности от фульминантной печеночной недостаточности и преждевременного прекращения противоопухолевого лечения (21–53% носителей HBsAg), что снижает общую выживаемость больных с лимфомами, получающих химиотерапию [12, 13]. Отсутствие настороженности в отношении возможного инфицирования HBV у больных с гематологическими заболеваниями обусловливает трудности оценки причин декомпенсации печеночного процесса, развивающегося, как правило, в течение нескольких недель химиотерапии. Позднее назначение противовирусной терапии может стать причиной фатального прогноза, несмотря на лечение [8, 11, 14–16]. В период реактивации у части больных отмечается рост альфа-фетопротеина, что требует проведения дифференциального диагноза с гепатоцеллюлярной карциномой. Явную и скрытую HBV-инфекцию часто пропускают на стадии, когда профилактическая противовирусная терапия НА может предотвратить серьезные осложнения ее реактивации [15, 16]. Следует отметить, что реактивация HBV отмечается не только у больных хроническим HBeAg-положительным или HBeAg-отрицательным гепатитом В при наличии в сыворотке крови HBsAg и HBV ДНК, но и на стадии неактивного носительства HBsAg или латентной HBV-инфекции.
Неактивное носительство HBsAg – самая частая форма хронической HBV-инфекции. Ее обнаруживают у 60–70% лиц с HBsAg в крови. Для него характерны стойко нормальный уровень трансаминаз, отсутствие H BeAg и наличие HBeAb в сыворотке крови, низкий уровень виремии (HBV ДНК в сыворотке крови < 2000 МЕ/мл или < 10000 копий/мл), минимальные признаки активности печеночного процесса по данным биопсии печени (индекс гистологической активности < 6 баллов по шкале Knodell или Ishak). Данная категория больных имеет благоприятный прогноз (очень низкий риск прогрессирования заболевания и развития цирроза печени, гепатоцеллюлярной карциномы, печеночной летальности) и, как правило, не нуждается в противовирусной терапии. Стойко нормальный уровень АЛТ в течение длительного периода наблюдения и низкая вирусная нагрузка снижают настороженность врача в отношении таких больных, однако под влиянием химиотерапии возможна реактивация HBV и развитие острого гепатита тяжелого течения с печеночно-клеточной недостаточностью. Частота реактивации HBV-инфекции у неактивных носителей HBsAg при химиотерапии составляет, по данным разных исследователей, от 14 до 72%. Смертность в этой группе больных может достигать 5–52% [11]. Поражение печени, развивающееся в ходе иммуносупрессивной терапии у HBV-инфицированных больных, обусловлено прямым цитопатическим действием вируса: усиленный синтез вирусных антигенов, прежде всего HBsAg, приводит к их избыточному накоплению в цитоплазме клеток печени с последующей дистрофией, некрозом гепатоцитов и развитием в отдельных случаях тяжелого холестатического поражения печени – фиброзирующего холестатического гепатита В. Тяжелое поражение печени, но с преобладанием синдрома цитолиза, наблюдается и при резкой отмене иммуносупрессивной терапии, когда в ответ на повышенную экспрессию вирусных антигенов на поверхности гепатоцитов происходит иммунный лизис гепатоцитов цитотоксическими лимфоцитами – синдром «рикошета» [4, 11].
Латентная HBV-инфекция, при которой в отсутствие HBsAg в сыворотке крови единственными маркерами вирусной инфекции являются антитела к антигенам вируса, прежде всего «изолированные» HBcAb класса IgG (суммарные), характеризуется также наличием HBV в ткани печени и очень низким (часто неопределяемым) уровнем HBV ДНК [12–14, 16]. Состояние супрессии вирусной репликации и экспрессии генов – типичный статус латентной HBV-инфекции, который может быть нарушен с развитием острого гепатита В (нередко фульминантного течения) у больных, получающих иммуносупрессивную терапию [15, 16]. Многочисленные исследования [16–19] свидетельствуют о низком (менее 2%) риске реактивации в этой группе больных. В двух проспективных исследованиях частота реактивации HBV у HBsAg-негативных больных с лимфомой, получавших лечение по схемам, включающим ритуксимаб, составила от 4,1 до 11,8% [20, 21]. Реактивация HBV-инфекции у больных с латентной инфекцией, у которых в сыворотке крови присутствуют HBcAb класса IgG и HBsAb, протекает по варианту «обратной сероконверсии» HBsAb в HBsAg с редким развитием острого гепатита В [8, 22, 23]. Частота обратной сероконверсии достигает 40% после 2 лет и 70% после 5 лет наблюдения за больными с латентной HBV-инфекцией после пересадки костного мозга в условиях длительной иммуносупрессии [23].
Вирусологическая и клиническая реактивация латентной HBV-инфекции отмечена при ряде клинических состояний (гематологические злокачественные заболевания, ВИЧ-инфекция, трансплантация костного мозга, печени, сердца и почек, солидные опухоли, при которых применяется цитостатическая и иммуномодулирующая терапия) [24–26]. Понятно, что для диагностики реактивации HBV-инфекции в первую очередь необходима диагностика самой HBV-инфекции перед началом химиотерапии у онкологических и гематологических больных на основании расширенного исследования всех маркеров вируса (HBsAg, HBeAg, HBsAb, HBeAb, HBcAb суммарных), а также качественного и количественного исследования HBV ДНК, уровня АСТ и АЛТ в сыворотке крови в динамике не реже одного раза в 1–3 мес.
Факторы риска реактивации HBV-инфекции у онкологических больных
Факторы риска определяются вариантом злокачественного заболевания и, особенно, проводимой химиотерапией. Гематологические заболевания, ассоциированные с реактивацией HBV-инфекции, представляют широкий спектр (табл. 2).
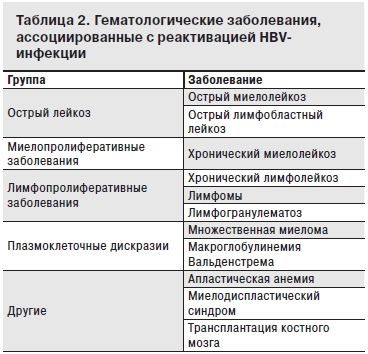
Исследования последних лет показали, что стадия развития В-клеточной лимфомы является фактором риска реактивации HBV-инфекции [7, 27], который определяется также уровнем вирусной нагрузки. Отмечено, что виремия > 105 копий/мл является таким же важным фактором риска, как и серологический профиль больного [14, 27]. Больные c HBsAg в сыворотке крови имеют самый высокий риск, в то время как больные с HBsAb > 10 МЕ/л относятся к группе самого низкого риска. HBeAg-положительные больные, в прошлом относившиеся к группе лиц с высокой вирусной нагрузкой, в настоящее время оцениваются по уровню виремии. Риск реактивации у больных без HBeAg, но с HBeAb в сыворотке крови также оценивают на основании изучения уровня вирусной нагрузки. Даже у больных с клиренсом HBsAg и сероконверсией в HBsAb о статочная HBV ДНК в виде cccДНК сосредоточена в гепатоцитах и может стать основой для реактивации вслед за иммуносупрессией. Более того, HBV ДНК может находиться в мононуклеарных клетках периферической крови, являющихся вторым после печени резервуаром HBV-инфекции. Единственным маркером этого состояния могут быть « изолированные» HBcАв в отсутствие HBV ДНК в сыворотке крови [14]. Интересным представляется наблюдение R. Ferreira и соавт. [8] реактивации HBV-инфекции у 78-летней больной с крупноклеточной В-лимфомой и изолированными HBsAb в сыворотке крови. С 2004 г. после 8 курсов химиотерапии циклофосфаном, винкристином, преднизолоном и достижения полной ремиссии лимфомы больная перенесла еще 3 рецидива, последовательно леченных по программам R-CHOP (ритуксимаб, циклофосфан, винкристин, адриамицин, преднизолон), CHOP и М-BACOD (блеомицин, адриамицин, циклофосфан, винкристин, дексаметазон, метотрексат). При обследовании перед химиотерапией HBsAg и HBcAb не выявлялись, в дальнейшем при лечении рецидивов лимфомы их не оценивали. В 2011 г. при позитронно-эмиссионной томографии (ПЭТ) была подтверждена полная ремиссия заболевания, однако спустя 40 дней после окончания последнего курса химиотерапии больная госпитализирована в связи с появлением желтухи, кожного зуда, повышением АСТ до 2804 Ед/л, АЛТ до 2935 Ед/л, 2-кратным повышением уровня ЩФ и 4,5-кратным – ГГТП. Общий билирубин – 367 ммоль/л, прямой – 242 ммоль/л. В сыворотке крови выявлены HBsAg, HBsAb, HBcAb, HBcAb IgM, тесты на HBeAg и HBeAb, а также HAV-Ab IgM, EBV-Ab, CMV-Ab, HSV ., HCV-Ab, ВИЧ-Ав – отрицательные. HBV ДНК 2,4 х 103 МЕ/мл. Несмотря на лечение энтекавиром (0,5 мг в день) и значительное снижение уровней АСТ и АЛТ сохранялись низкие показатели протромбина, присоединилась печеночная энцефалопатия. На 27-й день развития клинических симптомов реактивации наступила смерть больной от печеночной недостаточности.
Таким образом, необходимо принимать во внимание любой признак HBV-инфекции как потенциальный маркер возможной реактивации инфекции у иммунокомпроментированных больных. Среди других факторов отмечают лечение кортикостероидами и ритуксимабом в монотерапии или в комбинации с другими иммунодепрессантами, применение антрациклинов, циклофосфана, молодой возраст и мужской пол. 39% всех опубликованных наблюдений реактивации HBV-инфекции отмечены у больных с лимфомой при лечении ритуксимабом. При этом летальность от печеночно-клеточной недостаточности составила 52% [11, 19, 20, 23, 28].
Наш опыт наблюдения и лечения реактивации HBV-инфекции у больных с В-клеточными лимфомами насчитывает более 10 лет [4]. В двух наблюдениях химиотерапии лимфомы у больных с неактивным носительством HBsAg проводили лечение ламивудином уже на фоне развернутой реактивации HBV-инфекции. Более тяжелое ее течение при иммуносупрессии В-клеточной лимфомы отмечается у больных ХГВ с определяемой HBV ДНК в сыворотке крови.
Мы наблюдали больную 19 лет, у которой в 2006 г. во время беременности впервые выявлены HВsAg, низкий уровень HBV ДНК в сыворотке крови и нормальный уровень трансаминаз. Диагностирован HBeAg-отрицательный ХГВ с низким уровнем виремии и нормальным уровнем трансаминаз. После родов в связи с обострением ХГВ в течение 6 мес больная получала зеффикс (ламивудин) в дозе 100 мг ежедневно. После достижения авиремии препарат был отменен. В поликлинике по месту жительства предпринята также попытка лечения иммуномодуляторами (циклофероном и неовиром) курсами в течение следующих 6 мес без вирусологического контроля. В феврале 2008 г. отмечено резкое ухудшение состояния: выраженная слабость, стойкая лихорадка 39–40 °С, увеличение подмышечных лимфоузлов и появление узловатых образований в мягких тканях по ходу костей скелета. При обследовании в РОНЦ диагностирована В-клеточная лимфома. С мая по август 2008 г. больной проводили химиотерапию, а затем с сентября по октябрь 2008 г. – курс лучевой терапии с положительным эффектом. Впервые проконсультирована в клинике им. Е.М. Тареева в июне 2008 г. Было рекомендовано весь период химио- и лучевой терапии и в течение 6 мес после их окончания принимать зеффикс в дозе 100 мг ежедневно для профилактики реактивации HB-инфекции. После окончания курса лучевой терапии в октябре 2008 г. по совету онколога пациентка прекратила приём препарата. В декабре 2008 г. появились слабость, недомогание. В анализах от 29.12.08 уровень АЛТ и билирубина в норме, однако отмечена высокая репликация вируса: HBV ДНК 8,0 х 107 МЕ/мл. При повторном биохимическом анализе 15.01.09 отмечено нарастание уровня трансаминаз и билирубина, сопровождающееся сонливостью, анорексией. Повторно проконсультирована в клинике 27.01.09: отмечены выраженная желтуха, слабость, явления печеночной энцефалопатии, асцит. По «скорой» госпитализирована в КИБ № 2 в тяжелом состоянии. При поступлении жалобы на сильную слабость, тошноту, рвоту, отвращение к пище. Больная вялая, заторможенная, на вопросы отвечала односложно. Отмечен выраженный тремор кистей рук, резкая желтушность кожных покровов, склер, единичные геморрагии на коже груди, передней брюшной стенке, асцит. АД – 110/70 мм рт. ст., ЧСС – 96 в мин. В анализах: повышение уровня АЛТ до 1701 Ед/л (норма – до 55 Ед/л), АСТ – 745 Ед/л (норма – до 34 Ед/л), общего билирубина – до 336 мкмоль/л (норма – до 20,5 мкмоль/л), прямого билирубина – до 164 мкмоль/л ( норма – до 8,6 мкмоль/л), снижение протромбинового индекса до 29%, содержание общего белка – 48 г/л. Больной срочно, при поступлении, был назначен эпивир (ламивудин) в суточной дозе 150 мг, свежезамороженная плазма – 800 мл (в дальнейшем по 250 мл ежедневно до стабилизации лабораторных показателей), дезинтоксикационная терапия под контролем кислотно-щелочного состояния и диуреза, верошпирон – 150 мг/сут, лактулоза – до 100 мл/сут в четыре приёма, гепа-мерц – 30 г 2 раза в день внутривенно. Состояние больной на протяжении 3 дней оставалось тяжёлым, но уже к 3 -м с уткам противовирусной и симптоматической терапии отмечено повышение уровня протромбинового индекса до 48 %. Одновременно уровень АЛТ снизился до 449 Ед/л, АСТ – до 150 Ед/л. Сохранялась желтуха (общий билирубин – 394 мкмоль/л, прямой – 190 мкмоль/л), слабость. Состояние больной улучшилось к 5-му дню лечения: появился аппетит, исчезли тошнота, рвота, тремор, геморрагии на коже, протромбиновый индекс повысился до 61%. Асцит купирован на 16-й день лечения. Ко дню выписки (02.03.09) показатели нормализовались: АЛТ – 24 Ед/л, АСТ – 43 Ед/л, общий билирубин снизился до 66 мкмоль/л, прямой – до 33 мкмоль/л, протромбиновый индекс – 92 %. HBV ДНК «–». Больная в удовлетворительном состоянии выписана из стационара с рекомендацией длительно принимать ламивудин по 100 мг/сут в связи с тяжестью поражения печени и наличием ХГВ до начала химиотерапии. В сентябре 2009 г., после 7 мес приема ламивдина, в связи с появлением виремии и развитием резистентности к препарату переведена на приём энтекавира в дозе 1 мг/сут. Приём препарата больная продолжает до настоящего времени. Достигнута стойкая авиремия, наблюдение за больной продолжается.
Таким образом, профилактическое назначение нуклеозидного аналога в первый месяц химиотерапии способствовало контролю реактивации HBV-инфекции у больной, получавшей ламивудин на протяжении всего периода химио- и лучевой терапии. Отмена противовирусного лечения в конце лучевой терапии без учета имевшего место обострения ХГВ после родов привела к развитию холестатического варианта ХГВ фульминантного течения с тяжелой печеночно-клеточной недостаточностью и печеночной энцефалопатией. Противовирусная терапия ламивудином и интенсивная симптоматическая терапия позволили изменить прогноз заболевания и восстановить синтетическую функцию печени, однако при наличии у больной ХГВ, который лечили ламивудином в прошлом и в период реактивации HBV-инфекции, быстро (через 7 мес лечения) развилась резистентность к проводимой терапии, потребовавшая назначения повышенной (1 мг/сут) дозы энтекавира.
Профилактика и лечение реактивации HBV-инфекции у больных с лимфомой и наличием маркеров HBV-инфекции
Первым шагом в профилактике реактивации HBV-инфекции является скрининг на маркеры HBV всех пациентов перед химиотерапией, особенно больных группы повышенного риска: жителей эндемичных по гепатиту В регионов, лиц, родившихся в регионах с распространенностью HBsAg ≥ 8%, употреблявших наркотики, находившихся на гемодиализе, ВИЧ-инфицированных, гомосексуалистов [4, 6, 14]. Так как не всегда удается уточнить группу риска по гепатиту В, необходимо исходить из правила, что все больные, у которых планируется проведение химиотерапии, должны быть обследованы на маркеры HBV. Данное рутинное обследование рекомендовано в США с 2008 г. всем больным с опухолевыми заболеваниями, которым предстоит или уже проводится иммуносупрессивная и химиотерапия, особенно если лечение включает моноклональные антитела и биологические препараты. Скрининг включает исследование HBsAg и HBcAb. Основная профилактика реактивации HBV заключается в вакцинации против гепатита В серонегативных больных со злокачественными опухолями. Больным, не имеющим в крови маркеров H BV, в с вязи с отсутствием времени для полноценной вакцинации в режиме 0–1–6 мес рекомендуется вакцинация двумя дозами с интервалом в 3–4 нед. Третью дозу следует вводить через несколько месяцев после окончания химиотерапии [14]. При таком режиме вакцинации положительные результаты достигнуты у 57% больных с гематологическими злокачественными заболеваниями, у 15–68% больных, которым проводилась трансплантация костного мозга, и в 10% случаев при остром лимфобластном лейкозе [14]. Больные, у которых выявляется HBsAg, должны быть дополнительно обследованы на наличие HBeAg, HBeAb и уровень HBV ДНК. HBsAg-отрицательных больных, у которых в сыворотке крови обнаружат HBcAb, необходимо обязательно обследовать на наличие HBsAb. При отсутствии HBsAb в сыворотке крови следующим шагом является выявление HBV ДНК, так как у этих больных отсутствует иммунитет против HBV и возможно наличие латентной HBV-инфекции. Определение вирусной нагрузки и уровня АЛТ является ключевым в диагностике и мониторинге реактивации HBV. Следует учитывать, что реактивация может протекать транзиторно, бессимптомно и у отдельных больных заканчивается спонтанной ремиссией [14]. В современных рекомендациях отдается предпочтение терапии НА до начала химиотерапии с целью профилактики поражения печени. Длительность терапии НА определяется степенью иммуносупрессии и может быть продолжительной. Профилактику реактивации у HBsAg- положительных больных нужно начинать как можно раньше перед началом иммуносупрессии опухоли. При высокой (> 2000 МЕ/мл или > 10 000 копий/мл) вирусной нагрузке и повышении уровня АЛТ в сыворотке крови противовирусную терапию необходимо начинать незамедлительно!
Противовирусные препараты в лечении реактивации HBV
Среди широко применяемых в лечении ХГВ НА (ламивудин, телбивудин, адефовир, энтекавир, тенофовир) ламивудин имеет наибольший (с 2000 г.) опыт применения, характеризуется хорошим профилем эффективности, отсутствием нежелательных явлений терапии и дает положительные результаты при лечении как гематологических, так и солидных опухолей [28–33]. Высокий риск развития резистентности к терапии ламивудином обусловил дифференцированный подход к назначению противовирусных препаратов у больных с лимфомой и наличием маркеров HBV в сыворотке крови [10, 14]. HBsAg-положительным больным, получающим химиотерапию или иммуносупрессивные препараты (в том числе ритуксимаб в комбинации с глюкокортикостероидами), НА следует назначать профилактически за 1–3 нед до начала химиотерапии и не позднее 1-го дня лечения [10, 14, 23, 34–36]. Оптимальная длительность лечения не определена, однако Европейское сообщество гепатологов с 2012 г. рекомендует проводить профилактическое лечение НА в течение всего периода химиотерапии, независимо от уровня вирусной нагрузки, и 12 мес после ее окончания [10]. Для больных ХГВ длительность лечения НА не определена, так как у большинства из них после прекращения приема противовирусных препаратов развивается обострение заболевания. Понятно, что высокая вирусная нагрузка до начала химиотерапии определяет риск реактивации HBV-инфекции после прекращения противовирусного лечения [37]. У больных с низкой (< 2000 МЕ/мл) вирусной нагрузкой и непродолжительной химиотерапией предпочтение отдается ламивудину. Его профилактическое назначение снижает риск реактивации с 25–85% до 0–9% [14]. Развитие в ходе лечения YMDD-мутантных штаммов гена HBV-полимеразы, резистентных к ламивудину, ограничивает, однако, эффективность длительной терапии этим препаратом, что мы отметили в нашем наблюдении, когда через 7 мес повторного приема ламивудина возникли рецидив виремии и необходимость смены препарата. Известно, что после 1-го года лечения ламивудином резистентность развивается у 24% больных, в течение 5 лет лечения – у 65–70%. Пациентам с высокой (> 2000 МЕ/мл) вирусной нагрузкой, которым предстоят длительная химиотерапия и повторные курсы лечения, следует назначать препараты с мощным противовирусным действием и высоким барьером развития резистентности – энтекавир и тенофовир [7, 8, 10, 37]. HBsAg-отрицательные больные с HBcAb в сыворотке крови должны быть обследованы на наличие HBV ДНК. При обнаружении у пациентов ДНК HBV следует проводить лечение по правилам, принятым для больных с HBsAg. При отсутствии HBV ДНК в сыворотке крови, независимо от наличия или отсутствия HBsAb, необходим тщательный мониторинг АЛТ и HBV ДНК каждые 1–3 мес в зависимости от типа иммуносупрессии и сопутствующих заболеваний. При появлении виремии (выявлении HBV ДНК в сыворотке крови) необходимо назначать НА до повышения уровня АЛТ. Некоторые эксперты советуют в сем H BsAg-отрицательным и HBcAb-положительным больным, получающим ритуксимаб в моно- или комбинированной терапии по поводу гематологических опухолевых заболеваний, проводить профилактическое лечение ламивудином, особенно если отсутствуют HBsAb или невозможно осуществить регулярный контроль за уровнем HBV ДНК в сыворотке крови [10]. HBsAg-отрицательным и HBcAb-положительным больным, которым предстоит длительная (свыше 1 года) противовирусная терапия НА, рекомендуется назначать препараты с низкой частотой развития резистентности и высоким генетическим барьером появления мутаций, такие как энтекавир и тенофовир, представляющих первую линию препаратов для лечения ХГВ [7, 29, 30, 37].
Энтекавир относится к новым лекарственным препаратам из группы НА, быстро превращается в клетке в активную форму, подавляющую репликацию HBV на всех этапах. Исследования свидетельствуют о его хорошей переносимости, высоком профиле безопасности, более высокой, чем у ламивудина эффективности и отсутствии резистентности через 2 года приема у больных, ранее не лечившихся НА [7, 37]. В последние годы энтекавир стал препаратом первой линии в лечении ХГВ во всем мире [5, 6, 9]. H.R. Li с соавт. [7] провели сравнительное исследование эффективности профилактического применения у больных с лимфомой энтекавира (34 больных) и ламивудина (89 больных) для предотвращения реактивации HBV-инфекции. Клинические признаки в двух когортах больных были сопоставимы по полу, возрасту, стадии болезни, варианту лечения, частоте поражения печени в рамках основного заболевания и в рамках H BV-инфекции и серологическому профилю маркеров HBV (у 96,6% больных, получавших ламивудин, и у 94,1% больных, получавших энтекавир, HBsAg выявлялся в сыворотке крови до начала химиотерапии). В группе больных, получавших энтекавир, по сравнению с больными, получавшими ламивудин, значительно реже отмечались развитие острого гепатита (соответственно 5,9 и 27%; р=0,007), признаки реактивации гепатита В по данным вирусологического контроля (0 и 12,4%; р=0,024) и прекращение химиотерапии (5,9 и 20,2%; р=0,042). Авторы сделали заключение, что у больных с III–IV стадией В-клеточной лимфомы, получающих химиотерапию, в профилактике реактивации HBV энтекавир более эффективен, чем ламивудин. Отмечена также зависимость клинической тяжести реактивации HBV-инфекции от уровня вирусной нагрузки: у больных с более высокими показателями HBV ДНК в сыворотке крови до начала химиотерапии чаще развивался острый гепатит. Установлено, что у больных с ранней стадией опухолевого заболевания курс химиотерапии, как правило, относительно короткий, поэтому назначение ламивудина для профилактики реактивации HBV-инфекции в этом случае оправдано. Для больных с продвинутой стадией В-клеточной лимфомы и планируемым длительным лечением энтекавир является препаратом выбора, его нужно рассматривать как препарат первой линии профилактической терапии [7]. В исследовании H.R. Li и соавт. все больные, у которых развилась реактивация HBV-инфекции, имели III–IV стадию В-клеточной лимфомы. Учитывая, что резистентность к энтекавиру чаще развивается при наличии резистентности к ламивудину, рекомендуется начинать профилактическое лечение этой группы больных с энтекавира. Продемонстрирована также эффективность энтекавира у больных, резистентных к ламивудину [7, 37].
Таким образом, явная или скрытая (латентная) HBV-инфекция является серьезной проблемой для больных с гематологическими опухолями. Скрининг HBV-инфекции у этих больных, относящихся к группе риска реактивации вирусной инфекции при проведении химиотерапии, является обязательным для всех клиницистов, практикующих лечение злокачественных опухолевых заболеваний. Противовирусная терапия НА позволяет изменить прогноз у больных, получающих химиотерапию. Профилактика реактивации HBV-инфекции энтекавиром снижает смертность среди больных с онко-гематологическими заболеваниями, особенно с продвинутыми стадиями болезни, обеспечивает интенсивность курсов химиотерапии, снижает риск отказа от химиотерапевтического лечения и препятствует развитию острого HBV-ассоциированного гепатита.


