Гепатит С (ГС) — одна из актуальных научно-медицинских проблем, обусловленная высокой (70–80%) частотой формирования хронических форм заболевания и развитием неблагоприятных исходов, приводящих к инвалидизации [1–6]. По прогнозам ВОЗ, в ближайшие два десятилетия хронические гепатиты станут основной проблемой национальных органов здравоохранения. В мире зарегистрировано около 250 млн человек с HCV-инфекцией, в РФ — не менее 2 млн. В настоящее время это заболевание рассматривается как своеобразный индикатор социального и медицинского благополучия общества [1, 5—8]. Проведенные к настоящему времени исследования свидетельствуют, что клиническая картина хронической инфекции, вызванной ГС, складывается из процессов, происходящих в печени, и признаков поражения других органов и систем, так называемых внепеченочных проявлений. У 91% больных с длительностью заболевания более 5 лет выявлялись его четкие клинико-лабораторные признаки: увеличение размеров печени и селезенки, астено-вегетативный синдром, сопровождающиеся длительным сохранением активности процесса и виремией или сменой периодов активности и ремиссии, независимо от продолжительности заболевания [1, 8]. По данным Т.В. Чередниченко и соавт., у 79% больных хроническим гепатитом С (ХГС) в течение 5–10 лет заболевание протекало с сохранением активности процесса (в 65% случаев низкой и минимальной степени), у всех отмечалось фиброзирование ткани печени (у 65% слабовыраженное). В то же время у 20—30% больных ХГС показатель АлАТ в сыворотке крови не отличался от нормы [5, 9].
У 40—91% взрослых, больных ХГС, регистрируется широкий спектр внепеченочных поражений [6, 10—13]. В их патогенезе главную роль играет взаимоотношение факторов хозяина и вируса. Факторы хозяина (генетические предпосылки, возраст, исходное состояние противовирусного иммунитета) определяют возможность элиминации вируса или его персистенции, продукцию антигенов и характер иммунного ответа на них. НСV-инфекция протекает с нарушением клеточного и гуморального звена иммунитета, при этом определяется специфический ответ на структурные и неструктурные антигены НСV [14] .
Исследования особенностей функционирования иммунной системы у пациентов с различными аутоиммунными и внепеченочными проявлениями ХГС привели к формированию представления о нем, как о заболевании, сопровождающемся глобальной иммунной дисрегуляцией, затрагивающей как Т- так и В-клеточный иммунный ответ [15—19].
К основным причинам аутоиммунной патологии, развивающейся на фоне ХГС, можно отнести:
– хроническую стимуляцию большим количеством генетически различных и постоянно изменяющихся антигенов, что обусловлено наличием квазивидовых популяций в организме одного хозяина [20];
– способность НСV инфицировать и размножаться в различных тканях (внепеченочная репликация), что может приводить к иммунной атаке последних. Проникновение вируса в клетки хозяина осуществляется, в частности, через связывание с рецептором CD81, который присутствует на поверхности гепатоцитов и многих других клеток, включая В-лимфоциты и клетки щитовидной железы [21, 22];
– расширение эпитопа (epitope spreading) — механизм, лежащий в основе многих аутоиммунных состояний, при котором в результате хронической антигенной стимуляции иммуногенные эпитопы, отличные от индуцирующих эпитопов, становятся основными мишенями иммунного ответа [23];
– прямое дисрегулирующее воздействие НСV на В-клетки, связанное со способностью вируса проникать и активно размножаться в В-лимфоцитах, приводя, помимо прочего, к нарушению экспрессии многих генов и гипермутациям в различных регионах ДНК. Вероятно, именно этот механизм определяет часто наблюдающуюся генерализованную и клональную экспансию В-клеток, а в отдельных случаях ведет к их лимфобластоидной трансформации. Установлено, также, что НСV обладает выраженной стимулирующей (как антигензависимой, так и антигеннезависимой) активностью в отношении В-клеток, снижая их порог активации более чем в 100 раз [24, 25].
– снижение супрессорной активности Т-регуляторных клеток (CD4+, CD25+) в отношении В-лимфоцитов у НСV-инфицированных лиц [26].
Все это побуждает В-клетки к продукции большого количества низко специфичных, перекрестно реагирующих антител, циркуляция которых в организме приводит к появлению иммунных комплексов и развитию реакций гиперчувствительности различного типа, повреждающих органы и ткани хозяина.
Кроме того, нарушения функционирования Т-клеточного звена иммунной системы ведет к агрессии цитотоксических лимфоцитов в отношении различных тканей, в частности эндокринных [22].
Реакция гиперчувствительности замедленного типа обуславливает появление в органах и тканях лимфомакрофагальных инфильтратов и иногда гранулематоза. В спектр внепеченочных поражений при HCV-инфекции входят смешанная криоглобулинемия, узелковый полиартериит, В-клеточная неходжкинская лимфома, синдром Шегрена, сахарный диабет 2-го типа, аутоиммунный тиреоидит, поздняя кожная порфирия (спорадическая форма), тубулоинтерстициальный нефрит [12, 16, 19, 22].
Особую группу при инфицировании HCV составляют аутоиммунные патологии крови: иммунные цитопении, периферическая панцитопения, гемолитическая анемия, гипопластическая анемия. Известен ряд других поражений крови, обусловленных лимфотропностью этого вируса: моноклональная иммуноглобулинопатия и злокачественная лимфопролиферация.
По данным В.В. Серова и соавт. [8], ХГС у взрослых пациентов в 63,4% случаев протекает с печеночными проявлениями, в 20,0% — с внепеченочными (однако в дальнейшем у них могут появляться и печеночные проявления), в 4,7% — с сочетанием тех и других проявлений, а у 11,9% больных и печеночные, и внепеченочные клинические проявления отсутствуют, отклонения наблюдаются только в лабораторных анализах.
Подобных исследований по изучению течения ХГС у детей с внепеченочными проявлениями в доступной литературе нам встретить не удалось.
Цель работы — установить частоту внепеченочных проявлений у детей с HCV-инфекцией и особенности течения заболевания на основе сопоставления клинических симптомов, уровня вирусной нагрузки, генотипа вируса и иммунного ответа.
Материалы и методы
В период с 2005 по 2010 г. в клинике вирусных гепатитов НИИ детских инфекций были обследованы 68 детей, больных ХГС, в возрасте от 10 до 18 лет. Продолжительность болезни составляла более 10 лет.
Этиология заболевания была подтверждена на основании комплексного обследования путем определения антигенов вирусов гепатитов (НВsAg), и специфических антител к ним в крови: анти-HСV и антител к структурным и неструктурным белкам (cor, NS3, NS4, NS5) методом ИФА на тест-системах второго поколения «Аквапаст» (НИИЭМ им. Пастера, Санкт-Петербург) в лаборатории этиологических методов исследования. Клинико-лабораторное обследование детей проводили амбулаторно 2—3 раза в год. При объективных осмотрах больных обращали внимание не только на общепринятые проявления гепатита, но и на выявление экстрапеченочных знаков и системных проявлений заболевания. Всем детям осуществляли УЗИ печени на аппарате Shimasonic-SLD 310. Активность вирусного процесса устанавливали по наличию и уровню РНК HCV в ПЦР, которую выполняли по стандартной методике на тест-системах «АмплиСенс» (Центральный НИИ эпидемиологии Роспотребнадзора, Москва) в лаборатории генной инженерии и молекулярной вирусологии НИИ гриппа РАМН. Уровень цитокинов IL-4, ИФН-γ и ИФН-a определяли в сыворотке крови методом твердофазного ИФА c помощью наборов ТОО «Полигност», ООО «Протеиновый контур» и «Цитокин». Обследование для выявления уровня криоглобулинов в сыворотке крови проводили у всех больных. Для этого образцы крови больных забирали в подогретые до 37—39 °С пробирки типа вакутайнер и доставляли в лабораторию в термостате при 37 °С в течение 2 ч. После полного свертывания крови сыворотку отделяли центрифугированием (1200 об/мин, 10 мин) при 37 °С. Затем сыворотку инкубировали при 4 °С в течение 7 дней в трубках для определения гематокрита и повторно центрифугировали (1500 об/мин, 10 мин) при 4 °С. Криокрит (отношение объема криопреципитата ко всему объему сыворотки) определяли визуально с точностью до 1%. Для контроля чистоты исследования криопреципитат повторно растворяли нагреванием до 37 °С, а также параллельно забирали кровь в вакутайнеры с цитратом натрия с последующим проведением всех этапов исследования. Определение уровней аутоантител [антител к гладкой мускулатуре (ASMA), антимитохондриальных антител (AMA), антинуклеарных антител (ANA)] выполняли методом непрямой иммунофлюоресценции [набор реагентов ATS COMVI-1 IMMCO Diagnostic (США)], а уровня антител к микросомам печени и почек 1-го типа (LKM-1) — методом твердофазного ИФА [набор реагентов Ymmulisa Anti-Liver Kindly Microcomal (anti-LKM-1) Antibode ELAISA JMMCO Diagnostic (США)]. Обследование проводили в лаборатории диагностики аутоиммунных заболеваний.
В статье приведены данные исследований течения ХГС с внепеченочными проявлениями у взрослых пациентов, проведенных академической группой акад. РАМН В.В. Серова и сотрудниками кафедры терапии и профессиональных болезней Московской медицинской академии им. И.М.Сеченова, проводимые с конца 80-х до начала 2000-х годов.
Статистическую обработку полученных данных осуществляли с помощью пакета прикладных программ Microsoft Exel 2000, StatSoft Statistica v 6.0 с использованием параметрических и непараметрических методов вариационной статистики.
Результаты и обсуждение
Результаты проведенных исследований показали, что у детей с длительным сроком инфицирования ХГС в 86,8% случаев протекает с поражением только печени, а в 13,2% случаев — как с печеночными, так и с внепеченочными проявлениями.
Гендерные отличия в данном исследовании были типичными для больных ХГС: в группе больных без внепеченочных проявлений преобладали мальчики, а системные изменения чаще регистрировались у девочек. Возраст больных варьировал от 10 до 18 лет, в среднем составляя 12,6 ± 4,8 лет (табл. 1).
* — достоверность различий между сравниваемыми группами, p<0,05.
Течение заболевания у наблюдаемых больных было малосимптомным и медленно прогрессирующим. Самочувствие у детей практически не нарушалось, жалобы астенического характера выявляли лишь при целенаправленном опросе. Основными симптомами заболевания были диспепсический синдром (33,8%), увеличение печени (82,3%) и гиперферментемия (27,9%). Однако с увеличением длительности болезни с 5 до 10 лет достоверно чаще регистрировали астеновегетативный (с 27,9 до 63,2%) и геморрагический (с 8,8 до 30,8%) синдромы, а также патологию гастродуоденальной зоны, желчевыводящих путей и поджелудочной железы (с 10,3 до 32,4%). Уровень активности ферментов у подавляющего большинства (61,7%) больных не отличался от нормы, а у остальных был минимальным или низким, но не у всех сохранялась длительная стабильность процесса. У 22% пациентов фаза ремиссии сменялась фазой репликации с биохимической активностью от минимальной до умеренно выраженной и наоборот. Минимальные нарушения белково-синтетической функции печени были выявлены у 11 (22,2%) больных.
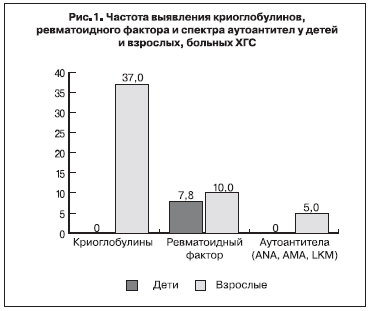
Внепеченочные проявления были лишь у 13,2% детей, длительно болеющих ХГС, что существенно реже, чем у взрослых, у которых средняя распространенность составляет 44% (р<0,05). У детей преобладали поражение щитовидной железы (5,3%), кожные высыпания (3,6%) и артралгии (7,1%). Синдром криоглобулинемии, ANA- и AMA-фактор, анти-LKM не были найдены ни у одного ребенка, тогда как у взрослых они выявляются в 12% случаев. В то же время, ревматоидный фактор определялся с одинаковой частотой как у детей, так и у взрослых — соответственно в 7,8 и 10% случаев. По данным исследователей, изучавших внепеченочные проявления у взрослых, именно появление и увеличение уровня ревматоидного фактора сопряжено с регистрацией внепеченочных проявлений у больных ХГС (рис.1).
Вирусологические исследования показали, что репликация вируса имела место у 82,4% больных, причем у 54,5% из них выявлялась вирусная активность с высоким (от 1,5 до 11 млн МЕ/мл) уровнем виремии, у 18,1% — со средним (от 250 до 600 тыс. МЕ/мл) и у 27,2% — с низким (от 20 до 80 тыс. МЕ/мл). В ходе исследования мы не выявили взаимосвязи между появлением системных синдромов ХГС и вирусной активностью. Аналогичные данные были получены и другими авторами, которые изучали частоту регистрации внепеченочных поражений у взрослых, больных ХГС, с различным уровнем вирусной нагрузки [8].
Результаты показали, что у детей, больных ХГС с системными проявлениями, одинаково часто регистрировали генотипы 3а и 1b, лишь у 1% одновременно выявляли два генотипа — 1а и 1b. Принято считать, что внепеченочные проявления у больных ХГС не сопряжены с каким-то одним генотипом, однако A.G Vigani и соавт. [27] отмечали преобладание внепеченочных проявлений при генотипе 3a, L. Frangeul и соавт. [28] — при 1b.
Проведенное исследование также не выявило связи между развитием внепеченочных поражений и терапией ИФН-α. Среди 33 наблюдаемых нами детей, ранее (3—7 лет назад) получивших курс противовирусной терапии, внепеченочные проявления (поражение щитовидной железы) были выявлены лишь у 1 ребенка подросткового возраста через 4 года после завершения лечения.
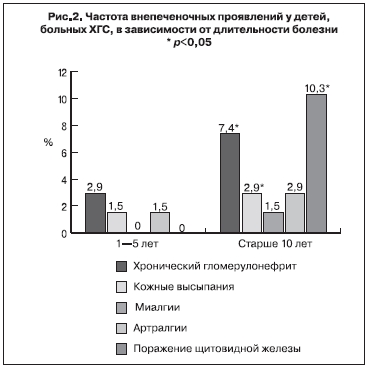
Известно, что показатели биохимической активности (уровень АлАТ, АсАТ, протеинограмма) не в полной мере отражают состояние патологического процесса в печени, эти же закономерности были выявлены нами и относительно системных проявлений ХГС. Так, внепеченочные проявления одинаково часто регистрировали у детей без активности трансаминаз и с минимальной ее активностью. Хотя с увеличением длительности болезни чаще возникали внепеченочные синдромы (рис. 2), т. е. выявление внепеченочных проявлений у ребенка с небольшим сроком заболевания требует осторожного подхода к оценке причинно-следственных связей между фактом инфицирования и формированием системных проявлений, что в свою очередь обуславливает необходимость углубленного обследования детей подросткового возраста, инфицированных ХГС в раннем детстве.
В результате проведенного исследования зарегистрированы отличия в иммунном ответе у больных ХГС с внепеченочными проявлениями и без них (табл. 2).
* — достоверность различий между сравниваемыми группами, p<0,05;
** — достоверность различий в сравнении со здоровыми детьми, p<0,05.
У больных ХГС без системных поражений отмечалось изменение соотношения ИФН-γ/IL-4 за счет гиперпродукции цитокина Th2 — IL-4, а также активация синтеза провоспалительного цитокина ФНО-α (226 ± 46 пг/мл), на фоне нормальных уровней ИФН-α и ИФН-γ (5,9 ± 8,6 и 67,25 ± 12,8 пг/мл), т. е. имел место значительный сдвиг в сторону гуморального иммунного ответа Th2-типа [3, 13, 16, 17].
У больных ХГС с внепеченочными проявлениями была зарегистрирована еще бoльшая инверсия баланса цитокинов Th1/Th2 (ИФН-γ/IL-4) с угнетением продукции главного медиатора клеточного ответа − ИФН-γ (18,4 ± 3,4 пг/мл), тогда как синтез IL-4 резко возрастал и превышал выработку у здоровых детей в 50—100 раз (894 ± 53 пг/мл). Также у этих пациентов наблюдалась выраженная стимуляция синтеза ФНО-α (1950 ± 97 пг/мл), что является неблагоприятным фактором в плане развития фиброза печени.
Следовательно, ХГС у детей с внепеченочными поражениями характеризуется резкой поляризацией иммунного ответа в сторону дифференцировки Th2 с недостаточностью клеточного механизма защиты, несмотря даже на довольно высокие уровни выработки ИФН-α. Полученные данные оказались достаточно неожиданными, поскольку угнетение синтеза ИФН-γ не сопровождалось повышением активности трансаминаз. По-видимому, инверсия иммунного ответа была связана с воспалительным процессом, происходящим не в печени, а в других органах и системах. У детей с внепеченочными проявлениями установлено также умеренное повышение уровней иммуноглобулинов: IgM до 1,2 ± 0,07 г/л (при норме 1,06 ± 0,09 г/л), IgG до 11,7 ± 0,06 г/л, (при норме 8,9 ± 0,03 г/л) и IgЕ до 142,8 ± 4,6 кЕ/л (при норме 100,0 ± 32,0 кЕ/л), что также иллюстрирует выраженный гуморальный иммунный ответ организма. Тогда как у детей, длительно болеющих ХГС без внепеченочных проявлений, неспецифический гуморальный ответ практически отсутствовал. В активную фазу процесса у них регистрировали существенное снижение уровня IgM (0,7 ± 0,09 г/л) и IgЕ (48,0 ± 11,0 кЕ/л).
Таким образом, при проведении поэтапной профилактики рецидивов у детей с ХГС с определением критериев прогноза заболевания у длительно болеющих детей для улучшения качества их жизни, необходимо проводить исследования на выявление активации синтеза аутоантител, ревматоидного фактора, определение цитокинового статуса. Выявленные изменения требуют наблюдения и динамического контроля. Высокие уровни неблагоприятных показателей или их нарастание в динамике при сочетании с клинической симптоматикой являются показанием к иммуносупрессивной терапии. Доказано, что одним из методов ранней диагностики внепеченочных проявлений может быть тест на определение ревматоидного фактора.
Выводы
У детей с длительным сроком инфицирования ХГС протекает с печеночными проявлениями в 86,8% случаев, с сочетанием внепеченочных и печеночных проявлений — в 13,2%. Среди системных проявлений преобладают поражение щитовидной железы (5,3%), кожные высыпания (3,6 %), артралгии (7,1%).
У детей, особенно у девочек, с длительностью заболевания ХГС более 10 лет в подростковом возрасте при диспансерном наблюдении необходимо проводить контроль функций мочевыделительной системы, желудочно-кишечного тракта, уровней гормонов щитовидной железы и ревматоидного фактора для исключения развития внепеченочных поражений.
Иммунный статус у детей, больных ХГС с неблагоприятным течением, характеризуется нарушением баланса цитокинов в виде резкой стимуляции синтеза IL-4 и ФНО-α при угнетении продукции ИФН-γ.


