Среди природно-очаговых трансмиссивных инфекций клещевой вирусный энцефалит (КВЭ) представляет серьезную проблему для здравоохранения на территориях 48 из 85 субъектов Российской Федерации. В число высокоэндемичных регионов России по КВЭ входит и Свердловская область.
За период 1992–1999 гг. максимальный показатель заболеваемости составлял 42,9 на 100 тыс. населения, когда регистрировалось до 7022 случаев КВЭ. С целью снижения уровня заболеваемости на территории Свердловской области с 1996 г. в рамках региональной программы проводится массовая вакцинация населения против КВЭ. В результате с 2000 г. отмечается стойкая тенденция к снижению уровня заболеваемости (до 2,63 на 100 тыс. населения к 2017 г.) и патоморфоз заболевания: спорадическая регистрация очаговых форм с летальным исходом при одновременном увеличении лихорадочных форм заболевания в настоящее время до 80% случаев. Сравнительный клинико-эпидемиологический анализ за 15-летний период наблюдения (1992–2006 гг.), проведенный Л.И. Волковой [1], показал, что основную роль в снижении уровня заболеваемости, уменьшении тяжести клинических форм, частоты прогрессирования заболевания, показателей инвалидизации и смертности имеет активная иммунизация населения. Классические черты нейроинфекции оставались типичными только для непривитого населения, лиц старших возрастных групп (старше 60 лет) и детей до 15 лет. По данным В.В. Романенко с соавт. [2], при охвате прививками свыше 50% населения началось снижение уровня заболеваемости КВЭ без резких циклических подъемов. При вакцинации 72% населения показатель заболеваемости среди привитых составил 1,5 на 100 тыс. контингента, что в 8,7 раз ниже, чем среди непривитых (13,0 на 100 тыс. контингента). В структуре КВЭ у привитых статистически значимо чаще регистрировали лихорадочные формы (88%), а менингеальные (10,7%) и очаговые (1,3%) встречались реже, чем у непривитых (66,2, 26,8 и 7,0% соответственно). Исследование М.С. Есюниной и соавт. [3] также показано, что иммунизация населения против КВЭ, проводимая в 1996–2012 гг., обусловила снижение заболеваемости с 43,0 ± 2,0 до 3,6 ± 0,6 на 100 тыс. населения. Коэффициент эпидемиологической эффективности составил при этом 97,6%. В клинической структуре заболеваемости привитых доля лихорадочных форм выросла до 90%, а доля тяжелых менингеальных и очаговых форм снизилась до 8,4 и 1,6% соответственно.
Однако до настоящего времени случаи заболевания КВЭ регистрируются на 80% административных территорий области, заболеваемость превышает общероссийский показатель в 2 раза (2,63 и 1,32 на 100 тыс. населения соответственно), процент летальности сохраняется на достаточно высоком уровне в течение многих лет и имеет незначительные колебания – от 0,6 до 2,7% в год, что, по-видимому, объясняется тяжестью течения очаговых форм заболевания.
Показатель привитости в Екатеринбурге в 2017 г. составил 90,4%, что превышает среднеобластной показатель (87,4%). При этом заболеваемость КВЭ среди жителей мегаполиса в течение ряда лет была выше, чем в Свердловской области (среднемноголетний уровень заболеваемости составил 4,10 и 3,01 на 100 тыс. населения соответственно), что наряду с другими критериями (заклещевленность, вирусофорность клещей, количество пострадавших от присасывания клещей), позволяет квалифицировать Екатеринбург как природно-антропургический и синантропно-урбанистический очаг КВЭ высокой степени активности. Приведенные данные указывают на необходимость анализа причин недостаточной защищенности населения Екатеринбурга от КВЭ в условиях массовой вакцинации.
Цель исследования – изучение уровня популяционного и поствакцинального иммунитета в зависимости от степени эндемичности региона, сезонности, масштабов специфической профилактики и иммунного статуса населения во взаимосвязи с риском заболевания и клиническим полиморфизмом КВЭ на фоне вакцинации и экстренной иммунопрофилактики в Екатеринбурге.
Материалы и методы
Эпидемиология клинических форм и патоморфоз КВЭ на фоне иммунопрофилактики были изучены в период 2006–2016 гг. по материалам базы данных городского центра природноочаговых инфекций (МО «Новая больница»). В исследование было включено 795 больных с подтвержденным диагнозом КВЭ.
Мониторинг сезонных колебаний популяционного иммунитета у доноров без данных о прививочном анамнезе в 2017 г. был проведен с 486 пробами сывороток крови обследованных контингентов, предоставленных ГБУЗ СО «Областная станция переливания крови». Критериями отбора лиц для взятия крови были возраст не моложе 18 лет на момент обследования; отсутствие заболевания КВЭ в прошлом и инфекционных заболеваний в настоящем.
Также были исследованы 350 образцов сывороток крови соматических больных МО «Новая больница» в разные периоды года (май и октябрь).
Иммуноферментный анализ (ИФА) для выявления антител класса IgG проводили с помощью наборов «ВектоВКЭ-IgG» производства ЗАО «Вектор-Бест» (Новосибирск). Результаты ИФА регистрировали на планшетном иммуноферментном анализаторе Stat Fax 4300 (Awareness Technology Inc., США) с компьютерным обеспечением учета полученных данных.
При описании данных для качественных признаков находили абсолютные и относительные (в %) частоты; последние снабжали 95% доверительными интервалами (95% ДИ), вычисленными по методу Уилсона (Wilson CI for proportion)1. Сравнение независимых выборок по качественным номинальным показателям проводили в ходе анализа таблиц сопряженности с помощью критерия χ2 Пирсона. Для слабонасыщенных таблиц (имелись ячейки со значениями fij ≤ 5) оценку статистической значимости проводили рандомизационной техникой Монте-Карло (n = 9999). Для выявления ячеек таблицы, давших неслучайный вклад в статистику критерия, рассчитывали согласованные стандартизованные остатки Хабермана (Adjusted residuals – AR). Анализ на наличие линейного тренда проводили с использованием теста Кохрана–Армитажа (тренд-теста) с одной степенью свободы (Cochran-Armitage test for trend). Различия считали статистически значимыми при p ≤ 0,05. Статистическая обработка данных эпидемиологического и клинического анамнезов, серологических исследований выполнена с помощью пакетов PAST (v. 3.25, [4]) и XLStat (Addinsoft Inc., США).
Результаты
Когортное исследование иммунологической структуры (иммунного статуса) населения (доноров) Екатеринбурга было проведено нами до и после эпидемического сезона КВЭ (май и октябрь 2017 г.). Титры антител класса IgG по данным ИФА группировали следующим образом: от 0 до 1:100 («серонегативные»), от 1:100 и более (защитный титр в соответствии с Санитарными правилами РФ «Профилактика клещевого вирусного энцефалита»2) и 1:400 и выше. Необходимо отметить, что в настоящее время обоснованно предлагается считать минимальным уровнем защитного действия антител титр IgG 1:400 [5, 6].
Как показали результаты (табл. 1), к завершению официальной кампании по вакцинации населения против КВЭ (май) антитела к ВКЭ в защитном титре отсутствовали у 33,3% обследованных. Сравнение титров антител в сыворотках крови, взятых в начале (май) и по окончании эпидемического сезона (октябрь) показало, что осенью процент проб крови с уровнем антител ниже защитного снижается в 2 раза (с 33,3 до 17,2%). Различия заключались преимущественно в преобладании низкотитражных проб (< 1:100) в мае (AR = 4,1) и проб с титрами от 1:400 до 1:1600 в октябре (AR = 3,0).

Тренд-тест Кохрана–Армитажа показал, что в октябре происходит рост доли высокотитражных проб (линейный тренд от проб с низкими титрами к высоким).
Иная ситуация складывалась при исследовании сывороток больных с хронической неинфекционной патологией различных органов и систем, среди которых ведущее место занимали заболевания респираторного и желудочно-кишечного трактов и сердечно-сосудистой системы.
Данные, приведенные в табл. 2, не повторяют динамики показателей гуморального иммунитета у здоровых людей до и после эпидемического сезона КВЭ, более того, защитный титр антител у соматических больных практически не изменился в течение рассматриваемого периода.
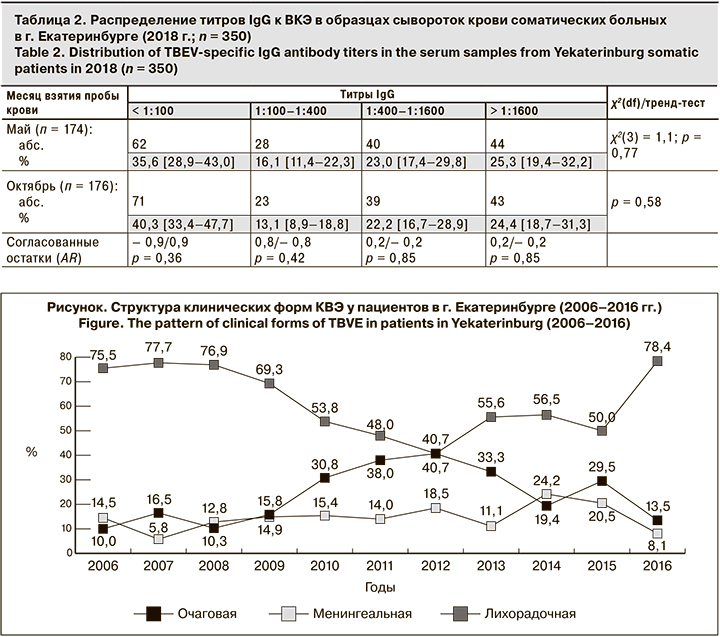
Дальнейшие исследования были посвящены изучению патоморфоза заболевания у пациентов с верифицированным диагнозом КВЭ на фоне различных модификаций иммунопрофилактики. В последние годы (2006–2016) происходило снижение уровня заболеваемости этой нейроинфекцией. Среди пациентов, обратившихся в неврологическое отделение ЛПУ, установлено преобладание в клинической структуре КВЭ лихорадочных форм (кумулятивный итог наблюдений – 64%) над менингельными и очаговыми (14 и 22% соответственно).
Как показано на рисунке, в исследуемой совокупности пациентов доля лихорадочных форм КВЭ, снизившаяся в 2012 г. до 40,7%, к 2016 г. достигла уровня 2006 г. (75,5%). Рост/спад происходил в основном за счет снижения/повышения доли очаговых форм заболевания, независимо от вида иммунизации или ее отсутствия. Более консервативная динамика характерна для менингеальных форм: их доля за период с 2006 по 2016 г. снизилась с 14,5 до 8,1%. При этом прослеживается тенденция к увеличению удельного веса очаговых форм в 2010–2015 гг. В целом за 12-летний период наблюдения отмечены колебания частоты встречаемости менингеальной и очаговой форм в 4 раза (от 5,8 до 24,2% и от 10,0 до 40,7% соответственно), и лихорадочной формы – почти в 2 раза (от 40 до 72 %).
Необходимо отметить, что проявления очаговых форм заболевания более характерны для больных, ранее не привитых или получивших только иммуноглобулин после присасывания клеща. Доля очаговых форм у таких больных выше, чем у вакцинированных и лиц, дополнительно получивших иммуноглобулин (табл. 3). У вакцинированных пациентов, обратившихся за экстренной серопрофилактикой после присасывания клеща, менингеальные формы развивались реже, чем у лиц, имевших только вакцинацию в анамнезе. Тренд-тест Кохрана-Армитажа показал, что существует статистически значимая линейная ассоциация профилактических мероприятий с клинической формой КВЭ (линейный тренд в сторону снижения тяжелых форм заболевания у привитых, получивших экстренную серопрофилактику).

Обсуждение
Проведенные исследования демонстрируют определенные отличия уровня гуморального иммунитета здорового населения мегаполиса в разные периоды календарного года. Как известно, популяционный иммунитет у населения эндемичной по КВЭ территории слагается из естественной иммунизации (латентная или инаппарантная форма инфекции), заболевания манифестной формой КВЭ и вакцинации. Сезонная вариабельность уровня гуморального иммунитета свидетельствует о значимой роли естественного «проэпидемичивания» населения и в то же время об инфекционной уязвимости трети трудоспособного населения Екатеринбурга перед началом эпидемического сезона КВЭ, несмотря на высокий процент охвата вакцинацией.
Кроме того, на течение и исход заболевания у пациентов с хронической неинфекционной патологией различных органов и систем может влиять взаимоотягощающая патология, в том числе и инфекционной этиологии [7–9].
Приведенные эпизоды состояния популяционного иммунитета у здорового трудоспособного населения Екатеринбурга свидетельствуют о необходимости персонифицированного подхода к специфической профилактике КВЭ, подразумевая применение экстренной схемы вакцинации или дополнительную ревакцинацию в пределах сроков, предусмотренных инструкцией по применению препарата (вакцины), перед началом эпидемического сезона КВЭ, а также назначение экстренной серопрофилактики иммуноглобулином пострадавшим от присасывания инфицированных клещей, безусловно, под контролем уровня гуморального иммунитета индивидуума, независимо от вакцинального анамнеза.
Причины резких колебаний структуры клинических форм КВЭ на фоне возрастающего охвата населения профилактическими прививками против ВКЭ, очевидно, связаны не только с изменением генетических свойств возбудителя, но и c рядом других факторов, имеющих отношение к исходному неблагополучию заболевших клещевым энцефалитом, что требует дальнейших исследований.
Показано, что для пациентов с определенным социальным статусом и настороженностью в отношении риска заболевания КВЭ, получивших дополнительно иммуноглобулин, характерен более высокий уровень защиты от возбудителя КВЭ. Кроме того, эффективность проведенной вакцинации зависит от возраста, состояния иммунной системы человека, сопутствующих заболеваний и многих других факторов. Одной из основных проблем при использовании современных вакцин является разработка оптимальных схем вакцинации и ревакцинаций. В настоящее время необходима оценка приемлемости экстренных схем вакцинации и возможности увеличения сроков между ревакцинациями. Специалисты ВОЗ на основании данных, полученных в Европе, где циркулирует в основном европейский генотип вируса, предлагают увеличить сроки между ревакцинациями до 5–10 лет с использованием вакцин, приготовленных на основе гомологичного штамма вируса. Это позволило бы значительно облегчить решение социально-экономической проблемы защиты населения от этой инфекции [10–12]. Тем не менее в нашей стране требуются дополнительные исследования этого вопроса, поскольку существующие вакцинные препараты, приготовленные на основе дальневосточного и европейского генотипов вируса, не могут закрыть генетическое разнообразие штаммов ВКЭ в огромном евразийском ареале. На большей части РФ циркулирует сибирский генотип, в связи с чем нельзя исключить, что иммунологическая память к гетерологичным штаммам вируса может снижаться быстрее, чем к гомологичным [13–16].
Заключение
Приведенные данные показывают тесную связь иммунного статуса с риском и тяжестью заболевания КВЭ. Синхронизировать эти явления для пользы индивидуума и здравоохранения в целом возможно при внедрении в эндемичных очагах массовой вакцинопрофилактики как адекватного способа и реального пути управления этой нейроинфекцией, а также персонифицированного подхода при вакцинации к лицам с риском потенциального (а порой и неизбежного) контакта с переносчиками ВКЭ.
Несмотря на неоднозначные оценки эффективности введения специфических иммуноглобулинов при КВЭ с профилактической и лечебной целями [17–22], невозможно игнорировать общепринятую в настоящее время в России практику экстренной иммунопрофилактики в отношении невакцинированных или получивших неполный курс вакцинации, а также, на основании наших исследований, вакцинированных лиц с нарушениями иммунного статуса. В последнем случае, при наличии в клеще, снятом с пациента, антигена или РНК ВКЭ, при отсутствии у пострадавшего антител к ВКЭ, должна проводиться экстренная профилактика иммуноглобулином в соответствии с СП 3.1.3.2352-08.
Финансирование
Исследования проводилось в рамках НИР «Молекулярная эпидемиология вируса клещевого энцефалита на различных территориях Уральского федерального округа» Отраслевой научно-исследовательской программы Роспотребнадзора «Проблемно-ориентированные научные исследования в области надзора за инфекционными и паразитарными болезнями на 2016–2020 годы». (№ регистрации: АААА-А16-116061710033-9).


