Острые кишечные инфекции (ОКИ) на сегодняшний день остаются одной из основных проблем педиатрии. В большинстве случаев при своевременной адекватной терапии заболевание завершается выздоровлением. Однако как показывают многолетние наблюдения и исследования, у некоторых детей формируются те или иные осложнения, которые усиливают тяжесть состояния, ухудшают прогноз, а иногда могут становиться причиной хронической патологии и летальных исходов.
Сердечно-сосудистая система закономерно реагирует на инфекционный процесс. У 80% больных отмечаются различные нарушения: повышение или снижение артериального давления, тахи- или брадикардия, усиление или появление шумов в сердце [1]. Во многих случаях эти симптомы купируются вместе с основными проявлениями ОКИ. Но примерно у 8% пациентов нарушения сохраняются, иногда прогрессируют, а при детальном дополнительном обследовании выявляются достоверные признаки инфекционного миокардита [2]. Известно, что причиной его могут становиться любые возбудители.
Среди ОКИ лидирующие позиции по распространенности в Российской Федерации занимают сальмонеллез и ротавирусная инфекция. По данным литературы [3–10], неблагоприятное течение этих заболеваний может быть связано не только с выраженным обезвоживанием, но и с различными внекишечными проявлениями: поражением поджелудочной железы, печени, почек, надпочечников, легких, нервной системы, сердца, стенки сосудов. Ротавирусы в сочетании с другими признаками миокардита были обнаружены в биоптатах сердечной мышцы при патологоанатомическом исследовании у умерших от синдрома внезапной смерти [11].
Клиницистами поражения миокарда диагностируются нечасто из-за неспецифичности симптоматики, частого применения на практике терминов, отсутствующих в действующей на сегодняшний день Международной классификации болезней (МКБ-10). Используемые при оформлении медицинской документации диагнозы «кардиопатия» и «миокардиодистрофия» не имеют общепринятых критериев диагностики, схем ведения больных и подходов к терапии. Среди практикующих специалистов до сих пор сохраняется много противоречий в оценке характера патологического процесса, формирующегося в сердечной мышце при прямом или опосредованном воздействии вирусов или бактерий.
Проведенные в нашем отделе клинико-экспериментальные исследования показали высокую распространенность и возможности своевременной диагностики инфекционных поражений миокарда у детей [12].
Цель исследования – уточнить особенности инфекционно-зависимых изменений миокарда, развивающихся при ОКИ, и разработать рекомендации по их диагностики.
Материалы и методы
Для оценки распространенности и определения характеристик патологического процесса были обследованы 2882 ребенка. Среди них сальмонеллез был подтвержден у 1471 ребенка, ротавирусная инфекция – у 648 детей, ОКИ сальмонеллезно-ротавирусной этиологии – у 43. При бактериологическом анализе Salmonella Enteritidis была обнаружена у 1174 больных, Salmonella Typhimurium – у 135, другие из 20 известных сероваров сальмонелл – у 142 детей. У 63 пациентов диагноз поставлен на основании клинико-серологических данных при нарастании титров антител к сальмонеллезному антигену в сыворотке крови в 4 и более раз.
Диагностику ротавирусной инфекции проводили в фекалиях методом ИФА с применением тест-системы «Рота-анализ» ЗАО «Биоиммуноген» (Москва) и методом ПЦР с использованием тест-систем «АмплиСенс» (Россия).
Для оценки специфичности и значимости выявляемых изменений были обследованы еще 232 ребенка с ОКИ другой этиологии: норовирусной (40), астровирусной (4), другой сочетанной (45) и неуточненной (143), а также 428 пациентов с острыми респираторными вирусными инфекциями (ОРВИ): аденовирусной (60), респираторно-синцитиальной (61), парагриппом (124), гриппом (6), сочетанной (7) и неуточненной (170). Диагноз устанавливали на основании результатов исследования мазка из носоглотки методом прямой иммунофлуоресценции на основе поликлональных антител и с помощью ПЦР с использованием диагностических тест-систем «АмплиСенс» (Россия).
С целью определения значимости выявляемых нарушений было проведено комплексное обследование 60 условно здоровых детей.
При регистрации инфекционно-зависимых изменений наблюдение за пациентами осуществляли до полного выздоровления или регистрации устойчивых отклонений в течение от 2 до 12 лет.
В исследование включали детей в возрасте от 1 мес. до 15 лет. На момент включения большинство составляли дети от 1 мес. до 3 лет – 74,5%, от 1 мес. до 1 года – 34%, от 1 года до 3 лет – 41%, от 3 до 7 лет – 17%, от 7 до 15 лет – 8%. У госпитализированных с ОКИ пациентов клинически чаще диагностировали гастроэнтероколит: при сальмонеллезах – у 871 (59,2%) ребенка, при ОКИ сочетанной вирусно-бактериальной этиологии – у 22 (51%) детей, при ротавирусной инфекции (гастроэнтерите) – у 395 (60,9%).
Сравниваемые группы были полностью сопоставимы по возрасту, полу, тяжести основного заболевания, сопутствующей патологии, срокам госпитализации, проводимой базисной терапии. 87% пациентов были госпитализированы в течение первых 4 суток от начала болезни и имели среднетяжелую форму основного заболевания.
 В разных по этиологии ОКИ группах у 10–17% пациентов были диагностированы осложнения: острый панкреатит, реактивный гепатит, инфекции мочевыводящих путей, анемия. У 37–63% больных отмечали сопутствующие заболевания: чаще острую респираторную инфекцию, норовирусную инфекцию, атопический дерматит и другую патологию.
В разных по этиологии ОКИ группах у 10–17% пациентов были диагностированы осложнения: острый панкреатит, реактивный гепатит, инфекции мочевыводящих путей, анемия. У 37–63% больных отмечали сопутствующие заболевания: чаще острую респираторную инфекцию, норовирусную инфекцию, атопический дерматит и другую патологию.
Проводимая работа была одобрена локальным этическим комитетом ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора.
Условиями включения в исследование были: наличие подписанного информированного согласия одним из родителей или законных представителей; документированный анамнез (амбулаторные карты, эпикризы, выписки из историй развития); отсутствие пороков сердца и другой хронической патологии, закономерно сопровождающейся сердечно-сосудистыми изменениями.
Всем детям, включенным в исследование, помимо обязательного осмотра проводили клинический и биохимический анализы крови, электрокардиографическое (ЭКГ) и эхокардиографическое (ЭхоКГ) исследования. Определяли концентрацию тропонина I, уровни активности МВ-креатинкиназы (МВ-КК), α-гидроксибутиратдегидрогеназы (α-ГБДГ), аспарагиновой трансаминазы (АСТ), аланиновой трансаминазы (АЛТ), содержание калия, кальция, С-реактивного белка (СРБ), антител к миокарду и (по показаниям) титра антистрептолизина-О.
Анализ активности МВ-КК, α-ГБДГ, АСТ и АЛТ проводили с помощью биохимического полуавтоматического фотометра «Stat Fax 1904 Plus» («Awareness Technology, Inc.», США) с применением оптимизированного ультрафиолетового теста и набора реагентов DiaSys Diagnostic Systems GmbH (Германия). Уровень тропонина I определяли с помощью одностадийного иммунохроматографического теста производства «Veda Lab» (Франция) и иммуноферментным способом с использованием набора реагентов «DRG International Inc.» (США).
Комплекс органоспецифичных антифибриллярных, антисарколеммальных и антицитоплазматических антимиокардиальных антител определяли иммунофлюоресцентным полуколичественным методом с помощью набора производства «Immco diagnostics» (Нидерланды).
В качестве дополнительных обследований применяли суточное мониторирование ЭКГ и рентгенографию органов грудной клетки.
Для оценки характера морфологических изменений в миокарде в исследование было включено 95 самцов линейных мышей BALB/с в возрасте 2 недель. Эксперимент проведен совместно с ведущим научным сотрудником РГБУ «НИИ вирусологии имени Д.И. Ивановского» Минздрава России д.м.н. Е.В. Исаевой и ведущим научным сотрудником клинического отдела ФБУН «МНИИЭМ имени Г.Н. Габричевского» Роспотребнадзора д.м.н. И.Т. Щербаковым.
В опытную группу А включили 65 мышей, зараженных перорально вирусом Коксаки А № 2046 Государственной коллекции вирусов РГБУ «НИИ вирусологии имени Д.И. Ивановского» Минздрава России. Этот вирус был выбран как наиболее близкий к непатогенному для мышей ротавирусу по морфологическим характеристикам и особенностям вызываемого им заболевания [13]. В опытную группу В вошло 5 животных, зараженных интраназально стандартным вирусом гриппа H3N2. В группу С было включено 20 особей, зараженных перорально Salmonella Typhimurium (8 животных), Salmonella Сholeraesuis (8 животных) и Salmonella Dublin (4 особи). Во всех случаях использовали дозу LD70. Контрольную группу составили 5 условно здоровых особей. Распределение по группам проводили методом случайной выборки. Оценивали изменения в миокарде животных на 3-и, 5–7-е, 14-е и 21-е сутки от момента инфицирования после окраски срезов гематоксилином и эозином с помощью оптического микроскопа с увеличением 280х, 400х и 630х.
Статистическую обработку всех полученных данных осуществляли на персональном компьютере с использованием программы Statistica, версия 6.1 («StatSoft Inc.», США). Использовали методы вариационной статистики с расчетом средней арифметической (M), стандартного отклонения (σ), стандартной ошибки средних величин этих показателей (m). Различия между рассчитанными показателями в группах оценивали по Z-критерию и критерию χ2. Различия при использовании параметрических и непараметрических методов считали статистически значимыми при вероятности > 95% (p < 0,05).
Результаты
Среди обследованных детей, больных ОКИ сальмонеллезной, ротавирусной и сочетанной сальмонеллезно-ротавирусной этиологии, впервые выявленные изменения, указывающие на возможную патологию сердечно-сосудистой системы, были обнаружены у 432 (20%). Среди них отмечали жалобы (со слов детей или их родителей) на утомляемость 89%, выраженную вялость – 5%, эпизоды судорог – 4%, обморочные состояния –2%. Объективно определяли ранее не регистрировавшийся систолический шум у 76% пациентов, приглушенность или глухость тонов сердца – у 37%, нарушения ритма – у 24%, расширение границ сердца – у 15%, артериальную гипотензию – у 6%.
При дополнительном обследовании на основании данных ЭКГ, ЭхоКГ и лабораторных показателей диагнозы были уточнены. У 101 ребенка (4,6% от всех больных ОКИ сальмонеллезной, ротавирусной и сочетанной сальмонеллезно-ротавирусной этиологии) изменения были расценены как функциональные, поскольку быстро купировались вместе с положительной динамикой основного заболевания. Среди них отмечали инфекционную гиперферментемию, тахикардию, соответствующую повышенной температуре тела и эмоциональному состоянию, брадиаритмию в период реконвалесценции и функциональные шумы. Они были выявлены достоверно чаще при микст-инфекции [5 пациентов (12%)] и ротавирусной инфекции [41 пациент (6%)], чем при сальмонеллезах [55 пациентов (4%)] (рис. 1).
 У 13% пациентов (281 ребенок) было отмечено сочетание клинических, инструментальных (расширение камер сердца, снижение фракции выброса, нарушение диастолической функции по ЭхоКГ; нарушения ритма и/или проводимости, снижение вольтажа, нарушения реполяризации на ЭКГ) и биохимических изменений (повышение уровня тропонина I, МВ-КК, α-ГБДГ, АСТ/АЛТ), которые сохранялись более 2 нед. У 20% обследованных детей были выявлены антимиокардиальные антитела через 25 суток от начала наблюдения и позднее. В последующем у них длительно сохранялись клинические, электрокардиографические и ультразвуковые признаки поражения миокарда. В период от 6 мес. до 5 лет и более изменения регистрировали у 29 больных (1,2% от общего числа больных сальмонеллезом и 1,6% больных ротавирусной инфекцией).
У 13% пациентов (281 ребенок) было отмечено сочетание клинических, инструментальных (расширение камер сердца, снижение фракции выброса, нарушение диастолической функции по ЭхоКГ; нарушения ритма и/или проводимости, снижение вольтажа, нарушения реполяризации на ЭКГ) и биохимических изменений (повышение уровня тропонина I, МВ-КК, α-ГБДГ, АСТ/АЛТ), которые сохранялись более 2 нед. У 20% обследованных детей были выявлены антимиокардиальные антитела через 25 суток от начала наблюдения и позднее. В последующем у них длительно сохранялись клинические, электрокардиографические и ультразвуковые признаки поражения миокарда. В период от 6 мес. до 5 лет и более изменения регистрировали у 29 больных (1,2% от общего числа больных сальмонеллезом и 1,6% больных ротавирусной инфекцией).
Характер изменений определен по гистологическим показателям, полученным при моделировании инфекционного процесса, с последующим морфологическим исследованием срезов миокарда инфицированных лабораторных животных. У лабораторных животных на 3-и, 7-е, 14-е и 21-е сутки от момента инфицирования вирусом Коксаки А в миокарде при гистологическом исследовании были выявлены одновременно дистрофические и воспалительные изменения. Максимальная выраженность была зарегистрирована на 14-е сутки, минимальная – на 21-е [13]. Достоверным признаком воспаления считали инфильтрацию лимфоцитами. Она сопровождалась отечностью стромы, отсутствием четких контуров мембраны, округлой формой кардиомиоцитов со смещенными к центру гипохромными округлыми ядрами. Цитоплазма кардиомиоцитов была в состоянии зернистой, зернисто-вакуольной или вакуольной дистрофии, поперечно-полосатая исчерченность визуализировалась нечетко или отсутствовала. Кровеносные сосуды микроциркуляторного русла были полнокровны. Эти изменения соответствовали инфекционному миокардиту разной степени выраженности и различной локализации.
У особей, инфицированных вирусом гриппа H3N2 и возбудителями сальмонеллеза, были обнаружены в целом сходные изменения. При гриппе в строме миокарда присутствовали лимфоциты с максимальной степенью выраженности изменений в миокарде предсердий на 3-и сутки. При сальмонеллезе в инфильтрате обнаруживали нейтрофилы и гистиоциты с максимумом на 5-е сутки от момента заражения у всех особей.
Участки дистрофии при отсутствии инфильтрации были выявлены у выздоравливающих после инфицирования вирусом Коксаки А животных, получавших энтеросорбенты, на 21-е сутки. Анализ гистологической картины миокарда в динамике при различных инфекциях показал, что дистрофия и воспаление представляют собой компоненты единого инфекционного процесса. Следовательно, выявляемые у пациентов изменения, соответствующие поражению миокарда и сохраняющиеся при купировании симптомов ОКИ, необходимо трактовать как вероятный миокардит.
Признаки вероятного острого инфекционного миокардита чаще отмечали у детей с сочетанием ротавирусной инфекции и сальмонеллеза (37%). При сальмонеллезе частота миокардита составила 10%, а при ротавирусной инфекции – 18% (см. рис. 1).
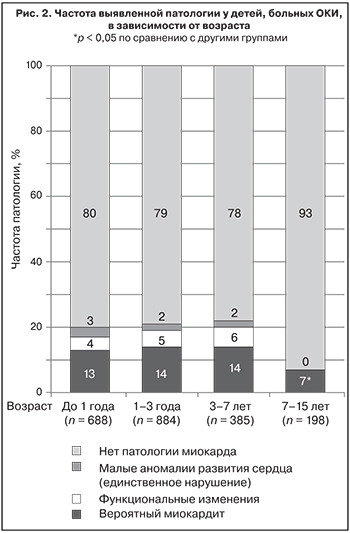
Анализ состояния миокарда в разных возрастных группах показал, что частота изменений при сальмонеллезе была достоверно выше у детей в возрасте от 1 года до 3 лет (71 ребенок – 12%)], чем у детей старше 7 лет (13 детей – 7%). На рис. 2 показано, что патологию миокарда регистрировали преимущественно у пациентов до 7 лет.
В группах детей, не имеющих клинических признаков патологии миокарда на фоне ОКИ и ОРВИ, так же, как и среди условно здоровых, миокардит не был заподозрен ни в одном случае. Частота функциональных изменений и малых аномалий развития сердца в сравниваемых группах, сопоставимых по этиологии и/или возрасту, не имела существенных различий.
У детей при вероятном миокардите на фоне ОКИ отмечали приглушенность или глухость тонов сердца, тахикардию, не соответствующую температуре тела, систолический шум. Это сопровождалось изменениями лабораторных показателей у 100% больных, изменениями на ЭКГ у 97% детей при сальмонеллезе, у 99% – при ротавирусной инфекции и у 100% – при их сочетании. Помимо этого отмечали изменения по результатам ЭхоКГ у 100% больных при сальмонеллезе, у 95% – при ротавирусной инфекции и у 94% – при их сочетании. Из лабораторных показателей чаще был повышен уровень МВ-КК (при сальмонеллезе – у 98% пациентов, при ротавирусной инфекции – у 99% и при сочетанной – у 100%) и α-ГБДГ (у 96, 89 и 100% соответственно), реже – АСТ (у 79, 69 и 75%). При ОКИ сальмонеллезно-ротавирусной этиологии средние значения α-ГБДГ были выше, чем при моноинфекции, что, по-видимому, связано с бóльшей частотой тяжелых форм.
Поражения миокарда при ОКИ различной этиологии и ОРВИ имели в целом сходные клинические, лабораторные, электрокардиографические и эхокардиографические характеристики.
По результатам ЭхоКГ наиболее часто выявляли диастолическую дисфункцию одного или обоих желудочков (от 84% при ротавирусной инфекции до 88% – при сочетанной) как по 1-му, так и по 2-му типу. Реже отмечали снижение фракции выброса (у 21% детей при ротавирусной инфекции – до 47–63%, у 25% детей при сальмонеллезе и микст-инфекции – до 45–63%), гипертрофию (у 12% детей при микст-инфекции, у 22% – при сальмонеллезе, у 34% – при ротавирусной инфекции) или дилатацию желудочков (у 24, 26 и 35% соответственно). Достоверно более высокая частота расширения правого желудочка и предсердий, а также аномальной регургитации была отмечена при ротавирусной инфекции.
На ЭКГ чаще определяли нарушение реполяризации со сглаженностью зубца Т (у 74% пациентов при ротавирусной инфекции, у 75% – при сальмонеллезе и у 81% – при микст-инфекции), снижение зубца R (у 21, 23 и 25% соответственно).
У детей с выявленным сочетанием признаков поражения миокарда при ротавирусной инфекции чаще выявляли выраженные нарушения реполяризации на ЭКГ: инверсию зубца Т, элевацию сегмента ST, удлинение интервала QT, повышение электрической активности правого желудочка, синусовую брадикардию. При сочетанной инфекции чаще регистрировали депрессию сегмента ST.
По данным мониторирования ЭКГ, независимо от этиологии ОКИ, изменения у пациентов с признаками вероятного миокардита были обнаружены в 100% случаев. Среди них выявляли эпизоды неадекватной состоянию пациента синусовой тахикардии и брадикардии, вентрикулярную экстрасистолию, паузы, эпизоды синоатриальной блокады 2-й степени, эпизоды снижения и инверсии зубца Т, нарушения вариабельности ритма.
По данным ЭхоКГ, при функциональных изменениях у детей не было отмечено сопутствующего повышения уровня тропонина I, МВ-КК, систоло-диастолической дисфункции, изменений размеров стенок и полостей. На ЭКГ не было обнаружено нарушений реполяризации и снижения вольтажа. У этих пациентов отмечали синусовую аритмию (при сальмонеллезе и микст-инфекции – у 18%, при ротавирусной инфекции – у 20%), синусовую брадикардию (при ротавирусной инфекции – у 22%), нарушение внутрижелудочковой проводимости (при сальмонеллезе – у 15%), повышение электрической активности одного или обоих желудочков (при ротавирусной и сочетанной этиологии – в 34% случаев, при сальмонеллезе – в 22%), удлиненный интервал QT (у 22% пациентов при сочетанной и у 12% – при ротавирусной инфекции).
В единичных случаях были отмечены небольшие повышения уровней одного или двух исследуемых ферментов.
Содержание СРБ было повышено достоверно чаще и имело более высокие значения (12–24 ммоль/л) у детей, имеющих признаки вероятного миокардита: у 75% – при микст-инфекции, у 83% – при ротавирусной инфекции, у 87% – при сальмонеллезе.
Уровни калия и кальция в сыворотке крови у абсолютного большинства пациентов во всех группах на момент выявления первых симптомов патологии миокарда были в пределах нормы и не имели достоверных отличий.
Обсуждение
Полученные данные, свидетельствующие о высокой распространенности поражений миокарда на фоне ОКИ, в целом соответствуют опубликованным результатам ранее проведенных исследований и наблюдений [5, 11, 14, 15]. Функциональные изменения чаще отмечали при микст-инфекции, чем при сальмонеллезе, что может быть связано с более активным усилением потока крови в камерах сердца на фоне выраженной интоксикации и, вероятно, нарушений водно-электролитного баланса при сочетанном воздействии возбудителей. В связи с этим ранее немые хорды и трабекулы становились причиной появления новых шумов. Вероятно, функциональные изменения встречались у пациентов чаще, чем показало наше исследование, однако из-за короткой продолжительности отклонений многие из них не были зарегистрированы врачами.
В группе больных ротавирусной инфекцией высокая частота впервые выявленных малых аномалий развития сердца, видимо, связана с преобладанием детей в возрасте до 1 года.
Частота регистрации симптомов, характерных для миокардита, при сальмонеллезе составила 10%, что полностью совпадает с опубликованными ранее результатами зарубежных исследований [14, 15]. Чаще всего признаки вероятного острого инфекционного миокардита отмечали у детей с сочетанием ротавирусной инфекции и сальмонеллеза – у 16 (37%) пациентов. Это, очевидно, связано с аддитивным действием двух возбудителей и большим числом тяжелых форм, развивающихся при ОКИ сочетанной этиологии. Более высокая распространенность миокардита при ротавирусной инфекции, чем при сальмонеллезе, вероятно, связана с возрастной структурой пациентов: 98% из них были в возрасте от 1 мес. до 3 лет, а дети старше 7 лет не были включены в исследование.
Экспериментальных работ, посвященных оценке изменений миокарда при различных инфекционных заболеваниях в динамике, ранее не проводили. В целом полученные результаты противоречат некоторым данным отечественных исследователей об абсолютном преобладании дистрофических изменений на фоне различных острых инфекционных заболеваний [1, 6]. Однако гистологическое подтверждение воспалительного характера повреждения сердечной мышцы с одновременным присутствием признаков дистрофии согласуется с позицией зарубежных авторов [2, 11, 15, 16].
Проведенное исследование показало необходимость проведения комплексного обследования детей с ОКИ при выявлении у них клинических признаков поражения миокарда с использованием лабораторных, электрокардиографических и эхокардиографических методов диагностики. Выявляемые изменения не специфичны, но по их суммарной оценке и медленной динамике в повседневной клинической практике возможно диагностировать вероятный миокардит и назначить соответствующее лечение, что, безусловно, улучшит прогноз.
Выводы
- Клинические, лабораторные, электрокардиографические и эхокардиографические изменения, соответствующие инфекционному миокардиту, выявлены у 10% детей при сальмонеллезе, у 18% – при ротавирусной инфекции и у 37% – при ОКИ сочетанной сальмонеллезно-ротавирусной этиологии.
- Симптоматика вероятного миокардита чаще регистрируется у детей в возрасте от 1 года до 3 лет, при сочетанной сальмонеллезно-ротавирусной инфекции и при тяжелых формах ОКИ.
- Функциональные изменения (тахикардия, брадикардия, нарушения ритма и проводимости, инфекционная гиперферментемия), купировавшиеся одновременно с симптомами ОКИ, выявлены у 4% детей при сальмонеллезе, у 6% – при ротавирусной инфекцией и у 12% – при сочетанной сальмонеллезно-ротавирусной инфекцией.
- При ОКИ вирусной и бактериальной этиологии, как и при гриппе, у лабораторных мышей в миокарде были обнаружены одновременно дистрофические и воспалительные изменения, характерные для миокардита.


