Как известно, ошибки в диагностике и лечении больных токсической дифтерией в период эпидемии 1990–1998 гг. во многом были связаны с устаревшим представлением врачей о том, что основным критерием установления степени тяжести токсической дифтерии ротоглотки является размер отека подкожной клетчатки шеи [1]. Это послужило стимулом к поиску новых способов ранней диагностики тяжести инфекционного процесса, а также усовершенствованию существующей классификации [2].
В 1931 г. английские авторы (Н. Андерсон и др.) впервые предположили, что тип gravis ассоциируется с более тяжелым, а mitis – с более легким течением дифтерии. В нашем ретроспективном исследовании среди 40 больных с тяжелым и среднетяжелым течением токсической дифтерии у 30 человек заболевание было вызвано токсигенными КБД gravis (с летальным исходом в 9 случаях) и у 10 человек – токсигенными КБД mitis (все с благоприятным исходом).
В настоящее время факторы патогенности КБД, внутривидовые различия штаммов и дифтерийный токсин (ДТ) настолько подробно изучены, что мы рискнули вернуться к поиску взаимосвязей между этиологическим фактором (штаммом КБД), тяжестью течения и изменениями биохимического статуса пациентов при поступлении (1–4-й день болезни) и в динамике (7–12-й день болезни). В инфекционной практике достаточно примеров, описывающих клинические особенности течения болезни в зависимости от внутривидовых различий возбудителя (дизентерия, сальмонеллез и др.), однако при эпидемическом подъеме заболеваемости дифтерией в 1990–1998 гг. таких наблюдений мы не обнаружили [3].
Следует заметить, что возбудитель дифтерии обладает весьма выразительным набором факторов патогенности: его составляют адгезины, ферменты агрессии и экзотоксин – один из наиболее сильных бактериальных токсинов. Коринебактерии демонстрируют высокие адгезивные свойства к эпителиальным и неэпителиальным клеткам (за счет образования белковых пилей разной длины) и способны к гемагглютинации и аутоагглютинации. Гемолизин КБД активно лизирует эритроциты, а фибриноген-связывающий фактор позволяет возбудителю превращать фибриноген в фибрин, минуя традиционный каскад свертывания. Это качество объясняет уникальную способность КБД формировать плотную фибриновую пленку в первичном очаге поражения. Вероятно также, что быстро развивающаяся тромбоцитопения, гемолиз эритроцитов, как и клинически развёрнутая картина геморрагической дифтерии – не только следствие острого тромбогеморрагического синдрома, но и результат действия гемолизина КБД [4].
Коринекомиколат клеточной стенки обеспечивает некоторую устойчивость КБД к фагоцитозу и препятствует перевариванию дифтерийной палочки внутри фагоцитов. Возбудитель сохраняет жизнеспособность вплоть до момента гибели фагоцита [2]. Эта способность бактерии обеспечивает ей выживание в активном периоде антибактериальной терапии и создает предпосылки для длительной циркуляции возбудителя в организме [2].
Создается впечатление, что КБД – хорошо подготовленный микроорганизм-кровопийца. Будучи условным анаэробом, он активно внедряется в ткань миндалин – зону высокого кровоснабжения, формирует там себе «крышу» – плотную фибриновую пленку, под которой он защищен от действия местных антисептических средств и кислорода, и использует белок, кровь (эритроциты, железо) макроорганизма для собственной жизнедеятельности.
Как известно, КБД gravis обладает большей патогенностью. Данный биотип научился активно ферментировать не только белки, но и крахмал. Активное включение в «рацион питания» углеводов убедительно визуализируется при посеве возбудителей на кровяном агаре: колонии КБД gravis – черного цвета, значительно более крупные, «сытые», гладкие и блестящие, в отличие от более мелких и невзрачных колоний КБД mitis.
Хотя способность токсигенных коринебактерий gravis и mitis, как и двух других биотипов (intermedius и belfanti) синтезировать ДТ одинакова, а уровень экспрессии ДТ определяется содержанием ионов железа в цитоплазме возбудителя, нельзя исключить тот факт, что более крупные колонии gravis выделяют большее количество ДТ, гемолизина, нейраминидазы и прочих патогенов, так как способны быстрее расти.
Рецептором для дифтерийного токсина на мембране клеток человека служит гепарин-связывающий предшественник эпидермального фактора роста (ГС-ЭФР). Наибольшее количество ГС-ЭФР-рецепторов сосредоточено на клетках миокарда и в нервной ткани, в ткани почек и надпочечников, что, вероятно, объясняет избирательность поражения при дифтерии этих органов. Научные исследования доказали, что дезоксирибонуклеаза А-фрагмента ДТ осуществляет фрагментацию хромосом и инициирует апоптоз, а В-фрагмент ДТ инактивирует фактор элонгации полипептидной цепи (eEF2), что сопровождается необратимым блокированием синтеза белка и гибелью пораженной токсином клетки [2].
Логично предположить, что более крупные колонии gravis в зоне воспаления выделяют большее количество токсина и обладают большей способностью угнетать белковый обмен, что проявляется клиническими и биохимическими различиями тяжести течения дифтерии. Следовательно, типирование КБД может использоваться не только для убедительной верификации диагноза «дифтерия», но и для прогноза тяжести инфекционного процесса.
Материалы и методы
Работу проводили на базе Инфекционной клинической больницы № 2 Департамента здравоохранения города Москвы. Обследовано 40 человек (27 мужчин и 13 женщин) в возрасте от 18 до 66 лет с диагнозом «токсическая дифтерия». Преобладали пациенты в возрасте до 45 лет (82,5%). 12 пациентов поступили на 2-й день болезни, 16 – на 3-й, 9 – на 4-й и 3 человека – на 5–6-й. У 30 больных диагностирована дифтерия ротоглотки, у 10 – комбинированная дифтерия ротоглотки и гортани или ротоглотки и носа.
Субтоксическая дифтерия установлена в 7 случаях, токсическая дифтерия I степени (TI) – в 6, II степени (TII) – в 19 и III степени (ТIII) – в 8. Во всех случаях диагноз дифтерии был подтвержден лабораторно: у 30 человек высеяна токсигенная КБД gravis и у 10 – токсигенная КБД mitis.
При дифтерии TI и субтоксической дифтерии (n = 13) среднетяжелое течение заболевания сопровождалось развитием миокардита (n = 4), полинейропатии (n = 2) и токсического нефроза (n = 10) и заканчивалось благоприятным исходом.
У пациентов с ТII и ТIII (n = 27) заболевание характеризовалось тяжелым течением, сопровождалось миокардитом с полной (n = 9) или частичной атрио-вентрикулярной блокадой (n = 18) и картиной сердечно-сосудистой недостаточности; развитием полинейропатии (n = 27), в том числе параличом диафрагмы (n = 10); картиной токсического нефроза (n = 19), в том числе острой почечной недостаточностью (n = 5), а также клинически развернутой картиной тромбогеморрагического синдрома по типу геморрагической формы дифтерии (n = 9). Неблагоприятное течение дифтерии ТII–TIII в 9 случаях привело к летальному исходу в разные сроки болезни.
Биохимические исследования у больных дифтерией проводили при поступлении (в 1–4-е сутки от начала заболевания), в динамике (1–2-я неделя заболевания) и перед выпиской (период реконвалесценции).
Исследования в области молекулярной биологии и клинической биохимии убедительно доказывают, что ферменты крови работают в комплексе друг с другом и регулируют обменные процессы как внутри, так и между клетками [5–9]. Организм запускает синтез определенных ферментов для возврата в состояние здоровья. Комбинации необходимых ферментов могут быть различными, во многом определяются типом инфекционного заболевания и работают как адаптационные механизмы [10–13]. Понятие повышенного уровня в крови цитолитических ферментов «печеночной» или «сердечной» природы потеряло всякий смысл сразу после открытия апоптоза. Концепция «ферментативного гомеостаза» была разработана российским физиологом Б.И. Кузником более 30 лет назад [10]. Автор утверждал, что состояние гомеостаза организм поддерживает за счет количественного изменения циркулирующих в крови ферментов и биологически активных веществ негормональной природы под надзором нервной, эндокринной и иммунной систем.
В нашем исследовании для оценки биохимического статуса у больных дифтерией были использованы рутинные (доступные на уровне любой клинической лаборатории) показатели. Они удовлетворяют двум основным требованиям: а) позволяют выявить дефицит пула свободных аминокислот в крови и б) уточнить «генеральную направленность» метаболических потоков в динамике исследования.
Определяли:
- уровень общего белка, который, как известно, является ключевым индикатором белковых ресурсов организма и метаболическим субстратом для работы многих ферментных систем. Наш контроль (эталонное значение) общего белка – 75–85 г/л. Утрата 1 г/л белка в крови означает потерю 30 г белка во всем организме [11];
- активность АСТ (аспартаттрансаминазы) – главный показатель термогенеза и биоэнергетики всего организма, индикатор катаболической (расщепление) направленности метаболических потоков;
- активность АЛТ (аланинтрансаминазы) – ведущий показатель глюконеогенеза и индикатор анаболической (синтетической) направленности метаболических потоков. Как известно, АЛТ отвечает за поддержание константного уровня глюкозы в крови – основного энергетического и дыхательного субстрата клеток. Работа глюкозо-аланинового шунта (уровень АСТ в крови), отвечающего за «перекачку» белков в глюкозу, регулируется гормональной системой надпочечников [11, 12].
Сумму значений трансаминаз (АСТ + АЛТ) мы рассматривали как суммарную величину термогенеза и глюконеогенеза, а по соотношению АСТ/АЛТ (коэффициент де Ритиса) судили о преобладании катаболического или анаболического типа обменных процессов.
Как показали наши исследования, чем раньше в остром периоде заболевания наблюдается инверсия коэффициента де Ритиса, тем благоприятнее течение инфекционного процесса.
Результаты и обсуждение
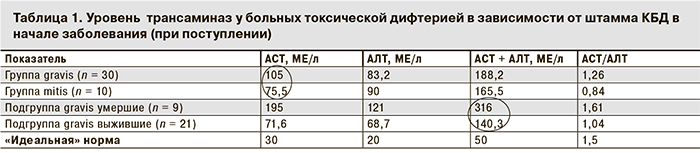
 Мы разделили больных токсической дифтерией на две основные группы (табл. 1): в группу gravis вошли 30 человек, у которых была высеяна токсигенная КБД gravis, в группу mitis – 10 человек, у которых заболевание было вызвано токсигенными КБД mitis. Дополнительно в группе gravis выделили 2 подгруппы в зависимости от исхода: у 9 человек заболевание закончилось летальным исходом (подгруппа gravis умершие) и у 21 – выздоровлением (подгруппа gravis выжившие).
Мы разделили больных токсической дифтерией на две основные группы (табл. 1): в группу gravis вошли 30 человек, у которых была высеяна токсигенная КБД gravis, в группу mitis – 10 человек, у которых заболевание было вызвано токсигенными КБД mitis. Дополнительно в группе gravis выделили 2 подгруппы в зависимости от исхода: у 9 человек заболевание закончилось летальным исходом (подгруппа gravis умершие) и у 21 – выздоровлением (подгруппа gravis выжившие).
Как видно из табл. 1, в начале заболевания исходный уровень термогенеза (активность АСТ) у больных группы gravis была на 39% выше, чем в группе mitis. Следовательно, уже в первые дни болезни у пациентов группы gravis начальная активность термогенеза и скорость катаболических процессов была выше в 6,5 раз по сравнению с идеальной нормой (АСТ = 195: 30 МЕ/л) и в 2,6 раза выше (195: 75,5 МЕ/л) по сравнению с пациентами группы mitis (рис. 1).
В подгруппе gravis выжившие и в группе mitis уровни АСТ не различались (71,6 и 75,5 МЕ/л соответственно).
Как известно, усиление термогенеза (повышение температуры тела до 38,5–39,5 оС, ощущение жара, увеличение частоты дыхательных движений, повышение артериального давления, учащение сердцебиения и мочеиспускания) наблюдается в начале заболевания у большинства пациентов с дифтерией ТII–ТIII.
В 1934 г. Н.К. Розенберг так описывал дифтерию: «Дифтерийный токсин поражает вначале аппарат, регулирующий тепловой баланс организма, сосудодвигательный центр, симпатическую нервную систему». Как замечательно клиническое описание соответствует биохимическому термину «повышенный термогенез»! Это он заставляет больных дифтерией обращаться за медицинской помощью в первые дни болезни, а врача – оценить метаболические сдвиги в организме больного в самом начале инфекционного процесса.
Сошлемся на совет известного физиолога И.В. Давыдовского «не упускать из виду тот факт, что все события в организме имеют компенсаторно-приспособительный или адаптационный характер» [14].
По нашему мнению, усиление катаболических процессов путем активации термогенеза необходимо для эффективной санации внутренней среды организма и удаления большого фонда денатурированных белков системы комплимента, компонентов свертывания крови (фибриноген, продукты деградации фибриногена и фибрина) и субстратов воспаления из кровеносного русла [11, 12]. Сжигание отработанных белков будет происходить в метаболической «печке» митохондрий, «дровами» для которой будут белки, а регулятором подачи кислорода – АСТ. Эта трансаминаза определяет степень разогрева метаболической «печки»: при минимальных значениях АСТ механизм термогенеза работает в экономном режиме «печки-буржуйки», при максимальных – в режиме «доменной печи». Клинически важно, что вследствие активации термогенеза регистрируется повышение температуры тела в интервале от 37 до 40 оС.
Ведущему механизму, направленному на санацию внутренней среды организма, должен соответствовать адекватный путь «утилизации отходов горения». Данную функцию выполняет глюконеогенез, который регулирует анаболические обменные процессы. Как известно, для эффективной работы катаболических и анаболических процессов необходим достаточный аминокислотный запас в виде фонда свободного (в плазме крови) и связанного (в эритроцитах) уровня общего белка [13].
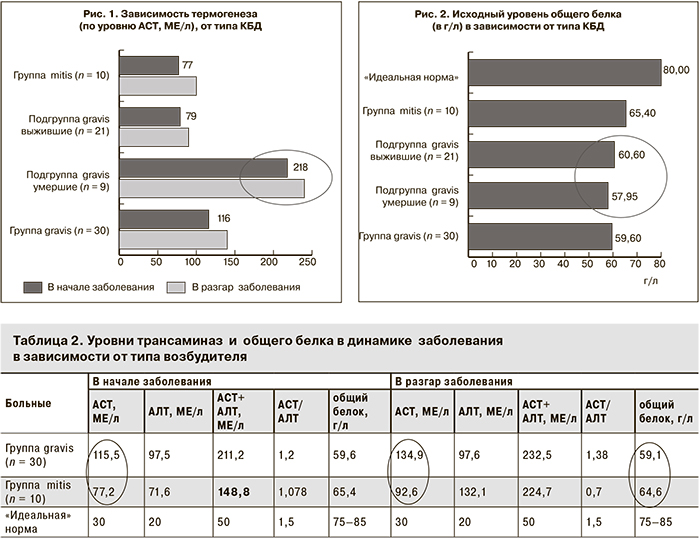
При токсической дифтерии наличие белковых запасов в кровеносном русле особенно актуально в силу невозможности нормального проглатывания пищи из-за отека ротоглотки и потерь белка с мочой при поражении почек (токсический нефроз). Биохимическое исследование уже в начале заболевания выявляет дефицит белка [75–65 = 10 х 30 = 300 (!) г] в организме (рис. 2), который усугубляется в разгаре заболевания за счет трех-семикратного усиления процессов термогенеза и сгорания белков в митохондриальной печи. У пациентов с неблагоприятным прогнозом (подгруппа gravis умершие) термогенез уже в начале заболевания был втрое выше (АСТ – 217,9 МЕ/л), чем в подгруппе gravis «выжившие» (АСТ – 78,5 МЕ/л), а соподчиненный с ним глюконеогенез подавлен (АЛТ – 81 МЕ/л в подгруппе gravis умершие и 101 МЕ/л в подгруппе gravis выжившие; табл. 2).

Анализ биохимического статуса показал, что при неблагоприятном течении дифтерии процесс обеспечения глюкозой – основным энергетическим и дыхательным субстратом клеток (глюконеогенез) – угнетен. У больных подгруппы gravis умершие с первых дней наблюдалась выраженная разбалансированность катаболических и анаболических процессов: высокий термогенез (АСТ – 217,9 МЕ/л, нарастание до 236,5 МЕ/л) и низкий глюконеогенез (АЛТ – 81 МЕ/л) с усугублением «метаболического кризиса» в разгар заболевания (рис. 3).
В группе mitis сумма трансаминаз (149 МЕ/л) в начале болезни ниже, чем в группе gravis (211 МЕ/л) и в подгруппе gravis выжившие (180 МЕ/л), что клинически согласуется с более благоприятным течением дифтерии, вызванной штаммом mitis (см. рис. 3)
Следовательно, суммарная активность трансаминаз – это «цена адаптации», отражающая степень напряжения ферментных систем, которые организму необходимо затратить для возврата в состояние здоровья [13].
В разгар заболевания в подгруппе gravis умершие трансаминазная «нагрузка» продолжает нарастать с 299 до 392 МЕ/л, тогда как в подгруппе gravis выжившие она постепенно снижается со 180 до 149 МЕ/л (см. табл. 3). В разгар болезни в подгруппе gravis умершие запас пула свободных аминокислот в крови продолжает снижаться до 57, 2 г/л.
У больных дифтерией в группе mitis содержание общего белка выглядит более благополучным как в начале (65,4 против 59,6 г/л), так и в разгар болезни (64,6 против 59,1 г/л). Следовательно, у данных пациентов имеется дополнительный резерв «прочности» метаболических процессов в виде 150 г тканевого белка.
Вероятно, этот белковый резерв обеспечивает большую адаптационную приспособленность и лучшую выживаемость больных. Свободный пул аминокислот может быть направлен на восполнение запаса израсходованных и синтез новых биохимических субстратов, обеспечивающих выздоровление.
Полученные данные послужили основой для продолжения работы. В результате удалось установить, что суммарный биохимический статус пациентов с дифтерией gravis в разгар заболевания характеризовался более выраженными признаками метаболического токсикоза: достоверной разницей в уровне фибриногена – белка воспаления; большей нагрузкой на альбуминовый (32,2 г/л – gravis, 34,8 г/л – mitis) и эритроцитарный барьеры детоксикации. Результатом токсического гемолиза при дифтерии, вызванной КБД gravis, было снижение числа эритроцитов (gravis – 3,7 х 1012/л, mitis – 4,2 х 1012/л) и скорости их оседания (21 и 17 мм/ч соответственно), повышение в крови содержания прямого билирубина (16,7 и 11,8 мкмоль/л) и, наконец, различная динамика специфического фермента токсикоза – β-глюкуронидазы (22,0 и 18,9 Е/л).
Нам удалось обнаружить довольно редкое при токсических формах дифтерии явление – невостребованность магния – важнейшего микроэлемента, участвующего в процессах сборки нуклеиновых кислот (рРНК). Среднее значение уровня магния в крови возрастало в 1,5 раза (1,58 ммоль/л) по сравнению с контролем (0,68 ммоль/л). Низкий резерв свободных аминокислот в крови (общий белок в группе gravis – 60,1 г/л, в группе mitis – и 63,9 г/л) в сочетании с «невостребованностью» магния (4,05 и 2,04 ммоль/л соответственно) указывает на тотальное угнетение анаболических (белок-синтетических) и макроэргических процессов при дифтерии. При исходно одинаковой скорости трансмембранных потоков (ЩФ), наработка мембранопротекторных субстратов (креатинфосфат) и макроэргических соединений (АДФ, АТФ) при дифтерии, вызванной КБД gravis, происходит в 2 раза хуже (КФК = 65,4 МЕ/л), чем при дифтерии, вызванной КБД mitis (КФК = 101 МЕ/л).
Разный уровень биоэнергетического потенциала и разная степень угнетения анаболических процессов, наконец, подтверждаются разными усилиями, затрачиваемыми ферментными системами организма для восстановления гомеостаза. Степень нагрузки ферментных систем – это и есть «цена адаптации», затрачиваемая организмом для возврата в состояние здоровья. Для больных дифтерией, вызванной КБД gravis, она заметно выше (АСТ + АЛТ = 247 МЕ/л), чем для пациентов с дифтерией, вызванной КБД mitis (170,4 МЕ/л).
Следовательно, среди прочих факторов, влияющих на прогноз заболевания, целесообразно учитывать тип возбудителя – КБД gravis или mitis. Биохимическая картина в динамике наблюдения позволяет более точно определить степень тяжести дифтерии. Дифтерия, вызванная КБД gravis, протекает тяжелее, с большим числом осложнений и с большей степенью нагрузки на ферментные системы.
Выводы
- Токсическая дифтерия, вызванная КБД mitis – клинически и биохимически более благоприятный вариант заболевания. Меньшая нагрузка метаболических систем (АСТ, АЛТ) и больший «запас прочности» (пул свободных АМК в крови) обеспечивают лучшую перспективу выздоровления данной группе пациентов.
- Биохимические сдвиги в большей степени отражают тяжесть течения заболевания, чем устоявшийся критерий – отек подкожной клетчатки шеи.
- Пересмотр существующей российской классификации дифтерии по-прежнему актуален.


