Гепатит С (ГС) является основной причиной формирования всей группы хронических болезней печени. Это вызвано тем, что вирус ГС (ВГС) способен ускользать от иммунного контроля, создавая новые генетические и антигенные варианты, задерживать формирование Т-хелперного и Т-киллерного ответа при остром ГС, что в 70–80% случаев может способствовать хронизации инфекции, а также вызывать реинфекцию у выздоровевших людей [1]. Все это заставляет исследователей задуматься о правильном выборе эффективных препаратов, режимов терапии и ее продолжительности, критериев оценки эффективности противовирусной терапии (ПВТ) [2, 3].
На конечные результаты лечения влияет множество факторов как со стороны вируса, так и со стороны «хозяина», в том числе состояние иммунной системы и генетические маркеры пациента. Однако успехи в изучении закономерностей иммунопатологических и генетических процессов при ХГС определяются не только направлением научного поиска, но и теми методическими приемами, которые используются для решения поставленных задач. Гетерогенность ответа больных ХГС на ПВТ свидетельствует о необходимости поиска факторов, позволяющих его прогнозировать [4].
Современные фармакогенетические аспекты ХГС позволяют по-новому взглянуть на указанные проблемы, а фармакогеномика ХГС дает ответы на многие вопросы о генетических аспектах ГС. В первом десятилетии XXI века реализован глобальный проект Genome-Wide Association Study (GWAS) – расшифровка генома человека и изучение взаимосвязи между специфическими полиморфизмами единичных нуклеотидов (ПЕН) разных генов и особенностями различных заболеваний. В последние годы установлена ассоциация генетических особенностей «хозяина» по результатам анализа ПЕН гена интерлейкина-28В (ИЛ-28B) с частотой устойчивого вирусологического ответа (УВО) при проведении ПВТ [5].
В настоящее время точно установлено, что изменения в кластере генов цитокинов ИЛ-28А, ИЛ-28B и ИЛ-29, локализованном на 19-й хромосоме (19q13) человека, являются основным фактором, определяющим особенности противовирусной защиты организма. Наибольшее значение имеет полиморфизм в регионе, примыкающем к гену ИЛ-28B [6].
 ИЛ-28В представляет собой интерферон-λ-3 и является лигандом цитокинового рецептора II класса. Эти лиганды запускают JAK/STAT сигнальный каскад, активируя синтез 2´,5´-олигоаденилат-синтетазы, который активирует эндонуклеазу. Эндонуклеаза, в свою очередь, участвует в процессах стимуляции образования фермента протеинкиназы, который блокирует синтез вирусных белков. Показано, что полиморфизмы ИЛ-28В определяют как вероятность самопроизвольной элиминации ВГС, так и ответ на терапию интерфероном и рибавирином [7].
ИЛ-28В представляет собой интерферон-λ-3 и является лигандом цитокинового рецептора II класса. Эти лиганды запускают JAK/STAT сигнальный каскад, активируя синтез 2´,5´-олигоаденилат-синтетазы, который активирует эндонуклеазу. Эндонуклеаза, в свою очередь, участвует в процессах стимуляции образования фермента протеинкиназы, который блокирует синтез вирусных белков. Показано, что полиморфизмы ИЛ-28В определяют как вероятность самопроизвольной элиминации ВГС, так и ответ на терапию интерфероном и рибавирином [7].
Изучение роли генетического полиморфизма указанных регионов человеческого генома показало, что положительное предсказательное значение полиморфизма ИЛ-28В выше значения других базовых характеристик – предикторов успеха терапии [индекса массы тела, возраста, стадии фиброза и вирусной нагрузки (ВН)]. Однако в исследованиях на больших популяциях больных ХГС с разным клиническим профилем (стадия фиброза печени от F0 до F4, низкий или высокий исходный уровень виремии) было показано, что предсказательное значение генотипа ИЛ-28В для достижения УВО может существенно модифицироваться данными клиническими характеристиками и снижаться с 74,4 до 37,3% для пациентов с генотипом С/С. Поэтому по-прежнему необходимо учитывать базовые характеристики стадии заболевания конкретного пациента, но в комплексе с его генетическими маркерами [8, 9].
Таким образом, определение вариантов полиморфизма генотипа ИЛ-28В может изменить алгоритм принятия решения о лечении путем изменения длительности как стандартного курса, так и тройной терапии ХГС.
Цель работы – определить клинико-генетические критерии ответа на стандартную ПВТ у больных ХГС.
Материалы и методы
Было обследовано 70 больных ХГС в возрасте от 18 до 70 лет из московской когорты. Пациенты наблюдались с 2000 по 2010 г. на базе клинического отдела инфекционной патологии и научно-консультативного клинико-диагностического центра Центрального НИИ эпидемиологии Роспотребнадзора (далее – ЦНИИЭ).
Все диагностические вмешательства проводили в строгом соответствии с требованиями биомедицинской этики на основании разрешения локального этического комитета. У всех пациентов было получено письменное добровольное информированное согласие на проведение исследования. В исследование были включены лица в возрасте от 18 лет и старше с верифицированным диагнозом ХГС, не злоупотребляющие алкоголем и не применяющие наркотические средства в течение последних 6 мес.
Больные ХГС были разделены на 2 группы: 1-ю группу составили 37 больных, ответивших на стандартную двойную ПВТ ИФН-α и рибавирином с дозированием по массе тела, 2-ю – 33 больных, не ответивших на ПВТ. Общее число больных в сравниваемых группах и их распределение по гендерному признаку (мужчин – 25 и 18, женщин –12 и 15 соответственно) было сопоставимо. Средний возраст больных (35,2 ± 1,3 и 40,8 ± 2,0 года соответственно) был также аналогичен.
Диагноз ХГС устанавливали на основании данных эпидемиологического анамнеза (указание на перенесенные операции и другие парентеральные вмешательства, переливания крови и ее компонентов, визиты к стоматологу, внутривенные инъекции наркотиков), клинико-анамнестических данных (наличие симптомов гепатита в течение 6 мес. и более, гепатоспленомегалии, определяемой при объективном исследовании физикальными методами), результатов лабораторных исследований (характерные изменения биохимических показателей и обнаружение маркеров ВГС методами ИФА и ПЦР, фиброэластометрии печени).
Количественный анализ РНК ВГС в сыворотке крови проводили методом ПЦР в лаборатории ЦНИИЭ с использованием тест-системы «АмплиСенс HCV-Монитор» (ЦНИИЭ, Москва). Генотипирование ВГС проводили методом ПЦР с помощью коммерческой тест-системы «АмплиСенс HCV-генотип» (ЦНИИЭ, Москва). В основе принципа генотипирования лежит амплификация с праймерами, специфичными для разных генотипов.
Генотипирование полиморфных локусов (rs12979860, rs8099917) гена ИЛ-28В осуществляли методом ПЦР в реальном времени, используя комплект реагентов для определения генетических полиморфизмов ИЛ-28В (НПО «ДНК-Технология», Россия).

Статистическую обработку результатов проводили с помощью лицензированных программ IBM SPSS Statistics 21.0 и статистического модуля программы Microsoft Excel 2010. Для оценки статистической значимости различий между независимыми выборками использовали U-критерий Манна–Уитни и t-критерий Стьюдента, между связанными выборками – W-критерий Вилкоксона.
Результаты и обсуждение
Для более полной характеристики больных ХГС была проанализирована зависимость УВО на лечение от длительности инфицирования на основании данных эпидемиологического анамнеза. При этом не выявлено достоверной разницы между числом больных в сравниваемых группах по продолжительности болезни (5–10 лет, более 10 лет). В то же время необходимо подчеркнуть, что во 2-й группе не было больных с длительностью инфицирования от 1 года до 5 лет. Это свидетельствует о значимости такого показателя, как длительность инфицирования, для ответа на ПВТ, так как все пациенты со сроком болезни менее 5 лет оказались в 1-й группе.
При определении генотипа ВГС установлено, что в 1-й группе генотип 1 определялся лишь в 29,7% случаев, тогда как во 2-й – в 72,7% (р < 0,001). Соответственно генотип «не 1» в 1-й группе был выявлен в 70,3% случаев, тогда как во 2-й – только в 27,3% (р < 0,001).
ВН до лечения колебалась у больных 1-й группы от 1,0 х 104 до 6,8 х 107, у больных 2-й группы – от 1,8 х 104 до 5,2 х 107. При этом ВН > 400 000 МЕ/мл была у 18 (48,6%) и 17 (51,5%) больных соответственно, то есть показатели значимо не отличалось, так же как и при ВН < 400 000 МЕ/мл. Однако при анализе показателей ВН в зависимости от генотипа выявлено, что уровень РНК ВГС > 400 000 МЕ/мл встречался достоверно чаще в 1-й группе у больных с генотипом «не 1» (78,9%), чем с генотипом 1 (21,1%; p < 0,001).
У больных 2-й группы достоверно чаще регистрировалась ВН < 400 000 МЕ/мл при ВГС генотипа 1: 62,5% против 22,2% при генотипе «не 1» (р < 0,01). И наоборот, более высокая ВН была у пациентов с ВГС генотипа «не 1»: 77,8% против 37,5% при генотипе 1 (р < 0,05).
Таким образом, выраженность виремии не была освязана с ответом на ПВТ, но более высокие показатели ВН достоверно чаще регистрировались у больных с ВГС генотипа «не 1».
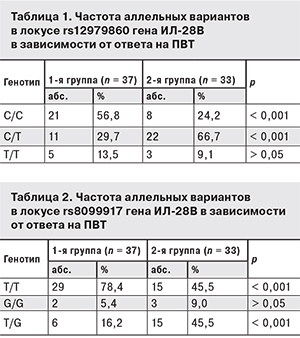
Была проанализирована взаимосвязь ответа на ПВТ от наличия различных аллельных вариантов в локусах rs12979860 (табл. 1) и rs8099917 (табл. 2) гена ИЛ-28B.
Как видно из табл. 1, число больных с генотипом С/С в локусе rs12979860 гена ИЛ-28B в 1-й группе было достоверно выше, чем во 2-й (р < 0,001). Генотип С/Т, наоборот, регистрировался значительно чаще у больных 2-й группы (р < 0,001). Аналогичные результаты получены и в локусе rs8099917 гена ИЛ-28B. Так, чаще отвечали на лечение больные ХГС с генотипом Т/Т (р < 0,001), не ответили на ПВТ пациенты с генотипом T/G (р < 0,001).
Следовательно, у больных 1-й группы достоверно чаще регистрировали генотипы С/С (rs12979860) и Т/Т (rs8099917).
В дальнейшем было проанализировано распределение генотипов С/С (rs12979860) и Т/Т (rs8099917) в зависимости от генотипа ВГС и ответа на терапию.
В табл. 3 представлен удельный вес разных генотипов в локусе rs12979860 гена ИЛ-28B в зависимости от ответа на лечение и генотипа вируса. У больных 1-й группы, независимо от генотипа ВГС, чаще встречался генотип С/С: (р > 0,05). Однако необходимо подчеркнуть, что пациенты с ВГС генотипа 1, имевшие генотип Т/Т в локусе rs12979860 гена ИЛ-28B, достоверно чаще отвечали на лечение, чем такие же больные с ВГС генотипа «не 1» (р < 0,05).
У больных 2-й группы в локусе rs12979860 гена ИЛ-28B генотип С/Т регистрировался при ВГС генотипов 1 и «не 1» с одинаковой частотой – 66,7%. Генотип Т/Т в этой группе у пациентов с ВГС генотипа «не 1» выявлен не был.
Таким образом, в 1-й группе у больных ХГС чаще встречался генотип Т/Т в локусе rs12979860 гена ИЛ-28B при ВГС генотипа «не 1». Во 2-й группе, напротив, чаще выявляли генотип С/Т при ВГС генотипов как 1, так и «не 1». Достоверных различий в удельном весе других генотипов не обнаружено.
При анализе генотипов в локусе rs8099917 гена ИЛ-28B у больных не выявлено значимых различий как по генотипам ВГС, так и в зависимости от ответа на терапию. Так, у больных 1-й группы в большинстве случаев регистрировался генотип Т/Т при ВГС генотипов как 1 (63,6%), так и «не 1» (84,6%). Минимальной была доля генотипа G/G: при ВГС генотипа 1 – 9,1%, «не 1» – 3,9%. Во 2-й группе генотипы Т/Т и Т/G встречались практически с одинаковой частотой при ВГС генотипов как 1, так и «не 1», а генотип G/G регистрировался только при генотипе 1.
Представляло интерес изучение удельного веса генотипов локуса rs12979860 в гене ИЛ-28B одновременно в зависимости от генотипа ВГС и ответа на ПВТ. Как видно из табл. 3, генотип С/Т у больных ХГС, вызванным ВГС генотипа 1, во 2-й группе регистрировался у 66,7% больных, а в 1-й – только у 18,2% (р < 0,01). Не выявлено значимых различий в соотношении разных генотипов при ВГС генотипа «не 1» как в 1-й, так и во 2-й группах, а также генотипов локуса rs12979860 в гене ИЛ-28B в зависимости от генотипа ВГС и ответа на терапию.
Результаты проведенного исследования показали, что на ПВТ реже отвечали больные с ВГС генотипа 1, чем «не 1»: 29,7% против 70,3% соответственно. Выявлена значимость для ответа на ПВТ такого показателя, как длительность инфицирования, так как все больные со сроком заболевания менее 5 лет были в 1-й группе. Показано, что уровень ВН не был связан с ответом на ПВТ, но более высокие показатели (> 106) достоверно чаще регистрировались у больных с ВГС генотипа «не 1».
Следовательно, предикторами неблагоприятного ответа на ПВТ можно считать следующее: инфицирование ВГС генотипа 1, длительность заболевания более 5 лет, генотип С/Т в локусе rs12979860 гена ИЛ-28B.
Таким образом, выявлена взаимосвязь длительности заболевания, генотипа ВГС и генотипа ИЛ-28B с ответом на ПВТ. Показано, что инфицирование ВГС генотипа «не 1», длительность заболевания менее 5 лет, генотип С/С в локусе rs12979860 ИЛ-28B являются благоприятными прогностическими клинико-генетическими маркерами ответа на стандартную двойную терапию у больных ХГС.


