В настоящее время значительное увеличивается количество пациентов с ожирением, а высокие темпы роста и широкая распространенность этой патологии позволяют говорить об ожирении как о новой «неинфекционной эпидемии». По данным ВОЗ, в 2008 г. более 1,7 млрд человек в возрасте 20 лет и старше имели избыточный вес, из них 25,0% (свыше 500 млн человек) страдали от ожирения. По прогнозам экспертов ВОЗ, к 2025 г. ожидается увеличение количества лиц с ожирением почти в 2 раза [1]. В России уже сейчас распространенность избыточной массы тела и ожирения составляет 46,5% среди мужчин и 51,7% среди женщин [2]. На фоне ожирения увеличивается риск сердечно-сосудистых заболеваний, сахарного диабета 2-го типа, синдрома обструктивного апноэ во сне и бесплодия. [3].
Ожирение способствует развитию неалкогольной жировой болезни печени (НАЖБП). У больных с ожирением стеатоз печени развивается в 95–100% случаев и трансформируется в стеатогепатит у 20–47% пациентов. Распространенность НАЖБП в странах Европы оценивают в 20–30% от общей популяции [4, 5]. Ведущая роль в патогенезе НАЖБП принадлежит нарушению углеводного и липидного обмена, а пусковым моментом в каскаде метаболических нарушений является инсулинорезистентность (ИР) [6, 7]. Первичная форма НАЖБП развивается на фоне метаболического синдрома или отдельных его компонентов. Вторичная форма НАЖБП наблюдается на фоне лекарственных поражений печени, синдрома избыточного бактериального роста, хирургических вмешательств на тонком кишечнике и при хроническом гепатите С (ХГС), который также широко распространен в популяции. У большинства пациентов ХГС протекает доброкачественно на протяжении длительного времени, и только у 20–30% он прогрессирует с формированием цирроза, печеночной недостаточности, портальной гипертензии и гепатоцеллюлярной карциномы. Сочетание ожирения с метаболическими нарушениями, включая ИР и сахарный диабет 2-го типа, играют роль в прогрессировании заболевания и увеличивают риск отсутствия ответа на противовирусную терапию ХГС [8].
Цель исследования – выявление влияния ожирения на метаболические параметры, прогрессирование фиброза у больных ХГС и исходы противовирусной терапии.
Материалы и методы
Были обследованы 205 больных ХГС с вирусом (НСV) генотипов 1 и 3 в возрасте от 18 до 69 лет, средний возраст 44,2 ± 10,3 года. Среди больных ХГС преобладали мужчины – 128 человек (62,4%) и больные с вирусом генотипа 1 – 123 человека (60,0%). Проведен сравнительный анализ лабораторных показателей в группе больных ХГС с ожирением (n = 53) и без ожирения (n = 152). Контрольную группу составили 44 пациента с ожирением. Группы были сопоставимы по полу, возрасту и индексу массы тела (ИМТ). Комбинированную противовирусную терапию [пегилированный интерферон-α-2а (ПегИФН-α-2а) или -α-2b (ПегИФН-α-2b) + рибавирин] получили 156 человек.
Оценку эффективности противовирусной терапии проводили на основании определения уровня РНК HCV после 4, 12 и 24 недель терапии при НСV генотипа 3, после 48 недель – при НСV генотипа 1, а также через 24 недели после ее окончания. Под устойчивым вирусологическим ответом (УВО) понимали отрицательный уровень РНК HCV в плазме крови через 24 недели после окончания противовирусной терапии.
Все пациенты подписали информированное согласие на участие в исследовании. Наблюдение проводилось в течение 2011–2014 гг. инфекционистом и эндокринологом в условиях кабинета амбулаторного приема Ставропольского краевого клинического консультативно-диагностического центра. Обследование проводили в соответствии с национальными рекомендациями по диагностике и лечению взрослых больных гепатитом С (2012–2013). Проведены клинические, антропометрические, биохимические, гормональные исследования. Для исключения гипотиреоза исследовали содержание тиреотропного гормона и свободного тиротоксина. Определяли содержание в крови кортизола, пролактина, лютеинизирующего и фолликулостимулирующего гормона, тестостерона. Определяли концентрации общего холестерина (ХС), триглицеридов (ТГ), ХС липопротеидов низкой (ЛПНП) и высокой плотности (ЛПВП) на автоматическом биохимическом анализаторе Konelab 30i («Thermo Scientific», Финляндия). Концентрацию инсулина (в мкЕД/ мл) устанавливали на микропланшетном ридере ELx800 («ФинБио», Финляндия). Для более точной оценки степени ИР использовали индекс HOMA (Homeostasis model assessment), определявшийся по уравнению:
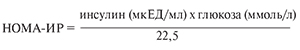
На наличие ИР указывают величины ≥ 2,77.
Тканевую чувствительность к инсулину определяли по индексу QUICKI (quantitative insulin sensitivity check index):
![]()
где I0 – инсулин в сыворотке крови натощак, G0 – глюкоза в сыворотке крови натощак.
Показатели 0,382 ± 0,007 расцениваются как норма, 0,331 ± 0,010 – как тканевая инсулиновая резистентность и 0,304 ± 0,007 – как сахарный диабет [9].
Концентрацию 25(OH)D в крови определяли с апреля по октябрь методом электрохемилюминисценции (анализатор Cobas e 411, Япония; реагенты – «Roche Diagnostics GmbH», Германия). Оптимальным и адекватным считается сывороточный уровень 25(OH)D ≥ 30 нг/мл [10]. Большинство исследователей определяют сывороточное содержание менее 9 нг/мл как дефицит, 10–30 нг/мл – недостаточность, а уровень менее 30 нг/мл – как «неадекватную обеспеченность» 25(OH)D [10].
Для диагностики и оценки степени фиброза использовали метод пункционной биопсии и ФиброТест («ВioPredective», Франция). Для определения стадии фиброза печени применяли систему полуколичественной оценки фиброза печени METAVIR (1994). Наличие жировой дистрофии печени определяли с помощью ультрасонографического исследования и теста СтеатоСкрин («ВioPredective», Франция). Пункционная биопсия печени проведена 25 больным ХГС с ожирением и 37 больным ХГС с ИМТ < 30 кг/м2.
Метаболический синдром определяли по критериям Международной федерации диабета (IDF, 2005), согласно которым для постановки диагноза необходимо наличие абдоминального ожирения и дополнительно двух из следующих критериев: снижение уровня ХС ЛПВП ниже 1,0 ммоль/л у мужчин и 1,2 ммоль/л – у женщин или специфическое лечение этого вида дислипидемии; гипертриглицеридемия более 1,7 ммоль/л или специфическое лечение этого вида дислипидемии; повышение уровня глюкозы в плазме крови натощак более 5,6 ммоль/л, или наличие сахарного диабета 2-го типа; нарушение толерантности к глюкозе; повышение систолического АД более 130 мм рт. ст. или диастолического – более 85 мм рт. ст. или лечение ранее выявленной артериальной гипертензии. Абдоминальное ожирение определяли при окружности талии у мужчин > 94 см, у женщин – > 80 см.
Критериями исключения были регулярное употребление алкоголя (более 30 г в день для мужчин и более 20 г в день для женщин в пересчете на этанол), а также коинфекция с другими вирусами (HВV, HАV, HDV, HIV), лекарственные и аутоиммунные гепатиты.
С помощью монитора состава тела OMRON BF-508 («Omron Healthcare Co., Ltd», Япрония) определяли процент подкожного и висцерального жира методом биоэлектрического импеданса. Измерение проводили не менее чем через 2 ч после завтрака или обеда. Интерпретация результатов измерения процентного содержания жира в организме основывалась на рекомендациях D. Gallagher [11] и зависела от пола и возраста пациентов:
- для женщин в возрасте 20–39 лет нормальное содержание жира в организме составляет 21–32,9%, для мужчин того же возраста – 8,0–19,9%;
- для женщин в возрасте 40–59 лет – 23,0–33,9%, для мужчин – 11–21,9%;
- для женщин в возрасте 60–79 лет – 24,0–35,9%, для мужчин – 13,0–24,9%.
Содержание висцерального жира от 1–9% считалось вариантом нормы, 10–14% расценивалось как высокий уровень и 15–30% – как очень высокий.
Для статистического анализа данных использовали пакет программ «Primer of Biostat 4,0», «STATISTICA 7.0». Для оценки межгрупповых различий применяли однофакторный дисперсионный анализ. Достоверными считали различия при p < 0,05. При отсутствии нормального распределения совокупности использовали непараметрический аналог критерия Стьюдента – критерий Манна–Уитни (при сравнении двух выборок). Количественные данные представлены в виде средней величины (М) и стандартного отклонения (SD). Для оценки достоверности различий качественных показателей использовали таблицы сопряженности с расчетом показателей χ2 с поправкой Йейтса, вычисляли отношение шансов (ОШ) и определяли 95% доверительный интервал (95% ДИ). Диагностическую ценность признаков определяли по их чувствительности, специфичности, положительной и отрицательной предсказательной ценности и точности.
Результаты и обсуждение
Пациенты с ХГС и ожирением не отличались по возрасту от больных ХГС с ИМТ < 30 кг/м2: соответственно 37,5 ± 18,5 и 35,9 ± 12,7 года. ХГС, вызванный вирусом генотипа 1, среди тучных пациентов встречался достоверно реже, чем среди больных с нормальным и избыточным весом. Преимущественными жалобами в обеих группах были слабость и тяжесть в правом подреберье. На фоне ожирения чаще выявляли гепатомегалию [у 35 из 53 пациентов (66,0%)] по сравнению с пациентами с ИМТ < 30 кг/м2 [у 36 из 152 пациентов (23,7%)] (χ2 = 37,28; р < 0,001). Активность печеночных энзимов (АЛТ, АСТ, ГГТ, ЩФ), уровни общего и конъюгированного билирубина в обеих группах достоверно не различались. У больных ХГС с ожирением был более высокий индекс гистологической активности (ИГА) по Knodell (11,0 ± 2,4 и 9,8 ± 3,1 баллов соответственно; р = 0,006) и более высокий (в среднем 2,6 ± 1,0 и 2,3 ± 0,8 баллов; р = 0,03) по шкале METAVIR при отсутствии достоверных различий в уровне вирусной нагрузки (ВН) – 5,0 ± 1,3 и 5,3 ± 1,3 log10 МЕ/л.
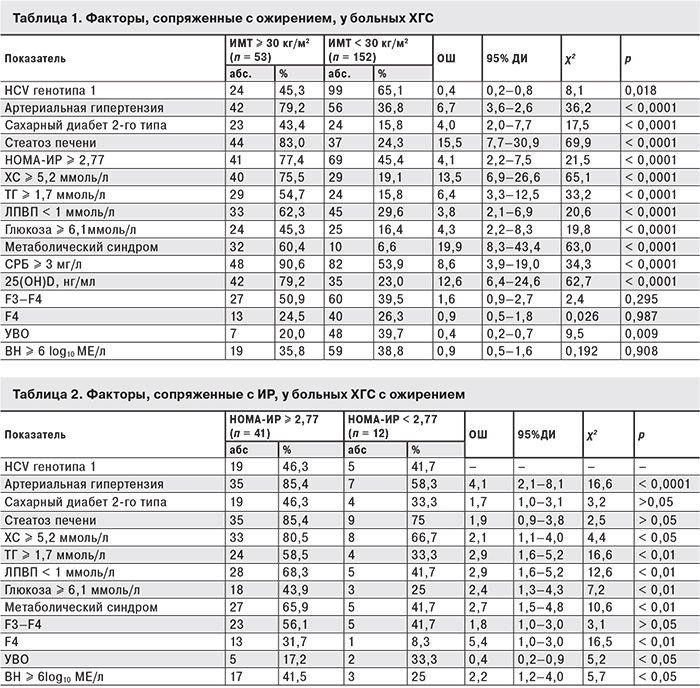
С ожирением были сопряжены отдельные компоненты метаболического синдрома, такие как артериальная гипертензия, гиперхолестеринемия, гипертриглицеридемия, снижение уровня ЛПВП, стеатоз печени и сахарный диабет. Процент больных с фиброзом печени F3–F4 по шкале METAVIR и циррозом печени и высокой ВН достоверно не отличался в обеих группах (табл. 1).
На фоне ожирения значительно увеличивались шансы развития как отдельных компонентов метаболического синдрома (артериальной гипертензии, ИР, сахарного диабета, стеатоза печени и гиперхолестеринемии), так и самого синдрома (наличие трех и более критериев).
У больных с ожирением в 2,5 раза уменьшались шансы получить УВО на комбинированную противовирусную терапию. С ожирением также было сопряжено вялотекущее воспаление, определяемое по уровню С-реактивного белка (СРБ), и неадекватная (≤ 30 нг/мл) обеспеченность витамином 25(OH)D.
Поскольку не у всех больных с ожирением развивается ИР, среди тучных пациентов были выделены больные с НОМА-ИР ≥ 2,77 (n = 41) и НОМА-ИР < 2,77 (n = 12). Как видно из табл. 2, с ИР были сопряжены факторы атерогенной дислипидемии (повышение уровня ТГ, снижение уровня ЛПВП), гипергликемия, а также развернутая картина метаболического синдрома. Кроме того, ИР у больных с ожирением ассоциировалась с развитием цирроза печени и еще более низким ответом на противовирусную терапию. Следует отметить, что ИР на фоне ожирения ассоциировалась с высокой ВН.
У тучных больных ХГС с ИР значительно увеличивались шансы развития цирроза печени, артериальной гипертензии, факторов, сопряженных с метаболическим синдромом (рис. 1).
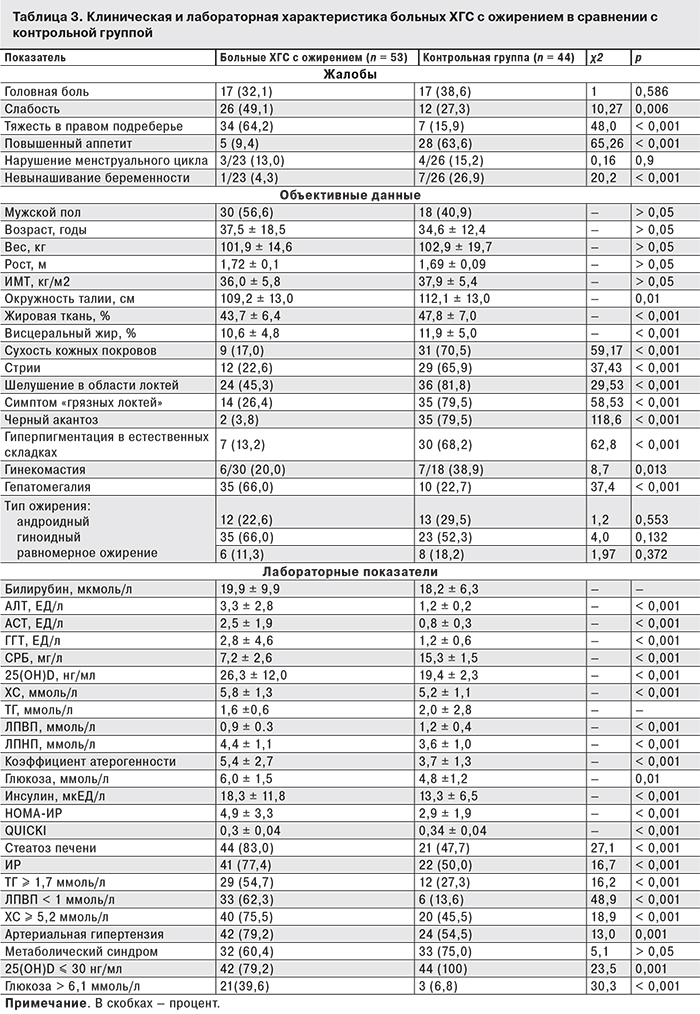
При исследовании у пациентов контрольной группы показателей тиреотропного гормона, кортизола, пролактина и тестостерона каких-то значимых изменений гормональноого профиля зафиксировано не было. Фактически ожирение было экзогенно-конституциональным. У больных ХГС с ИМТ ≥ 30 кг/м2 наиболее типичными жалобами были слабость и тяжесть в правом подреберье, а у пациентов контрольной группы, напротив, в 6,8 раз чаще регистрировали повышенный аппетит. По поводу невынашивания беременности женщины контрольной группы обращались за медицинской помощью в 6,3 раза чаще, чем пациентки с ХГС и таким же весом и (табл. 3). Отягощенный наследственный анамнез по ожирению и сахарному диабету 2-го типа чаще наблюдался в контрольной группе: у 10 (22,7%) и 8 (18,2%) пациентов соответственно. У 3 (5,7%) больных ХГС с ожирением был отягощенный семейный анамнез по сахарному диабету 2-го типа (р = 0,033) и у 7 (13,2%) – по ожирению, однако в данном случае разница была недостоверна (р = 0,18).
Длительность заболевания (по развитию ожирения) не различалась в обеих группах и составляла 12,9 ± 9,6 года у больных ХГС и 12,9 ± 11,9 года в контрольной группе. У больных ХГС с ИМТ ≥ 30 кг/м2 были более низкие показатели окружности талии, процентное содержания как жировой ткани, так и висцерального жира. В контрольной группе чаще встречались стигмы ожирения: так называемый симптом Бэра – симптом «грязных локтей», стрии, пигментация в местах трения, формирование акантоза тучных, нечистота кожи. В обеих группах наиболее часто встречался гиноидный (бедренно-феморальный) тип ожирения. Андроидный тип ожирения, характерный для формирования ИР, наблюдали у 1/4 больных ХГС и 1/3 пациентов контрольной группы.
У женщин контрольной группы (n = 26) превышение содержания жировой ткани составляло 17,1 ± 5,3%, что было достоверно выше, чем у пациенток с ХГС (n = 23) – 12,4 ± 8,8% (р = 0,03). У мужчин контрольной группы (n = 18) содержание висцерального жира превышало норму на 8,1 ± 5,9%, что также было выше, чем у пациентов с ХГС (n = 30) – 3,4 ± 5,6% (р= 0,008).
Активность печеночных энзимов была достоверно выше у больных ХГС. Значения СРБ были высокими в обеих группах, но в контрольной группе они были выше. Учитывая, что у пациентов контрольной группы уровень СРБ превышал 10 мг/л, было проведено дополнительное обследование и исключены другие причины повышения этого маркера. В обеих группах содержание 25(OH)D соответствовало уровню неадекватной обеспеченности (≤ 30 нг/мл), но в контрольной группе оно было достоверно ниже.
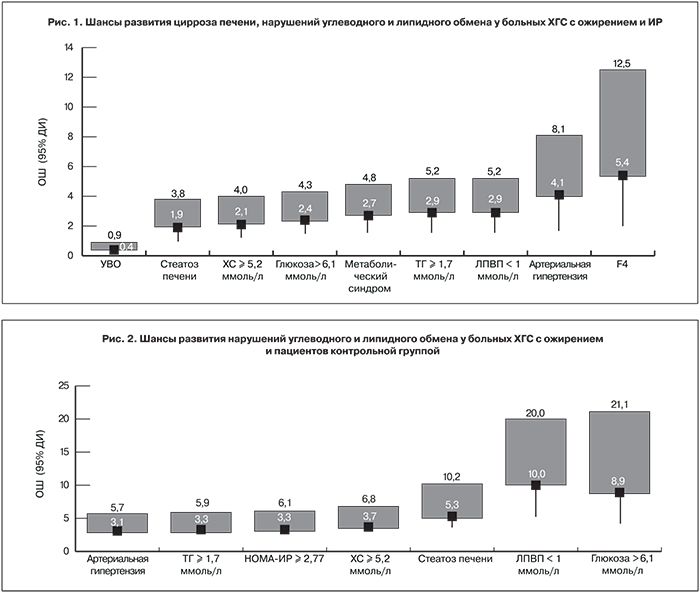
У больных ХГС были более выражены нарушения липидного и углеводного обмена: повышен уровень ХС, отмечено возрастание атерогенной субфракции ХС ЛПНП и снижен уровень ЛПВП. Коэффициент атерогенности в 1,5 раза превышал показатели в контрольной группе. ИР у больных ХГС была обусловлена более высоким содержанием глюкозы и инсулина в крови. Кроме того, тканевая чувствительность к инсулину, определяемая по индексу QUICKI, у больных ХГС соответствовала показателям при сахарном диабете. Среди больных ХГС был достоверно выше процент пациентов с компонентами метаболического синдрома: гиперхолестеринемией, гипертриглицеридемией, низким уровнем ЛПВП и гипергликемией. ИР у больных ХГС регистрировали в 1,7 раза, а стеатоз печени – в 1,4 раза чаще, чем в контрольной группе. Шанс развития артериальной гипертензии, гипертриглицеридемии и ИР был в 3 раза выше у больных ХГС с ожирением. Наличие гепатита С увеличивало риск развития стеатоза печени в 5 раз, а гипергликемии – в 9 раз (рис. 2).
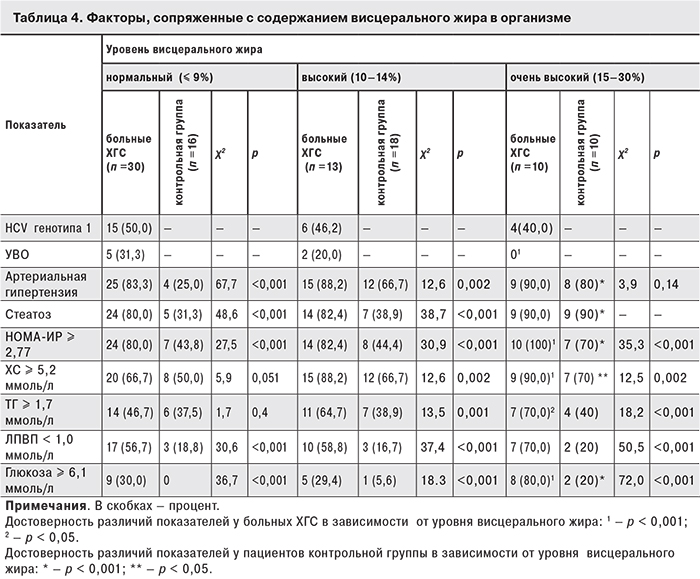
Поскольку у больных с ожирением окружность талии, а также содержание висцерального жира сопряжены с формированием ИР [12], были проанализированы показатели липидного и углеводного обмена у больных ХГС и пациентов контрольной группы в зависимости от содержания висцерального жира (табл. 4).
Как видно из табл. 4, у больных ХГС с нормальным и высоким содержанием висцерального жира не выявлено преобладания какого-либо генотипа HCV. Среди пациентов с очень высоким содержанием висцерального жира больных с HCV генотипа 1 было меньше (40%), чем с HCV генотипа 3, но разница была недостоверна. Больные ХГС с очень высоким уровнем висцерального жира не отвечали на лечение (χ2 = 82,7; р < 0,001). На фоне повышения уровня висцерального жира в группе больных ХГС выявлено достоверно больше пациентов с ИР и отдельными компонентами метаболического синдрома. Наличие стеатоза печени и артериальной гипертензии не зависело от уровня висцерального жира, так как регистрировалось у 80–83% пациентов даже при нормальном содержании висцеральной жировой ткани.
В контрольной группе с повышением уровня висцерального жира возрастало число больных с нарушениями углеводного обмена. Число больных с артериальной гипертензией и стеатозом печени также увеличивалось пропорционально повышению уровня висцерального жира.
У больных ХГС с ожирением в сравнении с пациентами контрольной группы нарушения липидного и углеводного обмена зафиксированы даже при нормальном содержании висцерального жира, и по мере увеличения жировой ткани эти показатели оставались более высокими.
В данном исследовании подтверждена связь ожирения у больных ХГС с высоким риском развития как отдельных компонентов метаболического синдрома, так и самого синдрома [13].
Еще в 1999 г. L.F. Hourigan [14] показал предикторную роль HCV-инфекции в развитии стеатоза печени и фиброза печени. В нашем исследовании у больных ХГС с ожирением также был более высокий индекс гистологической активности по Knodell и индекс фиброза по шкале METAVIR. У больных ХГС с ожирением и ИР значительно возрастали шансы развития цирроза печени и атерогенной дислипидемии.
В исследованиях A.L. Mason и соавт. [15] и A.G. Madny и соавт. [16] подтверждена роль HCV-инфекции в развитии сахарного диабета 2-го типа. На фоне ожирения шанс достичь УВО на противовирусную терапию снижался в 2,5 раза. Предложенные исследователями механизмы сниженного ответа на терапию включают ассоциацию с метаболическим синдромом, наличие стеатоза печени, увеличение индекса фиброза, наличие системного воспаления и уменьшение биодоступности ПегИФН [17, 18]. Отражением вялотекущего системного воспаления были достоверно более высокие показатели СРБ. В настоящее время повышение уровня СРБ расценивают как прямое следствие ожирения, курения и сахарного диабета. В частности, повышение концентрации СРБ имеет место при метаболическом синдроме, отражая состояние хронического подострого воспаления [19, 20]. Состояние воспаления, наблюдающееся при метаболическом синдроме, может быть обусловлено совокупностью двух основных факторов: повышенной секрецией провоспалительных цитокинов адипоцитами или макрофагами, инфильтрирующими жировую ткань, а также снижением продукции противовоспалительных факторов, таких как адипонектин, на фоне избыточного накопления жира в организме [21]. У подавляющего большинства пациентов с ожирением (как у больных ХГС, так и в контрольной группе) выявлена неадекватная обеспеченность 25(OH) D. Его низкий уровень коррелирует с артериальной гипертензией, развитием сахарного диабета, степенью ИР независимо от наличия ожирения [22, 23] и таким образом влияет на соответствующий уровень глюкозы в организме [24], участвует в метаболизме липидов и метаболическом гомеостазе при ожирении [25].
Несмотря на то что больные ХГС и пациенты контрольной группы не различались по гендерным и антропометрическим показателям, различия были как в характере жалоб, так и в клинических проявлениях. У пациентов контрольной группы чаще встречались стигмы ожирения (гиперкератоз локтей, черный акантоз, стрии и др.), что ранее расценивалось как первичные гипоталамические нарушения. В настоящее время формирование этих стигм расценивают как следствие и проявление ожирения, а степень их выраженности коррелирует с длительностью и тяжестью ожирения и возникающих при нем трофических расстройств.
В силу того, что именно висцеральное ожирение, а не просто высокий ИМТ коррелирует лучше всего с повышенным риском сердечно-сосудистых заболеваний и диабета [20], были проанализированы показатели углеводного и липидного обмена в зависимости от уровня висцерального жира. Следует отметить, что у больных ХГС были более выраженные нарушения углеводного и липидного обмена. Так, ИР и стеатоз печени наблюдались у 80% больных даже при нормальном уровне висцеральной жировой ткани.
Учитывая, что больные не различались по ИМТ, а показатели окружности талии и процентное содержание висцерального жира были выше в контрольной группе, нельзя исключить влияния НСV на формирование стеатоза печени и ИР у больных ХГС.
Ожирение у больных ХГС приводило к выраженным нарушениям метаболических параметров, увеличивало риск артериальной гипертензии и низкого ответа на противовирусную терапию, достоверно чаще ассоциировалось с циррозом печени (особенно на фоне ИР). Учитывая неблагоприятное влияние ожирения и ИР на прогрессирование заболевания, высокий риск развития атерогенной дислипидемии и гипергликемии, а также низкий ответ на противовирусную терапию, целесообразно выделять группу больных с ожирением, ИР и висцеральным ожирением, у которых первоочередной задачей является нормализация веса для минимизации рисков прогрессирования фиброза печени и повышения эффективности противовирусной терапии ИФН.


