Значительное снижение заболеваемости корью и краснухой в Республике Беларусь в последние годы послужило толчком для более пристального внимания к другим, клинически сходным с ними инфекциям. В первую очередь это относится к парвовирусной инфекции (ПВИ). Возбудитель – парвовирус В19 – распространен во всем мире и вызывает широкий спектр клинических проявлений. Основной формой заболевания является инфекционная эритема, которая проявляется макулопапулезной сыпью, лихорадкой, неспецифическими симптомами острых респираторных заболеваний, преходящими артропатиями и встречается в любом возрасте [1, 2]. У лиц с врожденной гемолитической анемией парвовирус В19 вызывает развитие апластического криза, у иммунокомпрометированных пациентов он может явиться причиной тяжелой хронической анемии [3]. Заболевание у женщин во время беременности может приводить к спонтанным абортам, развитию водянки плода и его гибели [4].
Сходство клинических проявлений ПВИ и других инфекционных и неинфекционных заболеваний создает существенные трудности для дифференциальной диагностики и требует применения лабораторных методов для верификации диагноза [5]. В Республике Беларусь с 2005 г. проводится диагностика ПВИ среди пациентов с подозрением на корь и краснуху. Выявление таких пациентов организовано во всех регионах страны в рамках выполнения Программы по элиминации этих инфекций в Европейском регионе ВОЗ, их лабораторное обследование проводится в республиканской референс-лаборатории по кори и краснухе, созданной на базе Республиканского научно-практического центра эпидемиологии и микробиологии. На наличие маркеров ПВИ исследуются сыворотки крови, в которых отсутствуют лабораторные критерии кори и краснухи.
Проведенные исследования показали, что в Республике Беларусь в настоящее время в структуре возбудителей острых экзантемных заболеваний парвовирус В19 составляет от 10 до 50% [6]. Однако официальная регистрация ПВИ в стране отсутствует, что не позволяло проводить эпидемиологический анализ. В этих условиях данные, накопленные в течение 10 лет в республиканской референс-лаборатории по кори и краснухе, представляются значимыми и наиболее полными для получения эпидемиологической характеристики. Данное исследование было посвящено изучению закономерностей эпидемического процесса ПВИ в Беларуси за период 2005–2014 гг. на основании анализа лабораторно верифицированных случаев экзантемной формы заболевания.
Материалы и методы
Забор образцов от пациентов с острой экзантемой проводили в соответствии с национальными регулирующими документами: национальными планами мероприятий по элиминации кори и краснухи на 2008–2010 и 2011–2012 гг., санитарными правилами и нормами по предотвращению заноса и распространения кори и краснухи. Лабораторному обследованию подлежали пациенты, соответствующие стандартному определению случаев кори и краснухи для целей эпидемиологического надзора [7].
 За период 2005–2014 гг. на наличие IgM-антител к парвовирусу В19 были исследованы 2742 сыворотки крови, полученные у лиц с острой экзантемой в возрасте до 64 лет, проживавших во всех регионах страны. Подтверждение острой ПВИ было получено в 821 случае.
За период 2005–2014 гг. на наличие IgM-антител к парвовирусу В19 были исследованы 2742 сыворотки крови, полученные у лиц с острой экзантемой в возрасте до 64 лет, проживавших во всех регионах страны. Подтверждение острой ПВИ было получено в 821 случае.
IgM-антитела к парвовирусу В19 выявляли методом ИФА с использованием коммерческих наборов Parvovirus B19 IgM Enzyme Immunoassay («Biotrin», Ирландия), Parvovirus B19 IgM ELISA («DRG», Германия), Parvovirus B19 IgG/IgM («Virion/Serion», Германия) согласно инструкциям производителей.
Заболеваемость ПВИ рассчитывали по интенсивным показателям на 100 тыс. совокупного населения или соответствующей возрастной группы. Для исключения влияния случайных факторов динамические ряды проверяли на «выскакивающие» величины по критерию Шовене. Многолетнюю тенденцию заболеваемости определяли методом наименьших квадратов по параболе 1-го порядка и оценивали по среднему темпу прироста (Тпр.ср.). Цикличность оценивали по отношению к параболе 1-го порядка. Годами благополучия считали годы, фактические показатели которых были статистически значимо меньше нижнего доверительного интервала теоретического показателя, рассчитанного по уравнению параболы 1-го порядка (y = 0,03x + 0,62), неблагополучия – соответственно те годы, фактические показатели которых были статистически значимо больше верхнего доверительного интервала теоретического показателя.
Годовую динамику оценивали по типовой и групповым кривым, построенным по среднемноголетним помесячным данным за годы благополучия и неблагополучия. Для выявления сезонного подъема применяли метод Пуассона. Даты начала и окончания сезонного подъема определяли методом подобных треугольников.
Возрастную структуру заболевших изучали в группах населения до 3 лет, 4–6, 7–10, 11–14, 15–19, 20–29, 30–39, 40–49 лет и 50 лет – 64 года. Возрастную группу риска определяли по экстенсивным, интенсивным показателям и показателю относительного риска (ОР). Доверительные интервалы (ДИ) определяли методом Клоппера–Пирсона [8–10].
Результаты и обсуждение
Многолетняя динамика заболеваемости
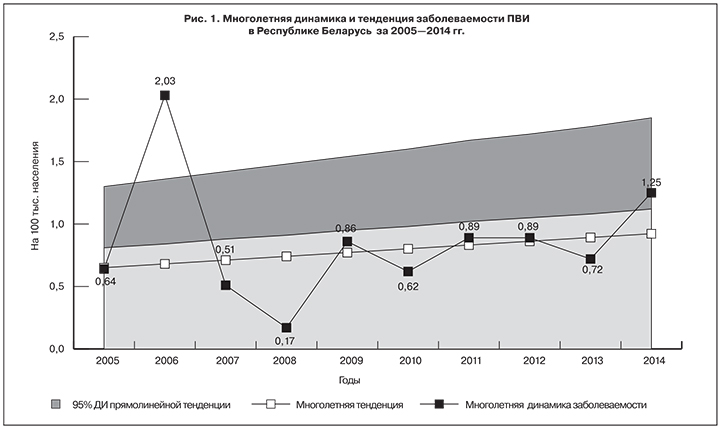
Среднемноголетний показатель заболеваемости за 10-летний период составил 0,86 на 100 тыс. населения (95% ДИ 0,68–1,06) и колебался от 0,17 в 2008 г. до 2,03 в 2006 г. Минимальный и максимальный показатели различались в 11,9 раза. В 2006 г. выявлена «выскакивающая» величина, что свидетельствует об имевшей место вспышке инфекции и отражает влияние случайных факторов на формирование эпидемического процесса ПВИ. По оценочным данным, оно составило 0,7 на 100 тыс. населения (95% ДИ 0,54–0,87), что соответствует 68,2 (95% ДИ 66,58–69,86) случая заболевания в год. В целом период 2005–2014 гг. характеризовался умеренной многолетней тенденцией к росту заболеваемости ПВИ (R² = 0,07; Тпр.ср. – 3,84%; p < 0,05) (рис. 1).

В многолетней динамике заболеваемости с 2005 по 2014 гг. по отношению к прямолинейной тенденции можно выделить 3 полных периода продолжительностью от 1,5 до 3,5 лет. Однако колебания заболеваемости по отношению к тенденции были незначительны, и при оценке статистической значимости различий фактических и теоретических показателей заболеваемости ПВИ в каждом году оказалось, что в 2006–2008, 2010 и 2014 гг. фактические показатели выходят за пределы ДИ соответствующих теоретических показателей заболеваемости.
Колебания показателей фактической заболеваемости по отношению к тенденции в годы, когда показатели не выходят за пределы ДИ, носят случайный характер и не отражают усиления влияния периодических факторов на эпидемический процесс ПВИ. Годами неблагополучия, для которых установлено влияние периодических факторов, являлись 2006 и 2014 гг., доля циклической надбавки (сила влияния) составила 36,3 и 10,4% соответственно. Годами благополучия считали 2007, 2008 и 2010 гг. Анализ влияния периодических факторов позволяет предположить, что цикличность эпидемического процесса составила 9 лет, фаза неблагополучия длилась почти 2 года (2006 г. – IV квартал 2007 г.), фаза благополучия – около 7 лет (IV квартал 2007 г. – II квартал 2014 г.).
Считается, что для стран с умеренным климатом характерны подъемы заболеваемости ПВИ каждые 3–5 лет [11–13], ряд авторов [14, 15] отмечают, что цикличность может увеличиваться до 6–7 лет. Как правило, эти данные касаются оценки периодов между подъемами заболеваемости либо регистрацией крупных вспышек. Следует учитывать, что официальная регистрация ПВИ в большинстве стран не проводится, поэтому исходные данные о заболеваемости, которые можно использовать для полноценного эпидемиологического анализа, отсутствуют [14].

Для выявленного в нашем исследовании характера многолетней динамики заболеваемости наиболее вероятным представляется следующее объяснение. Учитывая низкую заболеваемость корью и краснухой, при проведении надзора за этими инфекциями в Беларуси применяется рекомендованный ВОЗ критерий, согласно которому в течение 1 года должно быть выявлено не менее 2 пациентов с подозрением на корь или краснуху на 100 тыс. населения, у которых обе инфекции были лабораторно отвергнуты. В 2005–2008 гг. одни регионы (в частности, Минск, где в 2006 г. была зарегистрирована вспышка ПВИ) направляли на исследование большое число образцов, другие выявляли только единичные подозрительные случаи [6]. Начиная с 2009 г. (после принятия Министерством здравоохранения Республики Беларусь дополнительных мер), все регионы выявляют и направляют на лабораторное обследование пациентов с острой экзантемой из расчета 3–4 случая на 100 тыс. населения [16]. Умеренная многолетняя тенденция к росту заболеваемости обусловлена, вероятнее всего, постепенным повышением охвата надзорными мероприятиями и более активным выявлением пациентов с острой экзантемой на всей территории страны в последние годы. В то же время увеличение числа лабораторно подтвержденных случаев никогда не регистрировалось одновременно по всей территории страны, а происходило в каждом регионе в разные годы [17, 18], как это наблюдается и в других странах. Так, 2006 и 2014 гг. являлись годами неблагополучия и характеризовались подъемом заболеваемости практически во всех регионах страны, в 2007, 2008 и 2010 г. снижение заболеваемости наблюдалось также практически повсеместно. В остальные годы незначительные колебания заболеваемости в разных регионах невелировали друг друга, что и определило установленную цикличность ПВИ в Республике Беларусь.
 Годовая динамика заболеваемости
Годовая динамика заболеваемости
Случаи ПВИ выявлялись круглогодично. Для годовой динамики заболеваемости по типовой кривой, построенной по среднемноголетним данным за 2005–2014 гг., характерно неравномерное распределение показателей по месяцам (рис. 2). Наиболее низкую заболеваемость регистрировали с июля по январь, когда ее показатели колебалиась от 0,02 до 0,06 на 100 тыс. населения с минимальным значением в августе. С февраля начинался рост заболеваемости, к марту показатели достигали максимальных значений и находились примерно на одном уровне (0,11–0,13 на 100 тыс. населения) с марта по июнь. Резкое снижение до уровня круглогодичной заболеваемости происходило в июле, в течение 1 мес. Верхний предел круглогодичной заболеваемости составлял 0,06 на 100 тыс. населения. Сезонный подъем начинался 2 февраля, заканчивался 25 июля, его длительность составляла 5 мес. 24 дня.
При изучении типовой кривой было установлено, что в 69,5% случаев годовая заболеваемость была обусловлена круглогодичными факторами, сезонная надбавка составила 30,5%. Максимальный показатель в марте (0,13 на 100 тыс. населения) превышал верхний предел круглогодичной заболеваемости (0,06 на 100 тыс. населения) в 2,13 раза, что отражает достаточно высокую интенсивность сезонного подъема.
Динамика заболеваемости в годы эпидемического благополучия и неблагополучия существенно различалась (рис. 3).
В годы эпидемического неблагополучия минимальные показатели заболеваемости регистрировались с августа по декабрь и колебались от 0,02 до 0,05 на 100 тыс. населения с минимальными значениями в ноябре и декабре. С января начинался постепенный рост заболеваемости, продолжавшийся до апреля (0,33 на 100 тыс. населения), затем заболеваемость снижалась с мая по август. Верхний предел показателей круглогодичной заболеваемости составлял 0,06 на 100 тыс. населения. Сезонный подъем начинался 14 января, заканчивался 9 августа, его длительность составляла почти 7 мес. В годы неблагополучия 34,2% случаев заболеваний ПВИ было обусловлено круглогодичными факторами, сезонная надбавка составила 65,8%. Максимальный показатель заболеваемости в апреле (0,33 на 100 тыс. населения) превысил верхний предел круглогодичной заболеваемости (0,06 на 100 тыс. населения) в 5,8 раза, что отражает значительную интенсивность сезонного подъема.
В годы эпидемического благополучия минимальные показатели заболеваемости регистрировались с июня по декабрь и колебались от 0,01 до 0,04 на 100 тыс. населения, то есть практически не отличались от показателей в месяцы межсезонного периода в годы неблагополучия (0,02–0,05 на 100 тыс. населения). Наиболее низкой заболеваемость была в августе и октябре. С января она незначительно возрастала и достигала максимального уровня к марту, то есть на 1 мес. раньше, чем в годы неблагополучия. Максимальный показатель заболеваемости составил 0,07 на 100 тыс. населения и был в 4,7 раза ниже, чем в годы неблагополучия (0,33 на 100 тыс. населения). Снижение заболеваемости происходило в течение двух месяцев, и достигало межсезонного уровня в июне. Верхний предел круглогодичной заболеваемости составлял 0,04 на 100 тыс. населения и был на 33,3% ниже, чем в годы неблагополучия. Сезонный подъем начинался 28 января, лишь на 14 дней позже, чем в годы неблагополучия, а заканчивался 13 июня, почти на 2 мес. раньше. Его длительность составляла 4 мес. 17 дней. В сравнении с годами неблагополучия он был короче на 2 мес. и 10 дней.
В годы благополучия 87,5% случаев заболеваний ПВИ было обусловлено круглогодичными факторами, сезонная надбавка составила лишь 12,5%. Максимальный показатель заболеваемости в марте (0,07 на 100 тыс. населения) превысил верхний предел круглогодичной заболеваемости (0,04 на 100 тыс. населения) на 42,9%, что отражало незначительную интенсивность сезонного подъема.
Установленный характер годовой динамики заболеваемости ПВИ соответствует описанной в литературе зимне-весенней сезонности этого заболевания. Однако так же, как и в случае многолетней динамики, эта сезонность отражала вспышки или подъемы заболеваемости, которые регистрировались в конце зимы–весной [14, 19–22]. Результаты 10-летнего наблюдения в Беларуси свидетельствуют о том, что максимальный уровень заболеваемости соответствует весенним месяцам в годы как неблагополучия, так и благополучия. При этом зимне-весенняя сезонность наблюдается в благополучные годы, а в годы неблагополучия сезонный подъем охватывает также 2 летних месяца, то есть имеет зимне-весенне-летний характер.
О существенном возрастании влияния сезонных факторов на заболеваемость ПВИ в годы неблагополучия также свидетельствуют различия сезонной и круглогодичной заболеваемости. Если круглогодичная заболеваемость в годы неблагополучия была лишь на 32,2% выше, чем в годы благополучия (0,56 против 0,38 на 100 тыс. населения), то сезонная – в 21,6 раза выше (1,08 против 0,05 на 100 тыс. населения) за счет более длительного и интенсивного сезонного подъема. В отдельные годы рост и снижение заболеваемости происходили за счет изменения как круглогодичных, так и сезонных факторов.
Возрастная структура
ПВИ была лабораторно подтверждена у лиц в возрасте до 64 лет. В среднем в 2005–2014 гг. в возрастной структуре доминировали дети 4–6 и 7–10 лет, на долю которых пришлось 23,14 и 23,51% случаев соответственно (см. таблицу).
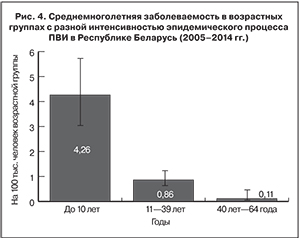
Учитывая разную численность возрастных групп, для оценки интенсивности эпидемического процесса показатели заболеваемости определяли в каждой из них отдельно. Наибольшие среднемноголетние показатели были зарегистрированы среди детей 4–6 и 7–10 лет: 6,76 (95% ДИ 4,31–10,90) и 5,34 (95% ДИ 3,22–8,35) на 100 тыс. детей соответствующей группы. Эти данные подтверждают характеристику ПВИ, в первую очередь, как детской инфекции [18, 23, 24]. Начиная с возрастной группы 11–14 лет интенсивность распространения инфекции снижается, однако она остается практически на одинаковом уровне вплоть до 30-летнего возраста и на несколько более низком – среди лиц до 40 лет (см. таблицу), что свидетельствует о постоянном вовлечении в эпидемический процесс не только подростков, но и взрослых. Наиболее низкие показатели заболеваемости, как и ожидалось, были в старших возрастных группах.
Анализ удельного веса лиц разного возраста в структуре заболевших и среднемноголетних показателей заболеваемости позволил выделить 3 группы населения (рис. 4):
- 1-я – с высокой интенсивностью эпидемического процесса – дети до 10 лет. Среднемноголетний показатель заболеваемости – 4,26 на 100 тыс. детей соответствующего возраста (95% ДИ 3,10–5,71), доля в структуре заболевших – 54,69% (95% ДИ 51,28–58,09);
- 2-я – со средней интенсивностью эпидемического процесса – возрастная группа 11–39 лет. Среднемноголетний показатель заболеваемости – 0,86 на 100 тыс. лиц соответствующего возраста (95% ДИ 0,59–1,21), доля в структуре заболевших – 40,93% (95% ДИ 37,56–44,29);
- 3-я – с низкой интенсивностью эпидемического процесса – возрастная группа от 40 до 64 лет. Среднемноголетний показатель заболеваемости – 0,11 на 100 тыс. лиц соответствующего возраста (95% ДИ 0,03–0,29), доля в структуре заболевших – 4,38% (95% ДИ 2,98–5,79).
Шансы заболеть ПВИ в 1-й группе были в 38,5 раза, а во 2-й – в 7,8 раза выше по сравнению с 3-й группой.
В 1-й группе основную долю заболевших составляли дети 4–6 и 7–10 лет (42,3 и 43,0% соответственно), вклад детей младше 4 лет был незначительным (14,7%). Во 2-й группе наиболее значимыми являлись возрастные группы 11–20 и 20–29 лет, к которым относились 38,1 и 40,5% заболевших соответственно. В 3-й группе среди заболевших преобладали лица в возрасте 40–49 лет (60,5%).
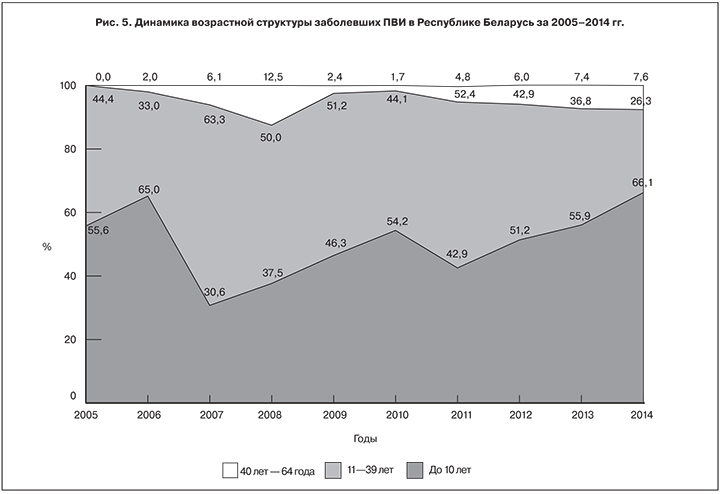
Изменение удельного веса разных возрастных групп в структуре заболевших в 2005–2014 гг. показано на рис. 5. В этот период, за исключением 2007–2009 и 2011гг., больше половины случаев ПВИ пришлось на долю детей в возрасте до 10 лет. Максимальная их доля (65,0 и 66,1%), наблюдалась в годы наибольшего подъема заболеваемости – в 2006 и 2014 гг. соответственно, минимальная (30,6 и 37,5%) была выявлена в годы наименьшей заболеваемости – в 2007 и 2008 гг.
Проведение в течение 10 лет лабораторной диагностики ПВИ среди пациентов с острой экзантемой позволило установить эпидемиологические закономерности этого заболевания в Республике Беларусь. Многолетняя динамика заболеваемости в период 2005–2014 гг. характеризовалась усилением влияния постоянно действующих факторов со средним темпом прироста 3,84%. Поскольку выявление пациентов с ПВИ происходило в рамках надзора за корью и краснухой, можно предположить, что рост числа лабораторно подтвержденных случаев был обусловлен улучшением качества надзорных мероприятий.
Эпидемически неблагополучными являлись лишь 2006 и 2014 гг., когда доля циклической надбавки составила 36,3 и 10,4% соответственно. Эпидемический цикл ПВИ, рассчитанный на основании кумулятивных данных по стране, был достаточно длительным и составлял 9 лет, из которых почти 7 лет являлись фазой благополучия.
Годовая динамика заболеваемости ПВИ в Беларуси формировалась под влиянием круглогодичных и сезонных факторов и характеризовалась зимне-весенне-летней сезонностью в годы неблагополучия и зимне-весенней – в годы благополучия. Сезонный подъем в годы неблагополучия продолжался почти 7 мес., с середины января до начала августа. В годы благополучия он продолжался чуть более 4 мес., поскольку начинался позднее и заканчивался на 2 мес. раньше. В годы эпидемического неблагополучия лишь в 34,2% случаев заболевания ПВИ были обусловлены круглогодичными факторами, сезонная надбавка составила 65,8%, в то время как в годы благополучия их доля составляла 87,5%, сезонная надбавка – 12,5%.
Увеличение интенсивности эпидемического процесса происходило преимущественно за счет сезонных факторов, влияние которых в годы неблагополучия была в 21,6 раза выше, чем в годы благополучия, в то время как влияние круглогодичных факторов возрастало лишь на 32,2%.
Основной возрастной группой распространения инфекции являлись дети 4–6 и 7–10 лет, заболеваемость среди которых составила 6,76 и 5,34, на 100 тыс. детей данного возраста соответственно и была в 4 и более раз выше, чем в других возрастных группах. Согласно среднемноголетним данным, в структуре заболевших доля детей этого возраста составляла более 45%. В то же время подростки и взрослые ежегодно вовлекались в эпидемический процесс. Среди лиц в возрасте 11–29 лет заболеваемость регистрировалась практически на одном уровне и несколько снижалась только в группе 30–39 лет. В сравнении с возрастной группой от 40 до 64 лет риск инфицирования у лиц 11–39 лет был в 8 раз выше. Активное распространение инфекции не только среди подростков, но и среди лиц детородного возраста свидетельствует о риске инфицирования женщин в период беременности с возможностью неблагоприятных исходов.


