Антиретровирусная терапия (АРТ) является международным стандартом лечения больных ВИЧ-инфекцией (ВОЗ, 2013). С ее помощью можно добиться контролируемого течения заболевания, то есть удается остановить прогрессирование болезни, предотвратить развитие вторичных заболеваний, увеличить продолжительность и улучшить качество жизни [1]. Антретровирусные препараты снижают вирусную нагрузку до минимальных показателей и замедляют развитие резистентности вируса к препаратам. При этом происходит восстановление показателей функции иммунной системы.
Согласно действующим Национальным рекомендациям по диспансерному наблюдению и лечению больных ВИЧ-инфекцией [1], под схемами первого ряда понимают схемы, назначаемые пациентам, ранее не получавшим АРТ. Стандартная схема АРТ включает 2 нуклеозидных ингибитора обратной транскриптазы ВИЧ (НИОТ) и третий препарат, которым может быть ненуклеозидный ингибитор обратной транскриптазы (ННИОТ).
Наиболее перспективными являются лекарственные препараты класса НИОТ, простые в употреблении, обладающие хорошей эффективностью в отношении резистентных форм вирусов, лишенные митохондриальной токсичности [2].
Фосфазид – препарат класса НИОТ, разработанный в России, отличается от азидотимидина благодаря фосфорсодержащему компоненту и более медленному формированию резистентности к ВИЧ-1 [3–5]. Он является аналогом тимидина и, конкурируя с ним в виде трифосфата, блокирует ключевой процесс репликации ретровирусов – обратную транскрипцию, на чем и основана терапевтическая эффективность по уменьшению концентрации ВИЧ в крови пациента.
На основании проведенного доклинического исследования фосфазида были изучены его токсикологические и фармакокинетические свойства [6]. Доказана высокая анти-ВИЧ-активность препарата in vitro c одновременно низким (значительно ниже, чем у зидовудина) уровнем цитотоксичности и токсичности для лабораторных животных [5]. Последующие клинические испытания фосфазида показали его безопасность и хорошую переносимость у взрослых ВИЧ-инфицированных пациентов [7, 8]. У них отсутствовали основные побочные эффекты, наблюдаемые при приеме зидовудина (анемия, нейтропения), а также были редкими нежелательные явления со стороны желудочно-кишечного тракта и головная боль [9].
Включение фосфазида в схемы АРТ позволило оценить эффективность и безопасность препарата. Первым исследованием схемы АРТ, включавший фосфазид, проведенным в соответствии с правилами надлежащей клинической практики (Good Clinical Practice – GCP), было испытание комбинации 3 ингибиторов обратной транскриптазы ВИЧ [10]. Использование фосфазида в комбинации с еще 1 НИОТ (зальцитабин или ламивудин) доказало хорошую переносимость и эффективность примененной терапии [11].
В 2001–2002 гг. сотрудниками Федерального научно-методического центра по профилактике и борьбе со СПИДом и Московского областного центра по профилактике и борьбе со СПИДом и инфекционными заболеваниями была проведена оценка эффективности и безопасности АРТ фосфазидом и диданозином в сочетании с «усиленным» ингибитором протеазы (саквинавир/ритонавир) у ВИЧ-инфицированных, ранее не получавших лечения [12]. Применяемые схемы терапии, включавшие фосфазид в комбинациях с диданозином и эфавирензом или нелфинавиром [13], или с видексом и вирамуном [10], вызывали положительную динамику показателей иммунитета на фоне снижения уровня вирусной нагрузки.
Обсуждалась возможность применения фосфазида в качестве монотерапии [14–16]. Доказана его эффективность и безопасность в составе АРТ у больных как хронической, так и острой ВИЧ-инфекцией [17].
Сравнительная оценка эффективности и безопасности применения фосфазида и абакавира в схемах АРТ была обсуждена при сочетанном лечении ПегИФН и рибавирином хронического гепатита С у больных ВИЧ-инфекцией. Выявлена низкая вероятность развития анемии по сравнению с зидовудином. Сочетание фосфазида (при сопоставлении с абакавиром) как с эфавирензом, так и с ингибитором протеазы, показало менее выраженное снижение абсолютного количества CD4+-лимфоцитов в процессе терапии хронического гепатита С [18].
С целью изучения нового комбинированного лекарственного средства на основе фосфазида и ламивудина в лаборатории вирусов иммунодефицита совместно с лабораторией Центра по экспертной оценке противовирусных и дезинфекционных средств ФГБУ «НИИ вирусологии им. Д.И. Ивановского» Минздрава России были проведены доклинические исследования на модели клеток человека, инфицированных ВИЧ-1 (острая инфекция), по подавлению в них вируса, изучению цитотоксического и противовирусного действия препарата (Д.Н. Носик и др., 2013).
Кроме этого, в ФГБУ «Российский кардиологический научно-производственный комплекс» Минздрава России проведено доклиническое токсикологическое изучении комбинированного лекарственного средства 8НР на основе фосфазида и ламивудина, изучены его фармакокинетика и относительная биодоступность (Е.В. Арзамасцев и др., 2014–2015).
Абакавир – аналог гуанозина, который при использовании в форме монопрепарата снижает вирусную нагрузку приблизительно на 1,4 lg10 через 4 недели приема [19]. Внутри клетки абакавир фосфорилируется с образованием карбовиртрифосфата, имеющего длительный период полувыведения [20]. В рандомизированных исследованиях была установлена относительная безопасность успешной терапии с включением абакавира [21].
Однако проблемой, связанной с применением абакавира, являются возможное развитие липоатрофии, а также реакция гиперчувствительности, которая определяется носительством аллеля HLA B*5701 молекулы первого класса комплекса гистосовместимости. Частота развития реакции гиперчувствительности у пациентов-носителей может доходить до 60% и характеризуется медленно нарастающей симптоматикой (лихорадка, ухудшение общего самочувствия, тошнота, боли в животе, кожная сыпь) [22].
Результаты когортных исследований безопасности терапии абакавиром свидетельствовали о незначительном повышении риска инфаркта миокарда, особенно у пациентов, впервые начавших лечение [23, 24]. Абакавир как монопрепарат не применяется в современной терапии.
Цель исследования – изучение эффективности антиретровирусного препарата фосфазид (в оптимальной дозе, доказанной предыдущими клиническими исследованиями) в сочетании с ламивудином в сравнении с препаратами абакавир + ламивудин в комбинированных схемах АРТ ВИЧ-инфицированных, ранее не получавших лечения.
Материалы и методы
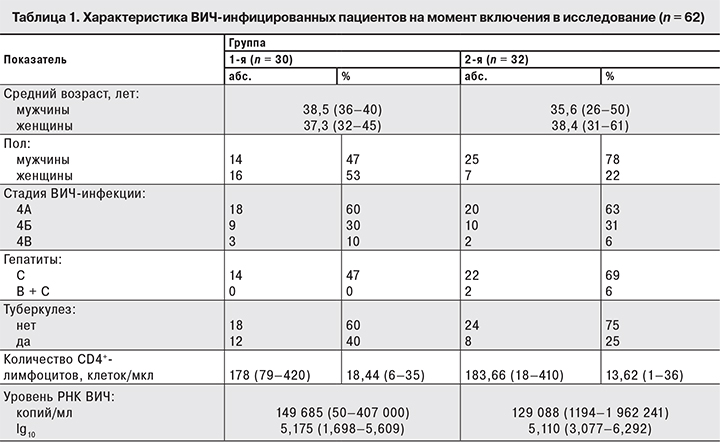
На базе Государственного казенного учреждения здравоохранения Пермского края «Пермский краевой центр по профилактике и борьбе со СПИД и инфекционными заболеваниями» в 2014–2015 гг. проведено открытое ретроспективное сравнительное исследование схем АРТ первого ряда, включающих фосфазид и абакавир, у 62 ВИЧ-инфицированных. Пациенты были разделены на 2 группы: в 1-ю вошли 30 пациентов, получавших фосфазид + ламивудин + эфавиренз, во 2-ю – 32 пациента, получавших абакавир + ламивудин + эфавиренз.
Фосфазид применяли по 800 мг в сутки в 2 приема. Абакавир, ламивудин и эфавиренз использовали в стандартных дозах.
Клиническое обследование включало выявление симптомов ВИЧ-инфекции у пациентов до назначения АРТ и далее в динамике лечения. Для оценки побочных явлений изучали параметры периферической крови и функциональных проб печени (АСТ, АЛТ), которые сравнивались с нормами, рассчитанными по Пермскому краю.
Для выявления сопутствующих заболеваний у каждого ВИЧ-инфицированного больного проведены серологические исследования методом иммуноферментного анализа (ИФА) для выявления НВsАg, антител к вирусам гепатита С, простого герпеса, цитомегаловирусу, токсоплазме, хламидиям и возбудителю сифилиса.
Диагноз ВИЧ-инфекции у всех больных установлен методом иммунного блотинга [Нью Лав Блот I (NEW LAV-BLOT I) сер. 9G1361, 9H0363] с использованием ИФА для обнаружения антител к ВИЧ-1 [Дженскрин Ультра ВИЧ Аг/Ат (Genscreen ULTRА HIV Ag-Ab)].
Определение показателей клеточного иммунитета для принятия решений о начале АРТ и оценки прогрессирования ВИЧ-инфекции проводили с помощью моноклональных антител фирмы «Becton Dickinson» (США) методом проточной цитометрии на цитофлуориметре FACSCalibur той же фирмы. Полученные результаты сравнивали с нормой [25], согласно которой количество CD4+-лимфоцитов в плазме крови колеблется в пределах 600–1900 клеток/мкл. Обращали внимание на процентное содержание CD4+-лимфоцитов, поскольку этот показатель менее вариабелен.
У ВИЧ-позитивных пациентов, получавших АРТ, определяли уровень РНК ВИЧ-1 в плазме крови методом ПЦР с помощью тест-систем «АмплиСенс RNK ВИЧ-монитор FRT» фирмы «ИнтерЛабСервис» (Россия); чувствительность ≈50 копий/мл.
Результаты и обсуждение
1-я группа пациентов, получавших схему АРТ, включающую фосфазид, состояла из 16 женщин в возрасте 32–45 лет и 14 мужчин в возрасте 36–40 лет. Во 2-ю группу пациентов, получавших схему АРТ с абакавиром, вошли 7 женщин в возрасте от 31 до 61 года и 25 мужчин в возрасте 26–50 лет. У всех пациентов установлена стадия 4 ВИЧ-инфекции с вторичными заболеваниями (гепатиты В и С, туберкулез).
Демографические и клинико-лабораторные характеристики пациентов, включая стадию ВИЧ-инфекции [1], медиану количества CD4+-лимфоцитов и медиану концентрации РНК ВИЧ-1 в плазме, отражены в табл. 1.
Миело- и гепатотоксичность у больных обеих групп не была выявлена в течение всего периода исследования.
Эффективности АРТ у всех пациентов определяли по уровню вирусной нагрузки, а также по абсолютному и относительному количеству CD4+-лимфоцитов в плазме крови до назначения терапии и через 12, 24, 36 и 48 недель от ее начала.
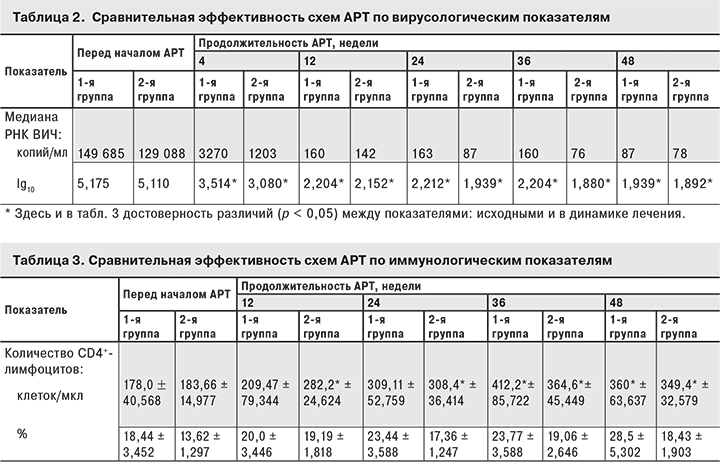
Известно, что ожидаемый ответ на терапию у больных, ранее не получавших АРТ, должен быть следующим: снижение вирусной нагрузки на 1,5–2,0 lg10 через 4 недели, до уровня < 50 копий/мл – через 24–48 недель от начала лечения. Значимыми считаются изменения уровня РНК ВИЧ на > 50% (на 0,3 lg10) (табл. 2).
Снижение уровня РНК ВИЧ-1 было достоверным в обеих группах, начиная с 4-й недели АРТ.
У пациентов 1-й группы исходный уровень РНК ВИЧ-1 составлял в среднем 149 685 (50–407 000) копий/мл. Через 4 недели АРТ он снизился до 3270 копий/мл (на 2 lg10) и продолжал снижаться до 48-й недели лечения. В 12, 24, и 36 недель исследования вирусная нагрузка была неопределяемой (< 50 копий/мл) у 79% больных, а в 48 недель – у 95%.
До начала АРТ во 2-й группе средний уровень РНК ВИЧ-1 составлял 129 088 (1194–1 912 245) копий/мл, через 4 недели он снизился до 1203 копий/мл (на 2 lg10). В 12, 24, 36 и 48 недель исследования вирусная нагрузка была неопределяемой у 88% больных.
Таким образом, снижение вирусной нагрузки на 2 lg10 через 4 недели от начала терапии соответствует оптимальному и стабильному вирусологическому ответу у не лечившихся ранее ВИЧ-инфицированных, получающих АРТ.
Количество CD4+-лимфоцитов у пациентов обеих групп до начала лечения достоверно не отличались и составляло < 350 клеток/мкл. На фоне АРТ за 48 недель у больных 1-й группы оно увеличилось на 182 клетки/мкл (со 178 до 360) и во 2-й группе – на 166 клеток/мкл (со 183 до 349) (табл. 3).
Положительная динамика количества CD4+-лимфоцитов на фоне адекватного снижения вирусной нагрузки доказала эффективность применяемых схем АРТ.
Клинического прогрессирования ВИЧ-инфекции за время наблюдения не было отмечено ни у одного больного.
Выводы
- Через 48 недель терапии подавление репликации ВИЧ достигнуто у 95% пациентов 1-й группы и у 88% пациентов 2-й группы, что свидетельствует о высокой эффективности назначенных схем АРТ.
- Повышение количества CD4+-лимфоцитов более чем на 100 клеток/мкл свидетельствует о позитивном влиянии на иммунный статус ВИЧ-инфицированных схем АРТ, включающих как фосфазид + ламивудин, так и сабакавир + ламивудином.
- Применение новой комбинированной формы фосфазида и ламивудина предполагает не только эффективность лечения, но и повышение приверженности к нему на фоне широко применяемой в схемах АРТ комбинации абакавир + ламивудин [26].


