Несмотря на многочисленные работы, посвященные изучению HBV-инфекции, проблема диагностики и профилактики вирусных гепатитов остается актуальной. По данным ВОЗ, более 240 млн человек имеют хронические инфекции печени, ежегодно в мире регистрируется более 1 млн летальных исходов, связанных с хроническими осложнениями или фульминантными формами вирусных гепатитов. Гепатит В (ГВ) занимает первое место среди причин смерти больных с патологией печени. Вирус ГВ (HBV) может длительное время находиться в латентном (скрытом) состоянии в ткани печени, а в некоторых случаях – и в крови HBsAg-отрицательных пациентов [1, 2]. По результатам некоторых исследований [3], латентные формы ГВ характеризуются отсутствием клинической симптоматики, и лишь у пятой части пациентов обнаруживается активная вирусная репликация по HBeAg и/или по ДНК HBV. Особую опасность скрытый ГВ представляет при донорстве крови и трансплантации органов [4, 5]. Согласно Федеральному закону от 20 июля 2012 г. № 125-ФЗ «О донорстве крови и ее компонентов», одним из основных принципов донорства крови и (или) ее компонентов является их безопасность.
Целью нашего исследования явилось HBV-тестирование донорской крови, в том числе выявление скрытых и латентных форм инфекции.
Материалы и методы
На базе Республиканского центра крови Министерства здравоохранения Республики Татарстан по г. Казани в 2010–2014 гг. обследовано 61 155 доноров. Проанализированы карты отведенных от донорства HВsAg-положительных лиц, а также HBsAg-отрицательных лиц с положительным результатом на анти-HBcor (сумм.), в том числе в сочетании с положительным результатом на анти-HBcor IgM и/или превышением уровня аланинаминотрансферазы (АЛТ) в сыворотке крови.
Специфическая лабораторная диагностика основывалась на ИФА с определением HBsAg, анти-HBcor IgM, анти-HBcor (сумм.) с использованием коммерческих наборов реагентов фирмы «Вектор-Бест» (Новосибирск).
Был проведен многолетний анализ заболеваемости HBV-инфекцией в Российской Федерации и Республике Татарстан, эпидемиологический анализ с расчетом показателей распространенности и встречаемости HBV-инфекции среди доноров.
Результаты исследования
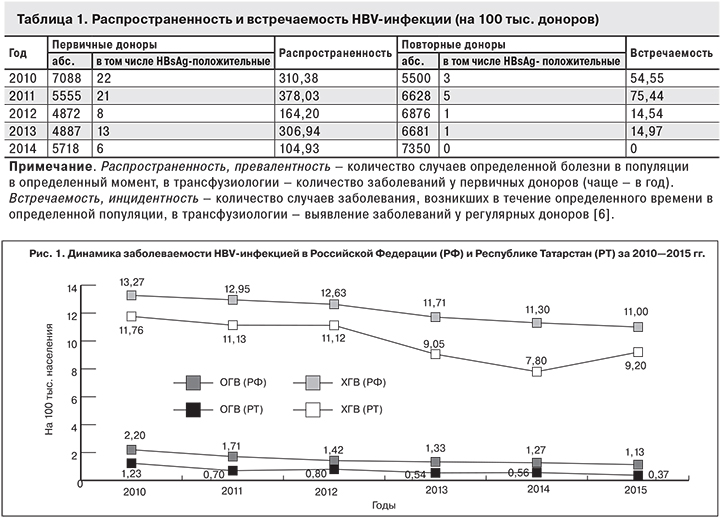
Ежегодно HBsAg-положительные лица выявляются как среди первичных, так и среди повторных доноров. За 5-летний период исследования изменения распространенности и встречаемости HBsAg носили волнообразный характер, что указывает на сохраняющийся высокий уровень хронической HBV-инфекции в популяции (табл. 1, рис. 1).
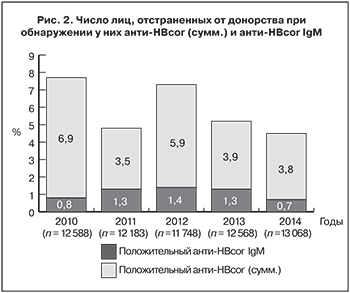 Тестирование донорской крови на анти-HBcor (сумм.) и анти-HBcor IgM для выявления скрытых форм HBV-инфекции определило долю лиц, отстраненных от донорства из-за обнаружения у них анти-HBcor (сумм.), которая колебалось от 3,5 до 6,9% (от 400 до 900 человек ежегодно) (рис. 2).
Тестирование донорской крови на анти-HBcor (сумм.) и анти-HBcor IgM для выявления скрытых форм HBV-инфекции определило долю лиц, отстраненных от донорства из-за обнаружения у них анти-HBcor (сумм.), которая колебалось от 3,5 до 6,9% (от 400 до 900 человек ежегодно) (рис. 2).
Ежегодно у 18–25 % лиц с анти-HBcor (сумм.) обнаруживают анти-HBcor IgM, у 4–6% – HBsAg; у 1% лиц с HBsAg обнаруживают анти-HBcor IgM.
Выявление HBsAg и/или анти-HBcor (сумм.), и/или анти-HBcor IgM в крови донора является показанием для запрета использования крови с последующим исключением его из базы действующих доноров. В случае сомнительного результата исследования на наличие HBsAg кровь/плазма подлежит карантинизации в течение 6 мес., то есть хранению свежезамороженной плазмы с запретом использовать ее на протяжении определенного времени. По истечении этого срока должно быть проведено повторное трехкратное обследование донора на наличие клинических и лабораторных признаков гемотрансмиссивных инфекций и получено заключение врача-инфекциониста об отсутствии HBV-инфекции в каждом конкретном случае.
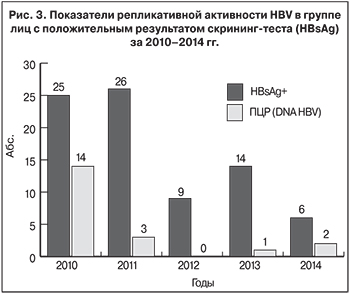
Для подтверждения активности инфекционного процесса использовали ПЦР как арбитражный тест на выявление DNA HBV (рис. 3). Результаты подтвердили выявление активных форм HBV-инфекции среди лиц со скрытой формой заболевания, которые являются источниками инфекции (за 2010–2014 гг. – до 25% случаев).
При уровне АЛТ выше 40 Ед/л кровь донора также бракуют и в дальнейшем не используют. В 2010 г. такие показатели были выявлены в 4,3% случаев, в 2011 г. – в 5,1%, в 2012 г. – в 4,1%, в 2013 г. – в 3,2%, в 2014 г. – в 4,8%. По данным литературы [5], в настоящее время верхней границей нормы АЛТ принято считать для мужчин 30 Ед/л, для женщин – 19 Ед/л. Концентрация АЛТ в сыворотке крови выше этих показателей была зарегистрирована всего у 1–2% доноров при наличии HBsAg и у 15–20% – при наличии анти-HBcor (сумм.).
 HBV-тестирование донорской крови снижает риск внутрибольничного инфицирования, однако полной гарантии отсутствия вируса в организме человека дать не может, поскольку существует серонегативное окно, а также скрытые формы HBV-инфекции, при которых HBsAg в крови не обнаруживается. Поэтому результаты исследования донорской крови на антитела к HBcor в сочетании с ее биохимическими показателями могут стать серьезным основанием для обязательного более детального обследования доноров [7].
HBV-тестирование донорской крови снижает риск внутрибольничного инфицирования, однако полной гарантии отсутствия вируса в организме человека дать не может, поскольку существует серонегативное окно, а также скрытые формы HBV-инфекции, при которых HBsAg в крови не обнаруживается. Поэтому результаты исследования донорской крови на антитела к HBcor в сочетании с ее биохимическими показателями могут стать серьезным основанием для обязательного более детального обследования доноров [7].
В России донором крови и ее компонентов может стать каждый дееспособный гражданин с 18 лет, прошедший медицинское обследование и не имеющий противопоказаний к донорству. Вирусные гепатиты входят в список противопоказаний к донорству крови и ее компонентов, который определен нормативными документами Минздрава России [8].
HBV является основной причиной посттрансфузионного ГВ, хотя введение скрининговой диагностики привело к значительному снижению заболеваемости этой инфекцией [9]. Несмотря на доступность чувствительных тест-систем для обнаружения HBsAg, случаи посттрансфузионного ГВ происходят по-прежнему [10]. M. Satake и соавт. [11] обнаружили ДНК HBV у 10 из 37 реципиентов, получавших анти-HBs- негативную кровь от донора, имевшего скрытый ГВ.
В 2015 г. российские ученые проанализировали данные обследования доноров за 8 лет – с 2007 по 2014 г. Было установлено, что удельный вес выявления в крови постоянных и первичных доноров поверхностного антигена HBV примерно одинаков и составляет 0,1–0,4%. В исследованиях 313 образцов сыворотки крови ВИЧ-инфицированных, проведенных И.В. Гордейчуком в Московской области [12], изолированные анти-HBcor были обнаружены в 8% случаев, а в 3,1% случаев была обнаружена ДНК HBV. В работах В.Х. Фазылова [5] и Д.Ш. Еналеевой и соавт. [7] описано обнаружение анти-HBcor при отсутствии HBsAg у 186 (18,2%) доноров г. Альметьевска (Республика Татарстан). Анти-HBcor-позитивные образцы необходимо считать потенциально опасными в плане наличия в них HBV [13, 14].
Таким образом, HBsAg-отрицательные лица продолжают оставаться источником инфекции для окружающих. Своевременное выявление латентных и скрытых форм ГВ приобретает все большую актуальность в связи с их эпидемиологической значимостью [12, 15].
Заболеваемость хронической (в том числе скрытой и латентной) формой HBV-инфекции способствует поддержанию циркуляции вируса среди населения и увеличивает риск инфицирования при переливании крови и ее компонентов. Среди доноров Республиканского центра крови ежегодно выявляются лица с положительными маркерами HBV-инфекции: с HBsAg – в среднем 16 человек в год, с анти-HBcor (сумм.) – 580 человек, из них 4,2% – с анти-HBcor IgM. К сожалению, на основании регламентирующих документов в эпидемиологическую службу поступают сведения об инфицированных донорах по единственному маркеру HBV-инфекции – HBsAg. Работа специалистов Республиканского центра крови направлена на полную диагностику вирусных гепатитов для исключения «пропущенных» случаев и является гарантом безопасности крови, заготавливаемой для лечебно-профилактических учреждений.


