Гепатит В (ГВ) – широко распространенное в мире заболевание. Серологические маркеры перенесенной или текущей инфекции присутствуют у 2 млрд человек, у 400 млн отмечается ее хроническое течение, 1,5–2 млн ежегодно умирают от последствий инфицирования вирусом ГВ (ВГВ), в том числе около 100 000 – от фульминантного ГВ, 500 000 – от острой формы ГВ (ОГВ), примерно 700 000 – от цирроза печени (ЦП) и 300 000 – от гепатоцеллюлярной карциномы (ГЦК) [1–3].
Известно, что ведущая роль в борьбе с ГВ принадлежит вакцинопрофилактике, поскольку с ее помощью удается предотвратить заболевание в 95–100% случаев [4].
Еще в 1992 г. вакцинация против ГВ была рекомендована ВОЗ для включения в число обязательных прививок для детей во всех странах мира [5]. К концу 2004 г. уже 142 страны включили вакцину против ГВ для вакцинации младенцев в национальные календари иммунизации, и всемирный охват тремя прививками детей к возрасту 6 мес. уже в то время составил около 40%. Целью Европейского бюро ВОЗ по борьбе с ГВ являлось достижение во всех странах к 2005 г. или раньше 90% охвата тремя прививками против ГВ в группах, подлежащих поголовной вакцинации [4].
В Российской Федерации вакцинопрофилактика также является основной мерой борьбы с ГВ. В 2006–2014 гг. благодаря проведению ежегодной плановой иммунизации населения, в том числе дополнительной иммунизации в рамках приоритетного национального проекта в сфере здравоохранения, были достигнуты высокие охваты вакцинацией разных групп населения.
В период с 2006 по 2012 г. в рамках национального календаря профилактических прививок против ГВ в стране было вакцинировано 62,6 млн детей, подростков и взрослых; показатель охвата законченной вакцинацией на начало 2013 г. среди детей до 17 лет включительно составил 99,4%, среди взрослых в возрасте 18–35 лет – 88,5%, а в возрасте 36–59 лет – 60% [6]. В 2014 г. в Российской Федерации вакцинировано против ГВ более 5 млн человек, в том числе более 1,8 млн детей.
Проведение массовой вакцинации позволило снизить заболеваемость ГВ в Российской Федерации в 33,7 раза (с 43,8 на 100 тыс. населения в 1999 г. до 1,3 – в 2014 г.) и к началу 2014 г. достичь самого низкого за все годы наблюдения уровня заболеваемости [7].
 Как известно, одним из критериев иммунологической эффективности вакцинопрофилактики ГВ является уровень гуморального ответа, характеризующийся частотой выявления специфических антител (анти-НВs) в протективных концентрациях к вакцинному антигену. Согласно данным ВОЗ [8], общепринятым критерием успешной вакцинации считается концентрация антител, превышающая 10 мМЕ/мл. Как правило, после полного курса иммунизации частота сероконверсий у лиц с защитным титром антител варьирует от 80 до 100% [9, 10]. Изучение длительности поствакцинального иммунитета является одним из наиболее важных вопросов вакцинопрофилактики. У вакцинированных против ГВ отмечается естественное ежегодное снижение уровня антител к HBsAg [11]. Длительность сохранения анти-HBs в сыворотке крови привитых зависит от величины титров антител, синтезируемых в процессе вакцинации. Данные литературных источников об уровне иммунитета в разные сроки после вакцинации отличаются.
Как известно, одним из критериев иммунологической эффективности вакцинопрофилактики ГВ является уровень гуморального ответа, характеризующийся частотой выявления специфических антител (анти-НВs) в протективных концентрациях к вакцинному антигену. Согласно данным ВОЗ [8], общепринятым критерием успешной вакцинации считается концентрация антител, превышающая 10 мМЕ/мл. Как правило, после полного курса иммунизации частота сероконверсий у лиц с защитным титром антител варьирует от 80 до 100% [9, 10]. Изучение длительности поствакцинального иммунитета является одним из наиболее важных вопросов вакцинопрофилактики. У вакцинированных против ГВ отмечается естественное ежегодное снижение уровня антител к HBsAg [11]. Длительность сохранения анти-HBs в сыворотке крови привитых зависит от величины титров антител, синтезируемых в процессе вакцинации. Данные литературных источников об уровне иммунитета в разные сроки после вакцинации отличаются.
Наиболее изученной и широко используемой в конце прошлого века была вакцина «Энджерикс В». По данным отечественных авторов [12], в результате ее трехкратного введения 92,3% привитых приобретают иммунитет к заражению ВГВ.
Целью работы была оценка иммунологической эффективности вакцинопрофилактики против ГВ населения отдельных регионов России, в том числе в рамках реализации приоритетного национального проекта «Здоровье».
Материалы и методы
Исследовано 803 сыворотки крови практически здоровых взрослых лиц, привитых против ГВ рекомбинантной дрожжевой вакциной «Энджерикс В» по стандартной схеме вакцинации (0–1–6 мес.) в 4 субъектах Российской Федерации (Московская и Свердловская области, Пермский край, Москва). Забор образцов крови проводили через 3–6 и 7–12 мес., 1–2 года, 3–5, 6–7 и 8–12 лет после окончания полного курса вакцинации. Сбор образцов крови и отделение сыворотки крови проводили в регионах, затем клинические образцы транспортировали в замороженном виде с соблюдением требований «холодовой цепи» в клинико-диагностическую лабораторию инфекционной клинической больницы № 1 Департамента здравоохранения города Москвы. Количественное определение маркеров ГВ [HВsAg, anti-HBs с определением их концентрации, anti-HBcor (суммарные и класса IgM)] у привитых проводили методом хемилюминисценции на автоматическом иммунохимическом анализаторе ARCHITECT с использованием тест-систем «Architect» («Abbott Laboratories», США). Серопротективной концентрацией специфических антител в сыворотке крови считали 10 мМЕ/мл и выше. Статистическую обработку материала проводили с использованием компьютерной программы Excel 2010.
Результаты и обсуждение
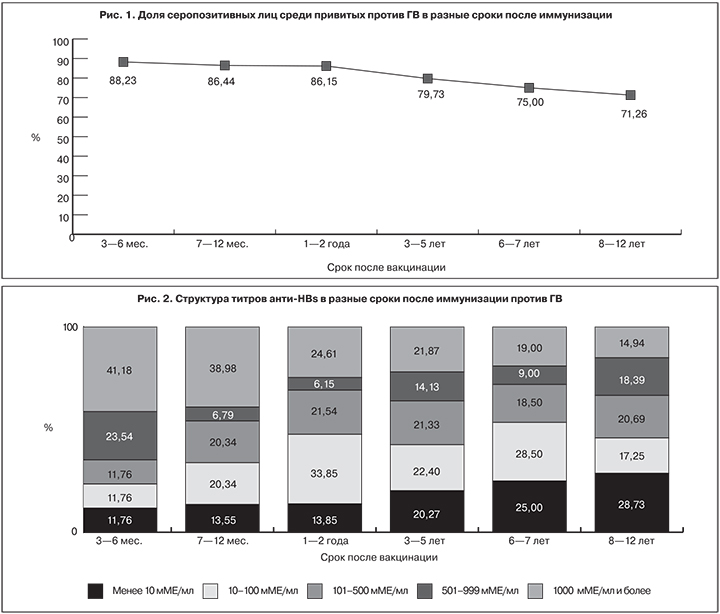
Суммарные данные серологического исследования показали, что в первые 3–6 мес. после завершения курса иммунизации специфические антитела в протективной концентрации были выявлены у 88,23 ± 8,06% привитых против ГВ, спустя 1–2 года – у 86,15 ± 4,28%, а через 8–12 лет – уже у 71,26 ± 4,56%, что может свидетельствовать о стойкости поствакцинального иммунитета (рис. 1).
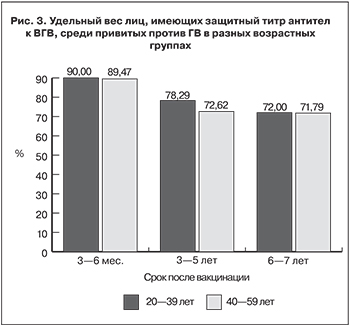
В структуре титров анти-HBs среди привитых спустя 3–6 мес. после завершения иммунизации удельный вес серонегативных лиц составлял 11,76 ± 8,05%, а через 8–12 лет – 28,73 ± 4,85% (р > 0,05; рис. 2). При этом удельный вес лиц с концентрацией анти-HBs 1000 мМЕ/мл и более через 1–2 года снизился в 1,7 раза, через 3–5 лет – в 1,9 раза, а через 8–12 лет – в 2,8 раза (р < 0,05).
Не выявлено существенных различий в иммунологической структуре привитых против ГВ в возрастных группах 20–39 и 40–59 лет (рис. 3).
Отмечено, что спустя 6–7 лет после полного курса иммунизации доля лиц, серопозитивных к ВГВ, в обеих группах снизилась (с 90,0 ± 10,0 до 72,0 ± 5,18 и с 89,47 до 71,79 ± 7,21% соответственно), но не имела статистически значимых различий.
Выводы
- После завершения курса иммунизации против ГВ специфические антитела в протективной концентрации через 3–6 мес. были выявлены в крови у 88,23 ± 8,06 % привитых и сохранялись спустя 8–12 лет у 71,26 ± 4,56%.
- Спустя 8–12 лет после вакцинации выявлено: удельный вес лиц с высокой концентрацией анти-HBs (1000 мМЕ/мл и более) уменьшился в 2,8 раза (с 41,18 ± 12,30 до 14,94 ± 3,82%; р < 0,05).
- Не выявлено существенных различий в иммунологической структуре лиц, привитых против ГВ, в возрастных группах 20–39 и 40–59 лет. Доля лиц, имеющих защитный титр антител к ВГВ, через 3–6 мес. после полного курса вакцинации составила 90,0 ± 10,0 и 89,47 ± 7,23% соответственно, спустя 6–7 лет она снизилась соответственно до 72,0 ± 5,18 и 71,79 ± 7,21%, но не имела статистически значимых различий.
- Полученные результаты с использованием серологического мониторинга подтвердили высокую иммунологическую эффективность вакцинации против ГВ населения отдельных регионов России.


