Вакцинация является на сегодняшний день одним из самых обсуждаемых вопросов медицинской практики. К сожалению, в средствах массовой информации, преимущественно в интернет-ресурсах, имеется множество сообщений, призывающих избегать прививок, приводятся научно необоснованные примеры «серьезных массовых осложнений вакцинации». Возникающие под напором «авторитетных» мнений сторонников антипрививочной пропаганды беспокойство и негативизм родителей в отношении вакцинации всерьез препятствуют выполнению главных задач метода – созданию индивидуального и коллективного иммунитета против инфекционных заболеваний [1–4].
 В этих условиях врачу особенно важно провести процесс вакцинации с максимальным эмоциональным и физическим комфортом для ребенка и его родителей. Более комфортным процесс вакцинации делает применение комбинированных вакцин, снижающих инъекционную нагрузку на ребенка и тревогу родителей по поводу одновременного введения нескольких препаратов. Кроме того, существенно улучшает психологическое состояние как маленького пациента, так и его родителей использование низкореактогенных вакцин [5, 6].
В этих условиях врачу особенно важно провести процесс вакцинации с максимальным эмоциональным и физическим комфортом для ребенка и его родителей. Более комфортным процесс вакцинации делает применение комбинированных вакцин, снижающих инъекционную нагрузку на ребенка и тревогу родителей по поводу одновременного введения нескольких препаратов. Кроме того, существенно улучшает психологическое состояние как маленького пациента, так и его родителей использование низкореактогенных вакцин [5, 6].
Известно, что вакцина АКДС, являющаяся комбинацией цельноклеточной коклюшной вакцины, дифтерийного и столбнячного анатоксинов, обладает выраженной реактогенностью. При введении АКДС у ребенка может отмечаться повышение температуры, капризность, локальные изменения: гиперемия и инфильтрат в месте введения, а также реакции со стороны нервной системы, например, пронзительный плач в течение нескольких часов (так называемая энцефалическая реакция). Все указанные явления, как правило, купируются без негативных последствий для здоровья в течение первых двух суток, однако их появление нарушает качество жизни ребенка и беспокоит родителей [7–11].
На сегодняшний день в медицинском арсенале помимо АКДС имеются бесклеточные (ацеллюлярные) вакцины АаКДС, которые также являются высокоиммуногенными, но значительно менее реактогенны. Эти вакцины были разработаны как альтернатива цельноклеточной АКДС для детей с патологией нервной системы, у которых введение цельноклеточной вакцины могло спровоцировать ухудшение течения основного заболевания. Кроме того, ацеллюлярные вакцины против коклюша могут эффективно использоваться у лиц разного возраста [12–16].
Целью нашего исследования был анализ течения поствакцинального периода при использовании комбинированных вакцин, в том числе содержащих ацеллюлярный коклюшный компонент. Кроме того, при выполнении данной научной работы мы постарались выяснить мнение родителей по поводу некоторых аспектов вакцинопрофилактики.
 Материал и методы
Материал и методы
В рамках исследования проведен анализ постпрививочных реакций у 45 детей после введения комбинированных вакцин «Пентаксим», в состав которой входят АаКДС, инактивированная полиомиелитная вакцина и вакцина против гемофильной инфекции, или «Приорикс» для иммунизации против кори, краснухи и эпидемического паротита.
Для того чтобы уточнить позицию родителей в вопросах вакцинации, было проведено анонимное анкетирование 100 родителей.
Результаты и обсуждение
В исследуемой группе под нашим наблюдением 22 пациента получили лишь однократную вакцинацию, а 23 ребенка прививались от 2 до 4 раз. Таким образом, у 45 детей проведен анализ 80 вакцинальных эпизодов. Из них в 67 случаях использована вакцина «Пентаксим», а в 13 случаях – вакцина «Приорикс». Кроме того, в 36 случаях из 80 была одновременно проведена вакцинация от гепатита В (32 вакцинальных эпизода вместе с «Пентаксим» и 4 – с «Приорикс»).
Вакцину«Пентаксим» вводили детям в возрасте от 3 мес. до 3 лет и 8 мес. В анализ исследования были включены все 3 вакцинации из первичного комплекса и первая ревакцинация АаКДС-ИПB/XИБ. Из 67 эпизодов вакцинации V1 – 22 случая, V2 – 19 случаев, V3 – 7 случаев, RV1 – 4 случая.
Большинство (85,7%) детей, привитых вакциной «Пентаксим», имели отклонения в состоянии здоровья (табл. 1).
В группу детей с синдромом соединительно-тканной дисплазии были включены пациенты с мышечной кривошеей, дисплазией тазобедренных суставов, вальгусной деформацией стоп, пупочной грыжей и грыжей пищеводного отверстия диафрагмы (ребенок оперирован). Один из двоих детей, имевших гнойно-воспалительные заболевания в анамнезе, перенес остеомиелит после вакцинации от гепатита В при рождении, у второго ребенка в анамнезе в возрасте 3 мес. был постинъекционный абсцесс, а в динамике – парапроктит.
Несмотря на комплексность проведенной вакцинации (в 32 случаях помимо вакцины «Пентаксим» также вводили вакцину от гепатита В), все наблюдаемые реакции при иммунизации вакциной «Пентаксим» мы относили на счет АаКДС-компоненте, так как для прочих препаратов, входящих в ее состав, развитие местных, а тем более общих реакций не характерно. Значимых различий в частоте и степени выраженности реакций при одновременной иммунизации с вакциной против гепатита В и без таковой не отмечено.
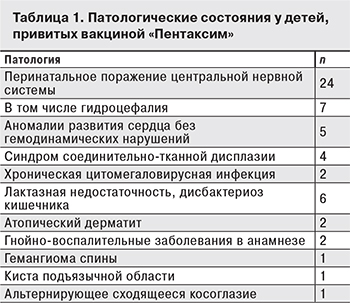
По итогам наблюдения отсутствие какой-либо общей реакции на прививку отмечено в 46 эпизодах из 67 (68,7%). В 12 (17,9%) случаях у детей имелась слабая, а в 5 (7,5%) случаях – средняя общая реакция в виде подъема температуры до субфебрильных и фебрильных значений соответственно. Ни в одном случае не было сильных общих реакций. В 3 (4,4%) эпизодах общая реакция на вакцинацию проявилась повышением капризности у ребенка. В 1 (1,5%) случае мама ребенка, страдающего гидроцефалией, отмечала у него усиленное моргание в течение дня после прививки. Этот симптом самостоятельно купировался на следующий день.
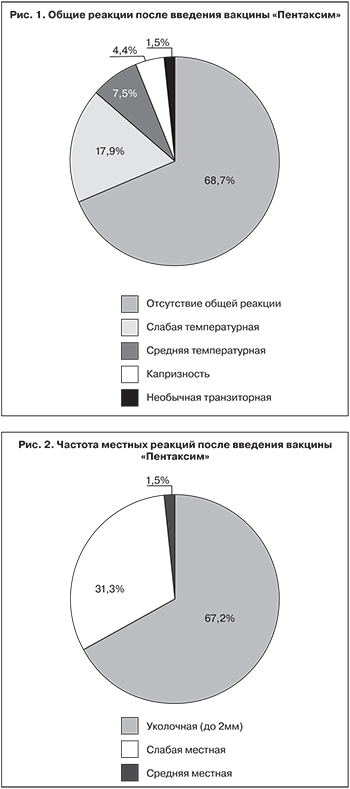
После введения вакцины «Пентаксим» в 45 (67,2%) эпизодах у детей отмечалась местная (уколочная) реакция (до 2 мм). В 21 (31,3%) случае имели место слабые местные реакции (гиперемия или отек размером от 0,2 до 2 см) и только в 1 (1,5%) случае – средняя (от 2 до 5 см). Отдаленных реакций или осложнений вакцинации у наблюдаемых детей не отмечалось.
Вакцинация от кори, паротита и краснухи вакциной «Приорикс» проведена 13 детям в возрасте от 1 года до 8 лет. В 11 случаях это была первичная вакцинация, а у 2 детей – повторная (первичная вакцинация в возрасте 1 года).
 В этой группе лишь трое детей не имели хронических заболеваний. У остальных были отклонения в состоянии здоровья (табл. 2).
В этой группе лишь трое детей не имели хронических заболеваний. У остальных были отклонения в состоянии здоровья (табл. 2).
В группе детей с почечной патологией фигурировали такие диагнозы, как нейрогенная дисфункция мочевого пузыря; хронический гломерулонефрит, ремиссия; дисметаболическая нефропатия, оксалатурия.
Поствакцинальный период характеризовался отсутствием общей реакции у всех детей. У 4 (30,8%) детей имелись слабые местные реакции, у 9 (69,2%) – уколочные реакции в месте введения вакцины.
Таким образом, при использовании комбинированных вакцин лишь в редких случаях отмечены средние общие реакции на прививку. Снижение частоты общих проявлений вакцинального процесса является важным фактором, так как значительно снижает уровень тревоги родителей, что и продемонстрировала следующая часть нашего исследования.
Родителям детей в возрасте от 1 мес. до 5 лет, посетившим педиатра, была предложена письменная анкета из 7 вопросов, представленная в табл. 3.
Вариантами ответа были: «да», «нет» и «затрудняюсь ответить». Родители-участники анкетирования были выбраны случайным методом. Из них у 30 человек дети получили вакцинацию только в родильном доме, остальным детям прививки проведены и в родильном доме, и в условиях поликлиники.
При анкетировании получены следующие результаты.
Подтвердили наличие чувства тревоги и опасения при проведении прививок ребенку 58 (58%) опрошенных. Из них 17 (17%) человек указали, что боятся «прививок вообще и всего, что с ними связано», а 18 (18%) – что боятся вполне определенных осложнений, однако на просьбу конкретизировать, каких именно, только двое опрошенных ответили, что боятся судорог у ребенка и четверо – что опасаются аллергических реакций. 23 (23%) человека сообщили о вполне устранимой причине тревоги по поводу вакцинации – недостаточной осведомленности о прививках. Не испытывали беспокойства в связи с вакцинацией своего ребенка 30 (30%) человек, а 12 (12%) затруднились ответить, то есть, вероятно, также не были полностью уверены в безопасности применения прививок.
 На вопрос «Считаете ли Вы, что вакцинация способна нанести серьезный вред здоровью Вашего ребенка?» 32 (32%) человека ответили отрицательно. Мнение о возможном серьезном вреде прививок для здоровья малышей выразили 6 (6%) опрошенных, а остальные 62 (62%) вновь затруднились ответить, что также может быть истолковано как неполная уверенность в безопасности вакцинации.
На вопрос «Считаете ли Вы, что вакцинация способна нанести серьезный вред здоровью Вашего ребенка?» 32 (32%) человека ответили отрицательно. Мнение о возможном серьезном вреде прививок для здоровья малышей выразили 6 (6%) опрошенных, а остальные 62 (62%) вновь затруднились ответить, что также может быть истолковано как неполная уверенность в безопасности вакцинации.
К обязательным для ребенка процедурам вакцинацию отнесли только четверть опрошенных – 25 (25%) человек, ответивших «однозначно, да», а почти такое же число родителей – 24 (24%) человека – выбрали ответ «скорее нет, чем да». Более половины опрошенных – 51 (51%) человек – в этом вопросе полагаются на мнение врачей и действуют по принципу «если врач сказал, что нужно делать, значит нужно».
Вакцинацию как фактор надежной защиты от опасных инфекционных болезней рассматривают 26 (26%) родителей, 14 (14%) человек не считают, что вакцинация защитит ребенка от заболевания, а 60 (60%) человек вновь затруднились ответить. Следует полагать, данный результат является следствием недостаточной информированности родителей об этиологии инфекционных болезней и роли прививок в их профилактике.
Дети 30 родителей из 100 опрошенных ранее прививок амбулаторно не получали (привиты только в родильном доме). Остальным родителям было предложено указать, отмечались ли при предыдущих процедурах вакцинации какие-либо проблемы в состоянии ребенка. Из 70 человек 57 (87,4%) сообщили, что вакцинацию ребенок перенес удовлетворительно, а родители 13 (18,6%) детей свидетельствовали об «осложнениях» после вакцинации. При детальном уточнении выяснилось, что речь на самом деле шла о стандартных местных и общих прививочных реакциях (покраснение в месте укола, повышение температуры).
Целью последнего вопроса было уточнить преимущественный источник информации о прививках для родителей. Опрос показал, что участковый врач и медсестра являются авторитетами в данной области для 60 (60%) опрошенных, 18 (18%) человек получают сведения от других врачей, 13 (13%) опираются на мнение знакомых, родственников, соседей. Для 9 (9%) родителей основным источником информации служит Интернет. Интересно, что ни один из родителей при ответе на этот вопрос не выбрал вариант «телевидение, газеты», что, вероятно, указывает на отсутствие необходимой разъяснительной работы в официальных СМИ.
Результаты проведенного анкетирования показывают, что большинство родителей действительно испытывают беспокойство при проведении иммунопрофилактических мероприятий, однако их страх чаще всего вызван не определенными убеждениями, а отсутствием необходимой достоверной информации о том, что такое прививки, для чего они выполняются, в чем отличия реакций организма на иммунизацию от осложнений вакцинации. Именно грамотная разъяснительная работа способна помочь родителям занять позицию твердой убежденности в пользе и необходимости вакцинопрофилактики и сделать их союзниками, а не оппонентами врача.
Выводы
- Частота значимых (средних) реакций при введении вакцины «Пентаксим» составила 7,5% для общих реакций и 1,5% – для местных. В 1,5% (1 случай) отмечена необычная транзиторная реакция на введение вакцины. Применение вакцины «Пентаксим» ни в одном случае не осложнилось сильной реакцией на прививку, что позволило беспрепятственно завершить полный курс вакцинации ребенка против коклюша, дифтерии и столбняка.
- После введении вакцины «Приорикс» поствакцинальный период характеризовался отсутствием значимых общих и местных реакций. В целом при использовании комбинированных вакцин у детей отмечалось благоприятное течение поствакцинального периода.
- Значительная часть родителей (58%) испытывают беспокойство и тревогу в связи с вакцинацией их детей. При этом лишь 25–26% родителей четко осведомлены о пользе прививок и выполняют процедуру, сознательно стремясь защитить своего ребенка от опасных заболеваний.
- Довольно часто родители неверно истолковывают появление стандартных реакций на прививку как осложнения, что в дальнейшем может повлиять на их приверженность вакцинации. Следует отнести этот факт к недоработкам медицинского персонала, так как опрос показал, что для 78% родителей, несмотря на активность антипрививочной пропаганды, главным авторитетом и источником информации являются врач и медсестра, ответственные за здоровье их ребенка.
- Использование комбинированных низкореактогенных вакцин в сочетании с активной просветительской деятельностью медицинских работников в отношении пользы и особенностей течения вакцинального процесса можно назвать двумя основными составляющими успеха важной задачи здравоохранения – формирования коллективного иммунитета против инфекционных болезней.


