Менингококковая инфекция (МИ) в настоящее время остается одной из актуальных проблем здравоохранения вследствие ее высокой медико-социальной значимости, что обусловлено вовлечением в эпидемический процесс преимущественно детского населения, особой тяжестью ее генерализованных форм (ГФМИ), высокой летальностью, связанной со значительной частотой развития гипертоксических форм, септического шока (СШ) и других осложнений, несовместимых с жизнью [1, 2].
За последнее десятилетие регистрируемая заболеваемость ГФМИ в Российской Федерации прогрессивно снижается и не превышает 1 на 100 тыс. населения (в 2013 г. – 0,79 на 100 тыс. населения). В то же время дети болеют ГФМИ в 11,5 раз чаще, чем взрослые: в 2012 г. заболеваемость среди детей составила 4,6 на 100 тыс. детей до 14 лет, среди взрослых – 0,4 на 100 тыс. населения, в 2013 г. показатель заболеваемости среди детей до 17 лет – 2,99 на 100 тыс. детей соответствущего возраста. Среди заболевших ГФМИ более 83% составляют дети до 5 лет (показатель заболеваемости в группе детей в возрасте до 4 лет составляет 9,9 на 100 тыс., детей первого года жизни – 13,9 на 100 тыс.) [3].
Несмотря на снижение в последнее десятилетие в Российской Федерации заболеваемости ГФМИ в 2,7 раза, среди умерших около 76% случаев приходится на долю детей до 17 лет. Уровень летальности среди них в 2013 г. составил в среднем 16,4%, а совокупного населения – 15,3%.
Согласно официальным данным [4], средний показатель заболеваемости МИ в Красноярском крае, включая взрослое население, относительно стабилен и в среднем составляет 2,3 на 100 тыс. населения. В то же время среди детей до 14 лет этот показатель в 4,4 раза выше и составляет в последние годы 10,08 на 100 тыс. населения (рис. 1).
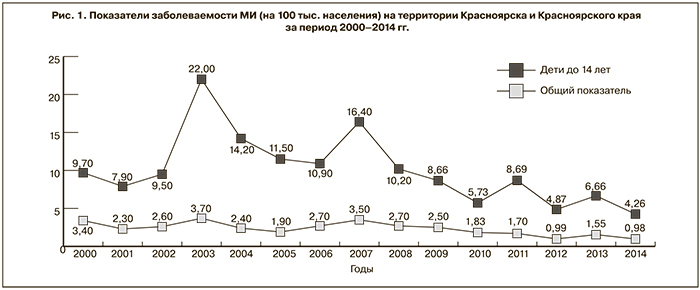
Обращает на себя внимание нестабильность снижения заболеваемости МИ, что еще раз подчеркивает актуальность проблемы в современных условиях. Так, к 2000 г. показатель заболеваемости МИ среди детей до 14 лет уменьшился с 16,8 (1989) до 9,7 на 100 тыс. населения. Однако в 2003–2005 гг. вновь отмечено некоторое оживление инфекции, и показатель заболеваемости составил соответственно 22, 14,2 и 11,5 на 100 тыс. населения, и только к 2006 г. он снизился до 10,9 на 100 тыс. населения [1, 5]. В 2007 г. показатель заболеваемости среди детей в крае вновь вырос до 16,4, а в 2008 г. составил 10,2 на 100 тыс. детского населения, что в 2 и 1,5 раза выше, чем в среднем по России. В 2010 и 2012 гг. показатель заболеваемости в крае снизился до уровня, среднего по стране [5].
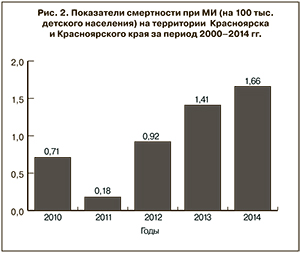
Многолетний средний показатель летальности от ГФМИ в последнем десятилетии прошлого столетия в регионе снизился в 3,4 раза и составил 9%. Однако в новом тысячелетии вновь отмечен рост летальных исходов до 13,6% [4]. Показатель смертности в последние годы достаточно нестабилен: если в 2011 г. он составлял 0,18 на 100 тыс. детского населения, то в 2013 г. увеличился более чем в 7 раз и составил 1,41 на 100 тыс. детского населения (рис. 2).
 На сегодняшний день известно 13 серогрупп менингококков, среди которых 6 наиболее часто вызывают инвазивные заболевания у человека (A, B, C, W135, X, Y). Распределение серогрупп различается в зависимости от региона. Так, в Экваториальной Африке высокую заболеваемость обусловливают менингококки группы А, в странах Европы выделяют преимущественно менингококки групп В и С.
На сегодняшний день известно 13 серогрупп менингококков, среди которых 6 наиболее часто вызывают инвазивные заболевания у человека (A, B, C, W135, X, Y). Распределение серогрупп различается в зависимости от региона. Так, в Экваториальной Африке высокую заболеваемость обусловливают менингококки группы А, в странах Европы выделяют преимущественно менингококки групп В и С.
По результатам изучения Российским референс-центром по мониторингу за бактериальными менингитами серогрупповой характеристики штаммов менингококка, выделенных в РФ за период 2010–2013 гг. от 2746 лиц с диагнозом ГФМИ, доминирующая серогруппа не определялась: в 18–27% случаев заболевание было вызвано менингококками группы А, в 25–32% – группы В, в 19–20% – группы С и в 1,2–2,4% – менингококками других серогрупп [3]. В Красноярском крае начиная с периода спорадической заболеваемости и до настоящего времени лидирующим серотипом среди лабораторно подтвержденных случаев МИ по-прежнему является менингококк группы В (64,7%), несколько реже выделяется серотип С (32,3%), в 2,9% случаев – серотип А. Причем серотип А достоверно чаще выделяется у детей раннего возраста, в то время как менингококки группы С наиболее часто вызывают заболевание у детей старше 3 лет.
Нами проведен анализ показателей заболеваемости МИ, включая случаи с летальным исходом, у детей до 14 лет, согласно официальным данным Управления Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по Красноярскому краю за период 2000–2014 гг. Изучены клинико-эпидемиологические особенности заболевания у 53 больных ГФМИ, находившихся на лечении в боксированном инфекционном и реанимационном отделениях Краевой межрайонной детской клинической больницы Красноярска в 2010–2014 гг. Динамическое наблюдение за больными проводили на протяжении всего периода пребывания в стационаре. Диагноз МИ устанавливали на основании совокупности клинических, эпидемиологических и лабораторных данных. Этиологию ГФМИ определяли методами бактериологической, латекс- и ПЦР-диагностики. Клиническое наблюдение дополняли общепринятыми лабораторными методами обследования.
Также проведена экспертная оценка 22 историй болезни детей, умерших в 2005–2014 гг. в отделении реанимации и интенсивной терапии.
Говоря о возрастной структуре заболевших в Красноярске, необходимо отметить некоторое «повзросление» МИ. По-прежнему среди больных преобладают дети в возрасте от 1 года до 3 лет, но их удельный вес снизился по сравнению с предыдущим десятилетием с 80 до 54,7%. С 40 до 20,8% уменьшилось количество детей первого года жизни, в то же время увеличилась доля детей 4–7 (с 7,5 до 13,2%) и 7–14 лет (с 7,9 до 11,3%) (рис. 3).
Прослеживается зимне-весенняя сезонность заболевания: 67,9% случаев МИ регистрировались именно в этот период.
 Лидирующей клинической формой ГФМИ остается комбинированный вариант – сочетание менингококцемии с гнойным менингитом/менингоэнцефалитом (68%), регистрируемый во всех возрастных группах. Реже встречатся «чистая» менингококцемия (17%) и гнойный менингит (15%) (рис. 4).
Лидирующей клинической формой ГФМИ остается комбинированный вариант – сочетание менингококцемии с гнойным менингитом/менингоэнцефалитом (68%), регистрируемый во всех возрастных группах. Реже встречатся «чистая» менингококцемия (17%) и гнойный менингит (15%) (рис. 4).
Основная симптоматика ГФМИ не претерпела существенных изменений. При анализе клинических особенностей ГФМИ установлено, что острый «классический» вариант развития болезни имел место у 90,6% больных. Лишь у 9,4% детей раннего возраста в начале заболевания проявлялись клинические признаки ОРВИ (насморк, сухой кашель, боль в горле, умеренные симптомы интоксикации) с присоединением на 2–3-и сутки общемозговой и менингеальной симптоматики, то есть можно полагать, что заболевание начиналось с назофарингита с последующей генерализацией инфекции.
По-прежнему характерным является острейшее начало заболевания. Как правило, с первых часов болезни температура тела повышается до 39,5–40 С (96,2%), которая плохо поддается снижению жаропонижающими средствами и через некоторое время вновь достигает высоких цифр. Гипертермия всегда сопровождается изменением поведения ребенка: нарушением сна, выраженным психомоторным возбуждением, которое отмечено в 69,8% случаев, причем наиболее часто оно имело место у детей первого года жизни (81,8%) и у больных в возрасте 1–3 года (48,3%), в то время как у детей старше 3 лет этот симптом регистрировался лишь в 7,6% случаев.
У 45% пациентов в начале заболевания появлялась рвота, которая в ряде случаев могла быть многократной. С первых часов болезни у половины (50,9%) детей развивалась резкая гиперестезия ко всем видам раздражителей: они становились чувствительными к громким звукам, свету, любым прикосновениям (попытка взять на руки, пеленание). У больных в возрасте до 1 года и от 1 года до 3 лет отмечался пронзительный «мозговой» крик в 58,6 и 38,4% случаев соответственно. Интенсивная головная боль диффузного распирающего характера, усиливающаяся при изменении положения тела, регистрировалась в 11,3% случаев, достоверно чаще (83,3%) у детей старше 3 лет. На фоне дегидратирующей терапии через 2–3 дня головная боль уменьшалась и к 4–5-му дню болезни исчезала.
Патогномоничным симптомом менингококцемии и сочетанных вариантов ГФМИ является геморрагически-некротическая сыпь. У наблюдаемых больных сыпь, как правило, появлялась в первые сутки заболевания (93,3%), чаще – в промежутке между 12 и 24 ч от начала болезни (75,5%), реже – до 12 ч (11,1%); в 8,8% случаев высыпания появлялись в первые 5 ч заболевания. Раннее появление сыпи (в первые 5–8 ч), характерное для тяжелых гипертоксических форм МИ, отмечено у 20% детей первых 3 лет жизни и лишь у 1,6% детей в возрасте 4–7 лет. Сыпь располагалась на всех участках тела, но чаще – на ногах и нижней части туловища (88,8%). При ГФМИ, сопровождающейся развитием СШ II–III степени, высыпания начинались с лица и верхней части туловища, затем распространялись на конечности. Как и в прежние годы, у большинства (71,1%) больных типичной для МИ является геморрагическая звездчатая сыпь с поверхностными или глубокими некрозами. В 47,5% случаев геморрагическая сыпь сочеталась с пятнистыми или пятнисто-папулезными элементами, а у 13,3% больных геморрагий вообще не было, а имелись лишь пятнисто-папулезные высыпания. Следует отметить, что именно эти случаи представляли для врачей скорой помощи и участковых педиатров наибольшую трудность в распознавании МИ на догоспитальном этапе, и больных направляли в стационар с диагнозом «ОРВИ».
Практически у каждого второго больного ГФМИ (у 49%) развивался СШ. При этом необходимо отметить, что в настоящее время уменьшилась и частота развития шока, и его тяжесть: у 57,7% наблюдаемых детей развивался СШ I степени, у 34,6% – II степени и только у 7,7% – III степени, тогда как в 90-е годы в Красноярском крае шок III степени имел место у 33% больных, то есть развивался практически у каждого третьего ребенка с ГФМИ.
Экспертиза историй болезни детей, умерших от ГФМИ, показала, что в подавляющем большинстве случаев причиной летальных исходов является развитие гипертоксических форм болезни, протекающих с СШ III степени, явлениями острой надпочечниковой недостаточности, отеком и набуханием мозга.

В последние годы значительно оптимизирована патогенетическая и этиотропная терапия больных с МИ. Однако в связи с присущим этой патологии молниеносным течением лечение может быть успешным только в тех случаях, когда его начинают с самых первых часов заболевания и проводят адекватно, грамотно, как на догоспитальном этапе, так и в условиях стационара. Только своевременно начатая целенаправленная терапия является залогом благоприятного течения заболевания.
Наибольшее число неблагоприятных исходов (68,2%) приходилось на зимне-весенний период, что, вероятно, обусловлено сезонным подъемом заболеваемости гриппом и другими ОРВИ и частым сочетанием этих заболеваний. Риск неблагоприятных исходов весной в какой-то мере можно объяснить снижением неспецифической резистентности организма и гиповитаминозом, развивающимися у детей после холодного периода года.
Экспертиза летальных исходов от МИ позволила выявить ряд неблагоприятных факторов, которые должны заставить врача обратить особое внимание на данную категорию больных. Важнейшим фактором риска неблагоприятного исхода заболевания является возраст ребенка. В наших наблюдениях 50% от числа летальных исходов (11 человек) составили дети первого года жизни и 36,3% (8 человек) – дети в возрасте 1–3 лет. Следовательно, неблагоприятные исходы при ГФМИ по-прежнему чаще наблюдаются у детей раннего возраста.
Большое влияние на исход ГФМИ оказывают врачебные ошибки в диагностике и лечении. Острейшее начало заболевания с развития гипертермического синдрома, сопровождающегося изменением поведения ребенка чаще в виде беспокойства, появление рвоты, как правило, являлось поводом для своевременного раннего обращения родителей за медицинской помощью. Анализ показал, что родители 15 (68%) детей обратились за медицинской помощью в первые 3–5 ч от начала болезни, а родители остальных 7 (32%) детей – не позднее 12 ч с момента появления первых симптомов заболевания. Однако, несмотря на это, только 8 (36,4%) больных были госпитализированы после первого обращения родителей за медицинской помощью, 11 (50%) больных госпитализированы при повторном вызове скорой медицинской помощи, а трое (13,6%) детей поступали на стационарное лечение после повторных вызовов и осмотров врачами скорой медицинской помощи или участковыми педиатрами более чем через 12 и даже через 24–48 ч после появления первых симптомов. Диагноз МИ на догоспитальном этапе в общей сложности был выставлен в 63,6% анализируемых случаев (14 человек), всем остальным больным выставляли ошибочные диагнозы (чаще всего «ОРВИ» и «кишечная инфекция»).
Необходимо помнить, что чаще всего одновременно с симптомами менингококцемии (реже – вслед за ее появлением) появляются признаки СШ, в ряде случаев шок может предшествовать высыпанию. О развитии СШ свидетельствует острейшее начало болезни, бурное нарастание всех симптомов (температура тела до 40 °С, беспокойство, озноб, тремор), раннее появление геморрагически-некротический сыпи, которая подсыпает «на глазах», при этом начинаются высыпания с верхней части тела (лицо, шея), или быстро поднимаются с нижней части туловища на лицо и слизистые оболочки. На коже появляются признаки нарушения гемодинамики: вначале отмечается бледность, затем – цианоз кончиков пальцев, ушных раковин, губ; следом развиваются цианоз и похолодание стоп, кистей (акроцианоз), в дальнейшем – тотальный цианоз и прижизненные трупные пятна; падает артериальное давление: вначале снижается минимальное давление за счет снижения сосудистого тонуса, а затем присоединяется снижение максимального давления из-за нарушения сократительной способности миокарда. Пульс на периферических артериях вначале становится слабым, а затем перестает определяться; отмечается резкая тахикардия, олигурия, а затем анурия.
Анализ 22 случаев летальных исходов у больных ГФМИ показал, что у 81,8% пациентов на догоспитальном этапе не только был установлен ошибочный диагноз (чаще всего «ОРВИ, гипертермический синдром»), но имела место явная недооценка тяжести состояния и степени шока. После введения жаропонижающих средств дети, как правило, оставались дома, повторно родители вызывали врача спустя 8–12 ч с момента начала заболевания, когда проявлялись все признаки СШ II–III cтепени. Смерть у таких детей наступала в отделении уже через 45–60 мин (3 случая) либо через 3, 5 и 8 ч (5 случаев) с момента госпитализации.
Во всех 4 случаях, когда был выставлен диагноз «кишечная инфекция», обращало на себя внимание несоответствие тяжести общего состояния и слабой выраженности кишечного синдрома.
Таким образом, основными ошибками догоспитального этапа являлись:
- Гиподиагностика МИ.
- Недооценка тяжести состояния при постановке больным других диагнозов («кишечная инфекция», «ОРВИ», «энтеровирусная инфекция» и др.).
- Поздняя госпитализация больных в большинстве случаев сопровождалась назначением неадекватной неотложной помощи, ограничивающейся, как правило, введением жаропонижающих средств.
У всех умерших больных МИ сопровождалось развитием СШ III степени, в 72% случаев – отеком головного мозга со смещением мозговых структур и вклинением ствола мозга в большое затылочное отверстие. В 20 (90,9%) случаях смерть детей наступила в первые сутки заболевания, следовательно, у них имело место молниеносное течение МИ, летальность при котором даже при своевременной диагностике и назначении медикаментозной терапии, адекватной тяжести состояния, остается очень высокой [2].
Наиболее эффективным методом предупреждения ГФМИ является вакцинация. Согласно позиции ВОЗ, массовая вакцинация против МИ рекомендована в высоко эндемичных (заболеваемость ГФМИ выше 10 на 100 тыс. населения) и эндемичных (2–10 на 100 тыс. населения) регионах, а также лицам, выезжающим в такие регионы из стран с низкой заболеваемостью МИ.
В странах с низкой заболеваемостью ГФМИ вакцинация рекомендована лицам из групп риска: детям и подросткам, проживающим в условиях скученности; сотрудникам лабораторий, работающим с возбудителями МИ; лицам с иммунодефицитами; ВИЧ-инфицированным лицам с клиническими проявлениями иммунодефицита. В Российской Федерации, в отличие от многих стран Европы и США, прививки против МИ не проводятся в плановом порядке, а включены в календарь профилактических прививок по эпидемическим показаниям, согласно которому вакцинации подлежат дети и взрослые в очагах МИ, вызванной менингококками серогрупп А или С, и лица, подлежащие призыву на военную службу [6].
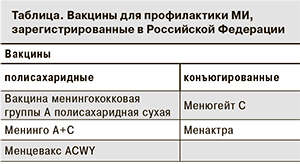
Действующие нормативные документы в первую очередь были ориентированы на использование полисахаридных вакцин. Вакцины данного класса могут успешно применяться для контроля вспышек МИ соответствующих серогрупп, но не для плановой иммунизации. Это связано с Т-независимым типом иммунного ответа на полисахаридные вакцины, при котором выработанная защита недолговременна и не способствует развитию иммунологической памяти, полисахаридные вакцины не влияют на уровень носительства и не обладают популяционным эффектом. Существенным недостатком полисахаридных вакцин является низкая эффективность иммунного ответа у детей в возрасте до 2 лет, для которых МИ представляет серьезную угрозу [7, 8].
С наибольшим успехом для профилактики МИ могут использоваться конъюгированные менингококковые вакцины, обеспечивающие выработку иммунитета у детей первых лет жизни, одновременно позволяющие достичь и непрямого (популяционного) эффекта вакцинации. К иммунологическим преимуществам применения менингококковых конъюгированных вакцин можно также отнести снижение носительства, иммунологическую память, длительное сохранение защитного эффекта, возможность эффективной ревакцинации, отсутствие гипореспонсивности при повторных вакцинациях. С появлением менингококковых конъюгированных вакцин (против серогруппы С, серогруппы А, комбинированной вакцины против серогрупп А, C, W135, Y) во многих странах менингококковая вакцинация вошла в календари профилактических прививок (см. таблицу).
Эксперты признают, что частота менингококковых менингитов в развитых странах не превышает 1 на 100 тыс. населения, однако тяжесть заболеваний и высокий уровень летальности, особенно у маленьких детей, обусловили введение менингококковой вакцинации в национальные календари прививок стран Европы и Северной Америки. Первой страной, показавшей высокую эффективность массовой вакцинации против менингококка, была Великобритания. В 1999–2000 гг. в этой стране провели вакцинопрофилактику всем детям в возрасте от 1 года до 17 лет менингококковой конъюгированной вакциной С, эффективность программы составила 90%. С 2000 г. вакцинация против менингококка серогруппы С проводится в Великобритании для рутинной иммунизации детей первого года жизни. В настоящее время менингиты, вызванные менингококком серогруппы С, в стране не регистрируются.
Первая в мире четырехвалентная менингококковая конъюгированная вакцина, была разработана и лицензирована в США в 2005 г. Вакцина представляет собой раствор очищенных капсульных полисахаридов Neisseria meningitidis групп A, C, W135 и Y, индивидуально конъюгированных с белком-носителем (очищенным анатоксином Corynebacterium diphtheriae), применение которой позволяет иммунизировать детей с целью формирования длительного иммунитета против 4 наиболее распространенных серотипов (А, С, W135 и Y), вызывающих тяжелые формы МИ. Программа клинических исследований включает более 10 000 пациентов разного возраста. Способность четырехвалентной менингококковой конъюгированной вакцины вызывать развитие иммунологической памяти после первичной вакцинации подтверждена результатами клинических исследований как у детей, так и у взрослых.
С 2005 по 2014 г. было произведено более 71 млн доз этой вакцины. Накоплен девятилетний опыт реального применения, который доказал эпидемиологическую эффективность вакцинации и продемонстрировал благоприятный профиль безопасности в разных возрастных группах.
В России четырехвалентная менингококковая конъюгированная вакцина зарегистрирована 22.09.2014. У детей в возрасте от 9 до 23 мес, курс вакцинации состоит из 2 инъекций по одной дозе вакцины (0,5 мл) с интервалом не менее 3 мес.
У лиц в возрасте от 2 до 55 лет вакцинация проводится однократно в дозе 0,5 мл. На сегодняшний день она разрешена к применению у детей с 9 мес. и у взрослых до 55 лет. Экономическая оценка эффективности плановой вакцинации против МИ проводилась в Канаде, исследователи сделали вывод об экономической целесообразности такой программы с точки зрения общества. При использовании конъюгированных вакцин один из рекомендуемых подходов заключается в первичной массовой вакцинации всех детей и подростков в возрасте от 9 месяцев до 18 лет с последующим включением вакцины в программу рутинной иммунизации детей. Модернизацию национального календаря прививок Российской Федерации с расширением перечня заболеваний, представляющих особую угрозу для жизни маленьких пациентов, в частности МИ, можно рассматривать как инструмент финансовой и демографической политики государства.


