Эффективность существующих систем эпидемиологического надзора за любой патологией, в том числе за бактериальными острыми кишечными инфекциями (БОКИ), в значительной степени зависит от валидности используемых методов лабораторной диагностики. Среди них основным в случаях БОКИ является микробиологический метод, который при удовлетворительной специфичности изначально характеризуется низкой чувствительностью и диагностической эффективностью, а также длительностью проведения при значительной ресурсоемкости [1, 2]. Более того, ситуация усугубляется на фоне интенсивного распространения возбудителей БОКИ, устойчивых к применяемым антибактериальным препаратам, изменения этиологической роли отдельных их представителей, появления новых, трудно диагностируемых рутинными методами этиологических агентов в условиях истинного и диагностического увеличения частоты микст-инфекций, нередко обусловленных ассоциациями не только патогенных агентов (бактериально-бактериальных, бактериально-вирусных и т. д.), но и сочетаниями условно-патогенных бактерий как между собой, так и с патогенами бактериальной и вирусной природы [3–8]. Указанное сопровождается сохранением высокой доли невыясненных случаев диарей не только бактериальной, но и вирусной природы, суммарная частота которых в России колеблется от 50 до 80% [9–11]. Это во многом препятствует своевременному проведению адекватных противоэпидемических мероприятий в отношении условий и факторов, способствующих распространению всей группы острых кишечных инфекций (ОКИ), результативность которых определяется быстротой и качеством используемых лабораторных методов [12]. Из их числа наиболее перспективным способом диагностики диарей является применение ПЦР, обладающей существенно более высокой, чем микробиологический метод, чувствительностью, специфичностью и диагностической эффективностью, позволяющей осуществлять детекцию множества патогенов в одной пробе клинического материала в течение короткого времени [13–15]. На сегодня наиболее интенсивно метод ПЦР используется при диагностике вирусных диарей, что привело к существенному увеличению их доли в структуре ОКИ [16]. При ОКИ, вызванных патогенными бактериями, использование молекулярно-генетического и микробиологического методов суммарно выявляет наличие патогенного бактериального возбудителя в монокультуре и микст-инфекции с другими бактериальными или вирусными агентами почти у половины заболевших (49,4%), причем с применением только метода ПЦР – в 29,8% случаев и бактериологического метода – в 20,8% [17]. В меньшей степени ПЦР используется при диагностике БОКИ, обусловленных условно-патогенными бактериями, при этом их доля может выявляться более чем в половине всех случаев ОКИ и в большинстве своем – при различных их сочетаниях [18–20].
В связи с изложенным целью исследования явилось выявление особенностей эпидемиологических проявлений БОКИ с обоснованием групп обследуемых больных для оценки эффективности микробиологического и молекулярно-генетического методов их лабораторной диагностики.
 Материалы и методы
Материалы и методы
Изучение эпидемиологических проявлений заболеваемости БОКИ в Уфе и Республике Башкортостан (РБ) в целом проведено на основе анализа данных отчетной формы № 2 «Сведения об инфекционных и паразитарных заболеваниях» за 1997–2013 гг. Информация о численности населения исследуемых территорий за анализируемый период получена в Территориальном органе Федеральной службы государственной статистики по РБ. Полученные результаты были обработаны приемами и способами эпидемиологической диагностики [21]. Для сравнительной характеристики молекулярно-генетического и микробиологического методов лабораторной диагностики БОКИ, согласно эпидемиологическим исследованиям, из популяции больных ОКИ, госпитализированных в ГБУЗ РБ «Инфекционная клиническая больница № 4» Уфы, в соответствии с критериями исключения (вирусологическое подтверждение диагноза ОКИ на рота-, норво- и астровирусы) и включения (случаи наибольшего риска заболеваемости ОКИ, подтвержденные и неподтвержденные микробиологическим методом) была отобрана когорта пациентов из 145 детей в возрасте 0–6 лет (основная группа). Из их числа первая подгруппа, включавшая 101 больного ОКИ, была представлена детьми с идентифицированными у них бактериальными возбудителями ОКИ; она маркировалась в дальнейшем как подгруппа больных БОКИ. Другая, представленная 44 детьми и не имевшая на момент начала обследования вирусологического и бактериологического подтверждения диагноза, именовалась подгруппой больных ОКИ невыясненной этиологии (ОКИНЭ). В контрольную группу вошли 23 ребенка, сопоставимые по возрасту с детьми основной группы, у которых первоначальные диагнозы ОКИ в последующем клиницистами были представлены как «лакунарная ангина», «ОРЗ» и «ОРВИ».
Методом ПЦР идентификацию бактериальных патогенов ОКИ осуществляли в тех же образцах клинического материала (фекалии) больных основной (подгруппы БОКИ и ОКИНЭ) и контрольной групп, с которыми проводились микробиологические исследования. Из указанных образцов клинического материала в условиях лаборатории молекулярной биологии и нанобиотехнологии Института биохимии и генетики Уфимского научного центра РАН проводили выделение тотальной ДНК, используя стандартные наборы («ДНК-сорб-АМ», Россия). Подбор праймеров, пригодных для ПЦР- идентификации условно-патогенных бактерий семейства Enterobacteriaceae осуществляли, используя опубликованные в GenBank последовательности нуклеотидов генов 16S рРНК: Citrobacter spp. – GU458292.1, Hafnia spp. – EU196322.1, Klebsiella spp. – GU458293.1, Proteus spp. – FJ711760.1 и Escherichia coli – AB548582.1. Для ПЦР-идентификации бактерий Salmonella Enterica, Shigella flexneri, Yersinia enterocolitica праймеры подбирались после компьютерного выравнивания геномов этих микроорганизмов с геномами других Enterobacteriaceae к фрагментам, не имеющим гомологии с другими представителями данного семейства. Для идентификации Campilobacter fetus была подобрана уникальная нуклеотидная последовательность от 657 631 до 658 422 положения в геноме данного микроорганизма (CP003871.2), содержащая ген flgG, кодирующий белок стержня базального тела жгутиков. Для Staphylococcus аureus подбор праймеров и оптимальных условий осуществления ПЦР проводили с помощью набора компьютерных программ Lasergene фирмы «DNASTAR» (США), из пакета которых программа Primer Select применялась для детекции Pseudomonas aeruginosa путем подбора пары олигонуклеотидных праймеров к гену 16S рРНК. Показатели валидности ПЦР и микробиологического методов лабораторной диагностики БОКИ у обследуемых детей 0–6 лет статистически оценивали через t-критерий Стьюдента.
Результаты и обсуждение
 В этиологической структуре ОКИ среди населения Уфы, согласно среднемноголетним данным (1997–2013), преобладали БОКИ, доля которых составила 56,8%. Между тем, вирусная природа при исследуемой патологии выявлялась лишь в 6,3% случаев, а на долю ОКИНЭ от общего числа заболевших ОКИ при этом приходилось свыше одной трети (36,9%). Аналогичный показатель в целом по РБ составил 51,6 %, тогда как доля вирусных ОКИ и удельный вес БОКИ оказались существенно более низкими (5,3 и 43,1% соответственно), чем в Уфе.
В этиологической структуре ОКИ среди населения Уфы, согласно среднемноголетним данным (1997–2013), преобладали БОКИ, доля которых составила 56,8%. Между тем, вирусная природа при исследуемой патологии выявлялась лишь в 6,3% случаев, а на долю ОКИНЭ от общего числа заболевших ОКИ при этом приходилось свыше одной трети (36,9%). Аналогичный показатель в целом по РБ составил 51,6 %, тогда как доля вирусных ОКИ и удельный вес БОКИ оказались существенно более низкими (5,3 и 43,1% соответственно), чем в Уфе.
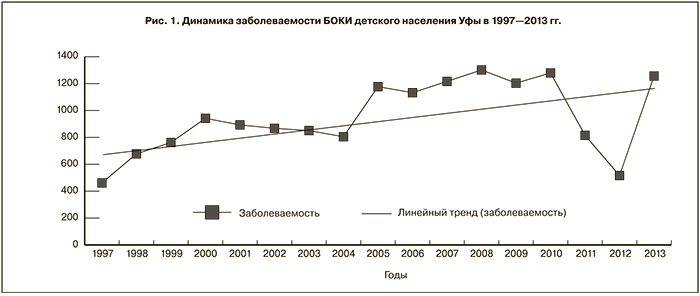
Интенсивный показатель заболеваемости БОКИ в изучаемый период на территории Уфы (230,1 ± 4,4 %ооо) также существенно превосходил таковой по РБ в целом (139,9 ± 1,8 %ооо). Такое же соотношение по проявлению БОКИ между анализируемыми территориями обнаруживалось как среди детей (897,5 ± 22,1 и 435,8 ± 7,5%ооо соответственно), так и среди взрослых (108,0 ± 3,3 и 71,5 ± 1,5 %ооо соответственно). При этом взрослые, особенно в Уфе, по интенсивности проявления БОКИ (108,0 ± 3,3 %ооо) многократно уступали детскому населению города (897,5 ± 22,1 %ооо). Эти данные свидетельствуют о значительном вкладе в формирование показателя заболеваемости БОКИ в РБ интенсивности ее проявления, регистрируемой среди детского населения Уфы, что явилось объективным обоснованием продолжения дальнейших исследований по результатам, полученным на данной территории у детей 0–14 лет. Исследуемый показатель в этой возрастной группе в ходе многолетнего наблюдения формировался при неблагоприятной тенденции развития заболеваемости БОКИ (рис. 1).
По соотношению кривой заболеваемости и линии прямолинейного тренда в ее динамике выделялся один полный цикл, ограниченный 1997–2010 гг., с периодами снижения (1997–2004) и подъема (2005–2010) исследуемого показателя. При этом 2011–2013 гг. символизировали собой начало периода снижения нового цикла, в котором показатель заболеваемости БОКИ у детей (862,6 ± 45,3 %ооо) имел сходное значение с таковым в 1997–2004 гг. (782,2 ± 39,9 %ооо). Вместе с тем в эти периоды показатели заболеваемости БОКИ детского населения в Уфе уступали уровню, зарегистрированному в период подъема полного цикла (1218,2 ± 56,8 %ооо).
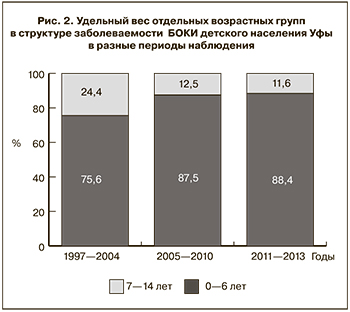
Несмотря на наблюдаемые отличия, для всех периодов характерным было более интенсивное, по сравнению с детьми 7–14 лет, вовлечение в эпидемический процесс БОКИ детей в возрасте 0–6 лет, на долю которых в последние годы приходилось почти 90% от числа всех заболевших данной патологией (рис. 2). Поэтому в исследованиях по оценке эффективности лабораторной диагностики БОКИ методом ПЦР в сравнении с микробиологическим методом основную группу обследуемых формировали из когорты больных детей 0–6 лет. При оценке микробиологического способа детекции возбудителей БОКИ в основной группе детей 0–6 лет выявляемость составила 69,7% всех случаев. Этот показатель при применении ПЦР возрос на 11,1% за счет дополнительного выявления бактериальных патогенов во второй подгруппе больных детей с первоначальным диагнозом ОКИНЭ. В целом при применении метода ПЦР у основной когорты детей доля расшифрованных случаев БОКИ (80,7%) была существенно выше, чем при использовании микробиологического метода, что свидетельствует о значимо более высокой чувствительности ПЦР (р < 0,05; табл. 1).
Данное положение, несмотря на сходство у исследуемых методов диагностики показателя специфичности (см. табл. 1), а также прогностической ценности положительного и отрицательного результатов (табл. 2), подтвердилось отношением правдоподобия (ОП).
Этот показатель, обобщающий величины чувствительности и специфичности исследуемых методов, выявил, что шанс получения положительного результата у больного БОКИ при использовании метода ПЦР в 1,4 раза выше, а вероятность получения отрицательного результата, напротив, в 1,6 раза ниже, чем при микробиологическом исследовании.
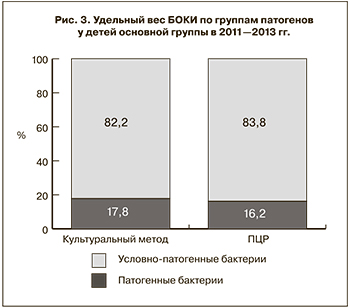
В составе идентифицированных бактериальных патогенов оба метода в равной степени выявили более чем 5-кратное преобладание представителей условно-патогенной флоры (рис. 3).
В то же время при микробиологической детекции все случаи БОКИ были идентифицированы как моноварианты, тогда как в исследовании методом ПЦР у больных детей как в подгруппе БОКИ, так и в подгруппе ОКИНЭ соответственно в 52,5 и 52,3% случаев были представленными ассоциациями из 2–6 условно-патогенных бактерий. Подобная закономерность, по данным ПЦР, при существенно меньшей доле ассоциантов выявлялась и в группе сравнения, включавшей детей с патологией верхних дыхательных путей (табл. 3).
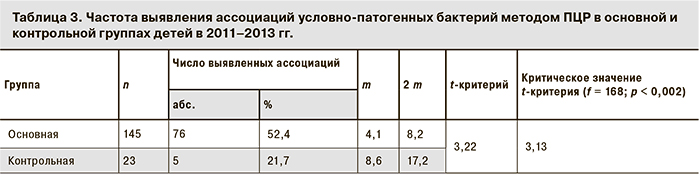
Приведенные данные свидетельствуют о том, что при применении ПЦР по сравнению с культуральным методом значительно увеличивается доля этиологически расшифрованных случаев БОКИ, выявленных в наиболее значимой в эпидемиологическом отношении группе детей 0–6 лет, что согласуется с известным положением о зависимости чувствительности метода лабораторной диагностики от интенсивности распространенности патологии среди населения [22]. Вместе с тем оба лабораторных метода регистрировали более чем 5-кратное преобладание доли условно-патогенной флоры в этиологии БОКИ. При этом случаи БОКИ при микробиологической детекции их возбудителей регистрировались лишь в виде моноинфекции, что, очевидно, связано с реализацией систематической ошибки при проведении лабораторной диагностики данным методом [22]. Наряду с этим в ряде крупных исследований показано, что идентификация условно-патогенных бактерий как возбудителей этих инфекций в моновариантах на количественной основе не может служить объективным основанием для назначения адекватной терапии и проведения соответствующих противоэпидемических мероприятий, поскольку они столь же часто выявляются и в контрольной группе детей без симптомов диареи [23, 24]. Этим, а также с фактором времени, имеющим решающее значение для больного, обусловлено предложение ряда клиницистов [25, 26] о начале лечения пациентов с ОКИ на симптоматической и патогенетической основах, без выделения этиологических патогенов. Однако подобный подход даже при несовершенстве микробиологического метода диагностики ОКИ совершенно не приемлем в эпидемиологической практике, в которой ПЦР, особенно в мультиплексном варианте, может составить ему альтернативу.
В отличие от микробиологического метода, обнаруживавшего возбудителей БОКИ лишь в моновариантах, ПЦР более чем в половине случаев как в подгруппе БОКИ, так и подгруппе ОКИНЭ обнаруживала микст-ассоциации из 2–6 представителей условно-патогенной флоры. Однако их возможная этиологическая значимость может стать более доказательной при обнаружении взаимосвязи генетических детерминант патогенности, персистенции и антибиотикорезистентности с клиническими проявлениями болезни, наличием у них генов полиморфизма и способности образовывать биопленки, наряду с выявлением динамики нарастания уровней специфических агентов ответной реакции организма у заболевших и факторов генетической предрасположенности у них к развитию исследуемой патологии [27– 29]. Подобный подход при ОКИ, обусловленных особенно условно-патогенной флорой, может наряду с существенным улучшением эффективности их лабораторной детекции внести значительной вклад в оптимизацию не только диагностической, но и информационной составляющей системы эпидемиологического надзора за этими инфекциями. Следовательно, организационно-управленческие решения, принятые на основе таких данных, будут наиболее адекватны условиям и причинам их возникновения, и значит достаточно эффективны при проведении профилактических и противоэпидемических мероприятий по борьбе с ОКИ.


