Туберкулез (ТБ) постепенно становится самым распространенным вторичным заболеванием у больных ВИЧ-инфекцией [1]. Люди, живущие с ВИЧ (ЛЖВ), имеют в 20 раз больший риск заболеть ТБ по сравнению с неинфицированными. Так, ежегодный риск для этой группы населения составляет 5–10%, в течение жизни – больше 30%, в то время как в популяции без ВИЧ – менее 10% в течение всей жизни [2].
Каждый год в мире выявляется более 1,3 млн случаев ВИЧ-ассоциированного ТБ. По данным ВОЗ за 2011 г., 13 % пациентов с ТБ имели ВИЧ-инфекцию [2]. В России этот показатель составляет 8,4% [3] и продолжает неуклонно расти. Прослеживается четкая зависимость заболеваемости ТБ и смертности среди ЛЖВ: у пациентов с количеством CD4+-лимфоцитов < 200 × 106 клеток/л заболеваемость в 6 раз выше, чем у пациентов с количеством CD 4+-лимфоцитов ≥ 500 × 106 клеток/л (9,1 и 1,5 на 100 пациенто-лет соответственно) [4].
Почти треть вновь выявленных случаев ТБ среди инфицированных ВИЧ заканчивается летальным исходом [5], особенно среди пациентов с уровнем CD4+- лимфоцитов < 100 клеток/мкл (ОШ 2,3; 95% ДИ 1,9–2,7) [6]. Это связано с тем, что у ЛЖВ ТБ развивается стремительно и не всегда типично [7]. В результате снижается возможность своевременного выявления больного, своевременного начала терапии, предотвращения дальнейшего распространения ТБ в популяции. Смертность от ТБ среди ВИЧ-инфицированных пациентов стала серьезной проблемой общественного здравоохранения. Посмертные исследования демонстрируют большое число случаев недиагностированного ТБ [8–10]. Во время прижизненной консультации фтизиатром диагноз ТБ не был поставлен в 22% случаев [11]. В то же время хорошо известно, что раннее начало лечения ТБ позволяет значительно снизить смертность [12].
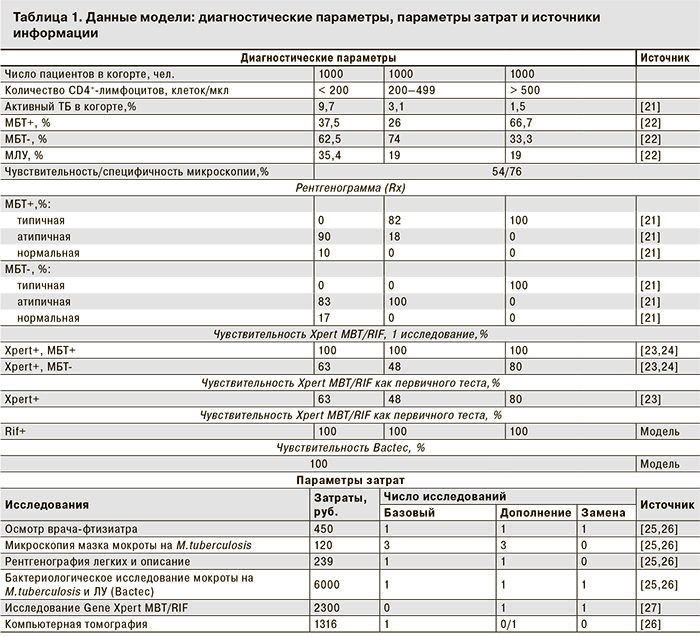
В Российской Федерации для диагностического поиска больных ТБ среди ЛЖВ используется такой же диагностический алгоритм, как и в общей популяции, включающий оценку симптомов (кашель, лихорадка, ночные поты и/или потеря веса), микроскопию окрашенного по Цилю–Нильсену мазка мокроты и рентгенограмму грудной клетки (Rx), с последующим культуральным исследованием для подтверждения диагноза. Даже в общей популяции каждый из этих методов имеет ограниченную чувствительность, а в популяции ЛЖВ эти показатели существенно снижаются. Так, например, чувствительность метода прямой микроскопии в общей популяции составляет около 50%, а у пациентов с ВИЧ – от 15 до 24% [13–18]. Особенно низкая чувствительность метода фиксируется при скудном бактериовыделении. Нестандартная рентгенологическая картина, особенно при низком уровне CD4+-лимфоцитов [6], еще больше осложняет постановку диагноза ТБ в популяции ЛЖВ. Кроме того, проведение всех необходимых диагностических мероприятий занимает значительное время и требует нескольких визитов в лечебное учреждение, в результате чего часть пациентов «теряется».
В условиях высокой распространенности множественной лекарственной устойчивости (МЛУ) ТБ в РФ очень важно и то, насколько своевременно определена чувствительность M. tuberculosis (МБТ) к противотуберкулезным препаратам. Быстрое получение данных о лекарственной устойчивости (ЛУ) возбудителя ТБ позволяет начать терапию с учетом этого, избежать амплификации ЛУ, повысить показатели успешности проведенного лечения, уменьшить количество рецидивов и летальных исходов. В связи с этим в мире не прекращаются поиски быстрых и высокочувствительных методов диагностики ТБ.
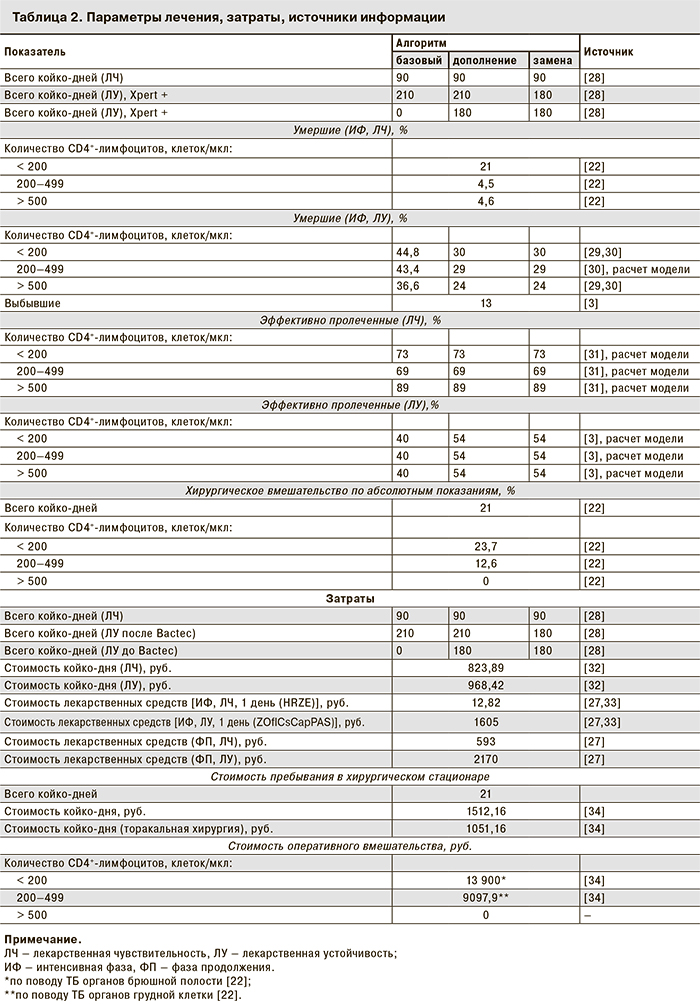
В 2012 г. для первоначального скрининга на ТБ с ЛУ или ВИЧ-ассоциированный ТБ ВОЗ был рекомендован метод Gene Xpert MTB/Rif. Время обнаружения МБТ для этого теста составляет менее одного дня.
К сожалению, внедрение быстрых методов диагностики ТБ не исключает пропуска диагноза у ЛЖВ. На XIX Международной конференции по ВИЧ, которая проходила в Вашингтоне в 2012 г., были доложены результаты когортного исследования, в рамках которого оценивали влияние результатов скрининга на основе симптомов на чувствительность теста Gene Xpert MTB/Rif среди ЛЖВ, не получающих АРВТ. Была подчеркнута необходимость внедрения в рутинную практику перед проведением Gene Xpert MTB/Rif оценки клинических симптомов и индуцирования мокроты [19].
Для борьбы с распространением ТБ в РФ функционируют специальные целевые программы, осуществление которых требует привлечения значительных финансовых средств. Так, только в 2008 г. на одного больного ТБ было затрачено в среднем 78 00 руб. [20]. В связи с этим крайне важно обеспечить повышение эффективности применяемых диагностических алгоритмов и рационально использовать бюджетные ресурсы.
Цель исследования – оценить эффективность затрат на различные алгоритмы диагностического поиска активного ТБ у ЛЖВ.
Материалы и методы
Была создана детерминированная аналитическая модель с построением дерева принятия решений. Расчет производился для 3 гипотетических когорт по 1000 пациентов в каждой, в зависимости от уровня CD4+-лимфоцитов (< 200, 200–499 и > 00 клеток/мкл) в рамках двухлетнего временного горизонта. Исследование проводилось с позиции системы здравоохранения, поэтому учитывались только прямые медицинские затраты. Модель учитывала условия оказания медицинской помощи в Российской Федерации.
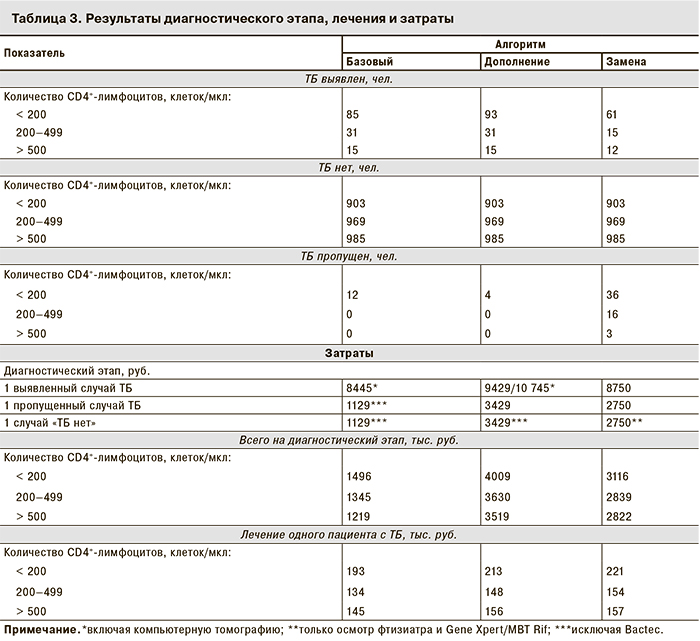
А. Диагностический этап
Анализировались следующие диагностические алгоритмы:
«Базовый» – последовательность стандартных этапов диагностики ТБ в РФ: микроскопия мазка мокроты, рентгенографическое исследование органов грудной клетки и дополнительные методы в случае неясной рентгенологической картины (компьютерная томография) с последующим культуральным исследованием для подтверждения диагноза и определения ЛУ M. tuberculosis на жидких средах методом Bactec MGIT;
«Дополнение» – последовательность стандартных диагностических этапов дополнена быстрым молекулярно-диагностическим методом Gene Xpert MBT/Rif, что позволяет получить информацию о наличии возбудителя ТБ в исследуемом материале и его чувствительности или устойчивости к рифампицину в течение нескольких часов, начать терапию ТБ с учетом ЛУ возбудителя и сократить пребывание пациента в стационаре;
«Замена» – последовательность стандартных диагностических этапов заменена исследованием Gene Xpert MBT/Rif для максимального сокращения времени на диагностический этап и получения информации о диагнозе ТБ в течение одного дня.
Диагноз ТБ считался неустановленным, если в результате диагностического поиска были получены следующие результаты:
- для алгоритма «Базовый» – отрицательный результат микроскопии мазка мокроты и рентгенограмма органов грудной клетки, описанная (оцененная) как нормальная;
- для алгоритма «Дополнение» – отрицательный результат микроскопии мазка мокроты, рентгенограмма органов грудной клетки, описанная как нормальная, и отрицательный результат исследования GENE Xpert MBT/Rif;
- для алгоритма «Замена» – отрицательный результат исследования GENE Xpert MBT/Rif.
Параметры модели представлены в табл. 1.
Б. Лечение и затраты
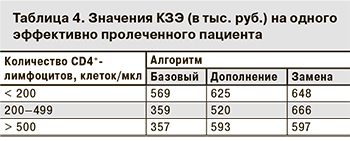 По итогам диагностического этапа принималось решение о старте противотуберкулезной терапии в условиях круглосуточного стационара с учётом данных о наличии или отсутствии ЛУ (в соответствии с действующей в РФ «Инструкцией по химиотерапии больных туберкулезом» [28]). Если данные о ЛУ отсутствовали на момент госпитализации (алгоритм «Базовый»), пациенты в течение 1 мес. получали терапию по 1-му режиму (HRZE) с дальнейшим переходом на 4-й режим при получении данных о ЛУ (6 мес. ZOflCsCapPAS и 12 мес. ZOflPAS) или продолжали получать 1-й режим (и 6 мес. HZE). Если устойчивость к рифампицину была известна на момент госпитализации (алгоритмы «Дополнение» и «Замена»), терапию проводили в соответствии с 4-м режимом [28]. Выбывшие в процессе лечения пациенты в дальнейшем терапии не получали. Эффективность лечения и уровень летальности пациентов с разным иммунным статусом соответствовали данным российских исследователей [22, 29], так как подходы к диагностическому поиску, схемам терапии, оценке эффективности проводимого лечения и стоимость диагностических мероприятий, лекарственных средств и пребывания пациента в стационаре значительно отличаются от других стран.
По итогам диагностического этапа принималось решение о старте противотуберкулезной терапии в условиях круглосуточного стационара с учётом данных о наличии или отсутствии ЛУ (в соответствии с действующей в РФ «Инструкцией по химиотерапии больных туберкулезом» [28]). Если данные о ЛУ отсутствовали на момент госпитализации (алгоритм «Базовый»), пациенты в течение 1 мес. получали терапию по 1-му режиму (HRZE) с дальнейшим переходом на 4-й режим при получении данных о ЛУ (6 мес. ZOflCsCapPAS и 12 мес. ZOflPAS) или продолжали получать 1-й режим (и 6 мес. HZE). Если устойчивость к рифампицину была известна на момент госпитализации (алгоритмы «Дополнение» и «Замена»), терапию проводили в соответствии с 4-м режимом [28]. Выбывшие в процессе лечения пациенты в дальнейшем терапии не получали. Эффективность лечения и уровень летальности пациентов с разным иммунным статусом соответствовали данным российских исследователей [22, 29], так как подходы к диагностическому поиску, схемам терапии, оценке эффективности проводимого лечения и стоимость диагностических мероприятий, лекарственных средств и пребывания пациента в стационаре значительно отличаются от других стран.
Предполагалось, что все пациенты с ТБ, в соответствии с отечественными и международными рекомендациями, получали АРВТ. Стоимость АРВТ при расчетах не учитывалась.
Величина затрат соответствовала тарифам на оказание противотуберкулезной медицинской помощи, тарифам на услуги в системе обязательного медицинского страхования по Санкт-Петербургу на 2014 г., прайс-листу на платные услуги Санкт-Петербургского НИИ фтизиопульмонологии и Центрального НИИ туберкулеза (Москва). Схемы терапии и их продолжительность регламентированы Приказом Министерства здравоохранения Российской Федерации от 21.03.2003 № 109 «О совершенствовании противотуберкулезных мероприятий в Российской Федерации» [28]. Расчет стоимости схем терапии производился в соответствии с ценами, указанными на сайте Фармэксперт [27].
Общие затраты в каждой когорте включали предполагаемые затраты на различные варианты диагностического поиска и последующее лечение в зависимости от полученных на этапе диагностики данных о ЛУ к рифампицину. При расчете затрат на умерших пациентов сделано допущение о том, что летальные исходы распределялись равномерно в течение периода пребывания в стационаре. При расчете затрат на выбывших пациентов сделано допущение, что выбывание происходило равномерно в течение периода пребывания в стационаре. В итоге были рассчитаны затраты на одного эффективно пролеченного пациента для каждой когорты и всех анализируемых алгоритмов диагностического поиска, дополнительные затраты на одного дополнительно эффективно пролеченного пациента, дополнительные затраты на один дополнительно предотвращенный летальный исход на протяжении терапии. Основные параметры моделирования представлены в табл. 2.
Результаты и обсуждение
При расчете затрат на когорту ЛЖВ (п = 1000) с разным уровнем CD4+-лимфоцитов (< 200, 200–499 и > 500 клеток/мкл) за 2 года получены следующие результаты.
В когорте с уровнем CD4+-лимфоцитов < 200 клеток/мкл добавление к алгоритму «Базовый» молекулярно-генетического метода обнаружения ДНК M. tuberculosis (Gene Xpert MBT/Rif) позволяет:
- дополнительно выявить 8 больных туберкулезом;
- начать терапию ТБ с учетом ЛУ к рифампицину 26 пациентам, что составляет 87% от расчетного количества;
- дополнительно эффективно пролечить 7 пациентов;
- дополнительно предотвратить наступление 2 летальных исходов в течение интенсивной фазы.
В структуре затрат на диагностику и лечение пациентов в этой когорте при использовании любого диагностического алгоритма практически 80% составляют затраты на лечение. Затраты на одного больного ТБ из когорты при использовании алгоритма «Дополнение» по сравнению с алгоритмом «Базовый» выше на 7500 руб.
В когортах с более высокими показателями иммунного статуса (200–499 и > 500 клеток/мкл), алгоритм «Базовый» позволяет выявить всех больных ТБ среди когорты, поэтому добавление Gene Xpert MBT/Rif в этом случае не дает дополнительных преимуществ по показателям выявления, но позволяет:
- начать терапию с учетом ЛУ к рифампицину 4 пациентов (67% от расчетного количества) с уровнем CD4+-лимфоцитов от 200–499 клеток/мкл и 3 (100%) пациентов с уровнем > 500 клеток/мкл;
- дополнительно эффективно пролечить по одному пациенту в каждой когорте;
- дополнительно предотвратить наступление по 0,5 летальных исходов в течение ИФ.
В структуре затрат в когортах с уровнем CD4+-лимфоцитов 200–499 и > 500 клеток/мкл преобладают затраты на диагностику. В когорте с уровнем CD4+-лимфоцитов 200–499 клеток/мкл они составляют от 1/3 (алгоритм «Базовый») до 1/2 (алгоритмы «Дополнение» и «Замена»), в когорте с уровнем CD4+-лимфоцитов > 500 клеток/мкл – от 1/2 (алгоритм «Базовый») до 2/3 (алгоритмы «Дополнение» и «Замена»).
Разница в затратах на одного больного ТБ из этих когорт при использовании алгоритма «Дополнение» по сравнению с алгоритмом «Базовый» примерно одинакова и составляет около 2500 руб.
 Использование исследования Gene Xpert MBT/Rif в качестве замены алгоритма «Базовый» приводит к диагностическим потерям в каждой когорте (табл. 3).
Использование исследования Gene Xpert MBT/Rif в качестве замены алгоритма «Базовый» приводит к диагностическим потерям в каждой когорте (табл. 3).
Расчет затрат на одного эффективно пролеченного пациента показал, что самые низкие значения коэффициента «затраты–эффективность» (КЗЭ) во всех когортах соответствуют алгоритму «Базовый» (табл. 4).
При использовании алгоритма «Дополнение» по сравнению с «Базовым» дополнительные затраты на одного эффективно пролеченного пациента из когорты с уровнем CD4+-лимфоцитов < 200 клеток/мкл составляют 1123 тыс. руб., из когорты с уровнем 200–499 клеток/мкл – 5422 тыс. руб., из когорты с уровнем > 500 клеток/мкл – 6093 тыс. руб.
Дополнительные затраты на 1 предотвращенный летальный исход в когорте с уровнем CD4+-лимфоцитов < 200 клеток/мкл составили 5035 тыс.руб., в когорте с уровнем 200–499 клеток/мкл – 5226 тыс. руб., в когорте с уровнем > 500 клеток/мкл – 6649 тыс. руб.
Анализ чувствительности
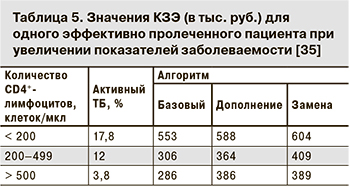
Оценивалось влияние изменения показателя заболеваемости активным ТБ среди ЛЖВ на значение КЭЗ в зависимости от используемой диагностической стратегии. В случае увеличения заболеваемости ТБ самые низкие значения КЗЭ во всех когортах соответствуют алгоритму «Базовый», как и в базовом варианте (табл. 5).
Ограничения анализа
Проведенный анализ имеет ряд важных ограничений. В частности, в данном исследовании не учитывались популяционный эффект диагностических пропусков и влияние времени, затраченного на выявление больных ТБ, при движении в рамках различных диагностических алгоритмов.
Выводы
- При диагностическом поиске ТБ среди ЛЖВ представляется эффективным добавление Gene Xpert MBT/Rif в группе пациентов с уровнем CD4+-лимоцитов < 200 клеток/мкл. Оно позволяет дополнительно выявить 8 больных ТБ на 1000 ЛЖВ и значительно увеличить число эффективно пролеченных пациентов, включая пациентов с исходной ЛУ к рифампицину.
- Использование Gene Xpert MBT/Rif в качестве замены стандартного алгоритма поиска может привести к значительному увеличению числа диагностических пропусков при любом уровне иммунного статуса ЛЖВ и не может рассматриваться в качестве альтернативы алгоритму «Базовый».
- Ориентация только на величину КЗЭ может привести к диагностическим пропускам, то есть потере возможности увеличить количество эффективно пролеченных пациентов.


