Несмотря на несомненные успехи, достигнутые в лечении ВИЧ-инфекции, продолжительность жизни ВИЧ-инфицированных людей все же остается меньше средней продолжительности жизни в общей популяции. Серьезный вклад в структуру смертности на фоне ВИЧ-инфекции вносят заболевания, в основе которых лежит эндотелиальная дисфункция (ишемическая болезнь сердца, острые нарушения мозгового кровообращения, ВИЧ-ассоциированная деменция) [1]. Доказано, что определенный вклад в развитие эндотелиальной дисфункции, наряду с прямым и опосредованным воздействием самого вируса иммунодефицита человека, вносит и использование в течение длительного времени комбинированной антиретровирусной терапии (АРВТ), ассоциирующееся с развитием так называемого синдрома липодистрофии с закономерным повышением риска сердечно-сосудистых заболеваний (ССЗ) [2, 3]. Данная проблема усугубляется увеличением общей продолжительности приема препаратов как следствия ее эффективности, а также «старением» популяции ВИЧ-инфицированных людей.
Термин «синдром липодистрофии» был веден в обиход в 1998 г. А. Carr и соавт. [2] для обозначения состояния, включающего «перераспределение» жировой ткани и метаболические нарушения у пациентов, получающих ингибиторы протезы (ИП) ВИЧ. Можно рассматривать клинические и лабораторные аспекты данного синдрома. Одним из его клинических проявлений является так называемая липоатрофия, под которой понимается истончение слоя подкожной жировой клетчатки (ПЖК) на лице, конечностях и ягодицах [2, 3]. Другим компонентом синдрома является избыточное накопление жировой ткани в области живота, молочных желез и дорсоцервикальной области, а иногда также в мышечной ткани и ткани печени (рис. 1, см. на вклейке) [2, 3]. Данные клинические симптомы часто ассоциируются с комплексными метаболическими нарушениями, такими как резистентность периферических тканей и печени к инсулину, нарушение толерантности к глюкозе вплоть до развития сахарного диабета 2-го типа, гипертриглицеридемия, гиперхолестеринемия, повышение уровня свободных жирных кислот и доли липопротеинов низкой (ЛПНП) и очень низкой плотности (ЛПОНП). При этом лабораторные отклонения могут предшествовать клиническим проявлениям. Тем не менее наибольшая выраженность метаболических изменений характерна для пациентов с выраженной клинической картиной липодистрофии [4, 5]. Синдром липодистрофии частично пересекается с метаболическим синдромом, для диагностики которого в соответствии с критериями NCEP (Национальная образовательная программа по холестерину, США) необходимо наличие 3 из 5 клинических и/или лабораторных симптомов: обхват талии ≥ 88 см у женщин и ≥ 102 см у мужчин, артериальное давление ≥ 130/85 мм рт. ст., уровень триглицеридов ≥ 1,7 ммоль/л, концентрация холестерина липопротеидов высокой плотности (ЛПВП) ≤ 1,20 ммоль/л у женщин и ≤ 1,0 ммоль/л у мужчин, уровень глюкозы в сыворотке ≥ 6,1 ммоль/л [6].
Несомненно, что метаболический синдром ассоциирован с висцеральным ожирением, однако, как это ни парадоксально, потеря жировой массы может также сопровождаться неблагоприятным метаболическим профилем с аналогичным риском развития ССЗ [7]. Возможно, это связано с тем, что ПЖК выполняет роль своеобразного буфера, связывающего свободные жирные кислоты. Повышение концентрации свободных жирных кислот и триглицеридов в крови в отсутствие захвата их ПЖК может привести к накоплению их в печени и скелетных мышцах, повышению синтеза ЛПОНП печенью и развитию резистентности тканей к инсулину [8]. Это подтверждается повышением концентрации свободных жирных кислот и ЛПОНП с развитием жировой дистрофии печени у пациентов с симптомами липоатрофии [8].
Следует отметить, что течение ВИЧ-инфекции как таковой уже ассоциировано с нарушениями липидного обмена в виде потери веса, общего дефицита ПЖК, снижения уровня общего холестерина, ЛПНП, ЛПВП и повышения уровня триглицеридов [9, 10]. Данные метаболические нарушения обусловлены, по-видимому, характерным для ВИЧ-инфекции состоянием хронического воспаления и ассоциированным с ним нарушением гомеостаза организма с преобладанием катаболических процессов над анаболическими [9, 10]. Ввиду этого сам факт наличия у пациента ВИЧ-инфекции может рассматриваться как фактор риска развития метаболического синдрома и ССЗ [11].
АРВТ жизненно необходима для ВИЧ-инфицированных пациентов, однако она в какой-то степени может усугублять у них метаболические нарушения. Частота липодистрофии в ВИЧ-популяции варьирует от 10 до 80% в зависимости от типа и продолжительности терапии [2, 3]. По результатам большого поперечного исследования распространенность гиперхолестеринемии (при пороговом значении 6,2 ммоль/л), гипертриглицеридемии (> 2,3 ммоль/л) и снижения холестерина ЛПВП (< 0,9 ммоль/л) составляет 10–27, 23–40 и 19–27% соответственно в зависимости от режима АРВТ [12]. Риск развития синдрома липодистрофии зависит от возраста и преморбидного фона пациента, уровня иммуносупрессии, используемой комбинации антиретровирусных препаратов и продолжительности терапии [3, 12].
Те или иные компоненты липодистрофии характерны для всех классов лекарственных препаратов, однако их характер и степень выраженности различаются. К примеру, липоатрофия преимущественно связана с приемом нуклеозидных (чаще тимидиновых) аналогов ингибиторов обратной транскриптазы (ставудин, зидовудин), тогда как дислипидемия возможна при использовании практически любого антиретровирусного препарата, но все же чаще наблюдается у пациентов, получающих схемы, включающие ИП [13,14].
Показано, что ИП in vitro индуцируют резистентность к инсулину с соответствующим повышением риска развития сахарного диабета и дальнейшим усугублением метаболических нарушений [15]. В значительной степени это обусловлено ингибированием мембранного белка GLUT4, обеспечивающего транспорт глюкозы в клетки преимущественно жировой и мышечной ткани [16]. Общеизвестно, что инсулин ингибирует липолиз и повышает захват тканями свободных жирных кислот, синтез триглицеридов и окисление жиров. Соответственно развитие резистентности тканей к инсулину сопровождается липолизом с повышением концентрации в крови свободных жирных кислот и триглицеридов. Прямой эффект нуклеозидных ингибиторов обратной транскриптазы (НИОТ) и ненуклеозидных ингибиторов обратной транскриптазы (ННИОТ) на чувствительность тканей к инсулину не был продемонстрирован, но возможна непрямая провокация инсулинорезистентности через вызываемые ими нарушения липидного обмена [3]. Частота инсулинорезистентности у больных, получающих АРВТ, достигает 60% [17]. В многоцентровом исследовании когорты ВИЧ-инфицированных мужчин в течение 3 лет диабет в 3 раза чаще развивался у больных, получающих АРВТ, при этом риск развития сахарного диабета был статистически значимо выше у пациентов, принимающих ИП, ставудин или эфавиренз [18].
Синдром липодистрофии, по-видимому, необходимо рассматривать как комплексное метаболическое нарушение, которое не может быть объяснено каким-либо одним, универсальным патогенетическим механизмом. По крайней мере, можно с уверенностью констатировать два момента: 1) липоатрофия и увеличение объема жировой ткани обусловлены принципиально разными патогенетическими механизмами; 2) патогенез происходящих метаболических нарушений различен при использовании препаратов разных классов и даже при приеме разных препаратов одного класса.
Механизм развития дислипидемии и висцерального ожирения под действием ИП многообразен и включает в том числе ингибирование распада транскрипционного фактора SREBP-1, необходимого для дифференцировки адипоцитов и биосинтеза свободных жирных кислот, триглицеридов и холестерина [19]. Избыток данного фактора в печени приводит к повышению в ней липогенеза (рис. 2, см. на вклейке). Кроме этого, показано, что саквинавир, индинавир, ритонавир подавляют распад аполипопротеина В, результатом чего является накопление его в клетках, высвобождение в ответ на повышение в крови содержания свободных жирных кислот с повышением концентрации ЛПОНП [20]. Определенную роль в развитии метаболических нарушений играют также подавление активности липазы в печени и ингибирование протеасом [16].
В основе развития липоатрофии лежит ингибирование НИОТ митохондриальной γ-ДНК-полимеразы с последующим нарушением функции митохондрий [21]. Доказана также способность НИОТ стимулировать апоптоз адипоцитов [22].
Изменения липидного профиля развиваются в течение недель после назначения ИП. Наиболее выраженные нарушения выявлены у пациентов, получающих ритонавир [23]. Прием атазанавира практически не влияет на липидный профиль [24]. Для остальных препаратов класса ИП характерно умеренное влияние на метаболические процессы в организме. В целом пациенты, получающие препараты, бустированные ритонавиром, имеют худший липидный профиль по сравнению с пациентами, получающими небустированные ИП.
В рандомизированном исследовании было показано, что изменения концентрации общего холестерина были сопоставимы при приеме лопинавира/ритонавира и нелфинавира (средний прирост холестерина – 53 и 48 мг% соответственно), но в то же время в группе пациентов, получающих лопинавир/ритонавир выявлено более значительное повышение уровня триглицеридов (на 125 и 47 мг% соответственно) [25].
Исследование KLEAN выявило одинаковую частоту и выраженность метаболических нарушений при сопоставимой вирусологической и иммунологической эффективности терапии в группах наивных пациентов, принимающих дважды в день фосампренавир/ритонавир (700/100 мг) или лопинавир/ритонавир (400/100 мг) [26]. По-видимому, влияние бустированного фосампренавира на липидный профиль обусловлено не столько им самим, сколько действием ритонавира. К примеру, изменения уровня холестерина были сопоставимы при использовании в течение 48 нед. фосампренавира в комбинации с ритонавиром (1400/100 мг) и атазанавира с ритонавиром (300/100 мг) при условии однократного приема в сутки (в исследование были включены только наивные пациенты, все они получали кроме ИП также тенофовир и эмтрицитабин) [27]. C.B. Hicks и соавт. [28] продемонстрировали, что 96-недельный курс лечения фосампренавиром с ритонавиром в дозе 1400/100 мг при однократном приеме в сутки (в комбинации с абакавиром и ламивудином) характеризовался даже большей вирусологической эффективностью, чем прием фосампренавира/ритонавира в дозе 1400/200 мг, что было обусловлено лучшей переносимостью схемы и, соответственно, большей приверженностью. При этом содержание общего холестерина и холестерина ЛПВП в обеих группах было сопоставимо при значительно меньшем уровне триглицеридов у пациентов, принимавших препараты в дозе 1400/100 мг. Таким образом, однократный прием в сутки фосампренавира со 100 мг ритонавира является более предпочтительным с точки зрения минимального влияния на липидный профиль. Следует отметить, что однократный прием фосампренавира/ритонавира в сутки может быть рекомендован только для больных, ранее не получавших АРВТ.
Схемы, не включающие ИП, также могут вызывать нарушения метаболизма жиров и углеводов, хотя и менее выраженные, чем при использовании ИП [12]. Среди ННИОТ эфавиренз ассоциируется с более высокими уровнями холестерина и триглицеридов, чем невирапин [29]. Применительно к классу НИОТ наибольшие метаболические расстройства наблюдаются при использовании диданозина и ставудина. Продемонстрировано значительно большее повышение уровня общего холестерина при использовании схемы, включающей ставудин/ламивудин/нелфинавир, в сравнении со схемой зидовудин/ламивудин/нелфинавир [30] и более значительное повышение уровня триглицеридов при использовании схемы ставудин/диданозин/индинавир в сравнении со схемой зидовудин/ламивудин/нелфинавир [31]. В исследовании S. Staszewski с соавт. [32] наблюдалось значительное преимущество тенофовира перед ставудином с точки зрения липидного профиля пациентов.
Для относительно новых групп лекарственных препаратов, таких как ингибиторы интегразы, ингибиторы слияния и антагонисты CCR5-корецепторов, по-видимому, мало характерны нарушения метаболизма жиров [33, 34]. Исследование MERIT продемонстрировало значительное преимущество антагониста CCR5-корецепторов маравирока над эфавирензом в отношении влияния на липидный обмен (оба препарата назначали в комбинации с зидовудином и ламивудином в течение 96 нед.). Применение маравирока, в отличие от эфавиренза, не приводило к существенному повышению уровней общего холестерина, ЛПНП и триглицеридов, независимо от исходных показателей липидных фракций у больных. Более того, на фоне применения схемы, включающей маравирок, продемонстрировано улучшение показателей липидного обмена у значительной части больных с исходной дислипидемией. Авторы делают вывод, что маравирок может быть оптимальным выбором для пациентов с высоким риском развития ССЗ [34]. Благоприятное воздействие этого препарата на липидный профиль и сердечно-сосудистую заболеваемость отчасти связано с его уникальной способностью блокировать хемокиновые рецепторы CCR5 и уменьшать тем самым активность системного воспаления, которое на сегодняшний день рассматривается в качестве основного фактора риска развития дислипидемии и атеросклероза как в популяции в целом, так и среди ВИЧ-инфицированных пациентов [10, 34].
Развитие липоатрофии связано, главным образом, с влиянием НИОТ. Ряд исследований демонстрирует преимущество таких препаратов как абакавир, ламивудин и тенофовир перед другими представителями этого класса. Сравнение схем, содержащих абакавир, с режимами на основе ставудина показывает явное преимущество абакавира (увеличение массы ПЖК на 913 г против уменьшения на 1578 г в течение 96 нед. терапии; p < 0,001) [35]. Другое исследование продемонстрировало преимущество комбинации зидовудина и ламивудина перед комбинацией ставудина и диданозина (прирост объема ПЖК 1,7% против потери 26,4% ПЖК) [36]. Не выявлено разницы в развитии липоатрофии при использовании абакавира и тенофовира [37]. При применении схем, включающих абакавир, частота и степень выраженности периферической липоатрофии была сопоставима с таковой при использовании схем, не содержащих НИОТ [38]. Это, по сути, означает, что для абакавира не свойственен данный побочный эффект, присущий классу НИОТ, что делает его препаратом выбора у больных с риском развития липоатрофии. Применение абакавира поначалу было ограничено возможностью развития гиперчувствительности, однако в последние годы в связи с доступностью теста на наличие аллеля HLA-B*5701, характеризующегося практически 100% чувствительностью, вероятность развития этого опасного нежелательного явления сведена к минимуму [39].
Использование других классов препаратов в меньшей степени сопровождается развитием липоатрофии; при этом большая частота липоатрофии характерна для эфавиренза, нежели для ИП [40]. Тем не менее при использовании небустированного атазанавира в течение 96 нед. также отмечено выраженное уменьшение объема ПЖК на ногах, чего не наблюдалось при применении атазанавира, бустированного ритонавиром [41]. Частота развития липоатрофии при использовании ралтегравира была сопоставима с таковой при использовании эфавиренза [42]. По результатам описательных исследований применение маравирока не ассоциируется с развитием липоатрофии [43].
Основные принципы ведения ВИЧ-инфицированных пациентов с синдромом липодистрофии согласуются с имеющимися рекомендациями по ведению больных с метаболическим синдромом и дислипидемией [43–45]. Профилактика и коррекция синдрома липодистрофии складывается из следующих составляющих:
1. Определение липидного профиля пациентов до начала АРВТ и в течение 3–6 мес. после начала или смены схемы терапии.
2. Оценка степени риска ССЗ с использованием онлайн калькулятора (http://cvdrisk.nhlbi.nih.gov/calculator.asp).
3. Коррекция образа жизни (отказ от курения; диета с уменьшением содержания животных жиров, холестерина, общего числа калорий и с увеличением содержания омега-3-жирных кислот; аэробная физическая нагрузка).
4. Подбор схемы АРВТ с оптимальным липидным профилем (см. таблицу).
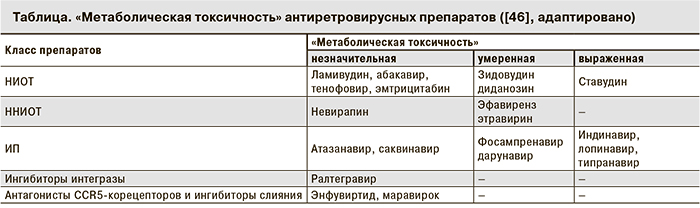
В случаях выраженных клинических или лабораторных проявлений липодистрофии возможна замена схемы АРВТ, хотя, по-видимому, рассчитывать на выраженную эффективность данной тактики у всех больных не приходится. Тем не менее показано, что замена ИП на ННИОТ (невирапин или эфавиренз) или НИОТ (абакавир) у пациентов со стабильным подавлением репликации вируса позволяет сохранить эффективность схемы и может частично сгладить изменения липидного профиля у больных [47, 48]. Единственная доказанная возможность уменьшить проявления липоатрофии связана с заменой тимидиновых аналогов (ставудина и зидовудина) на абакавир или тенофовир [49]. В частности замена ставудина на абакавир привела к значительному приросту объема ПЖК на руках и ногах (41 и 52% соответственно). Данный эффект не отмечен при замене ИП или ННИОТ на абакавир [50]. При выраженной липоатрофии возможно рассмотрение схем, не содержащих НИОТ, однако следует иметь в виду, что в этой ситуации может возрасти риск развития дислипидемии [43].
5. Использование лекарств, корригирующих метаболические нарушения у пациентов. Пациентам, у которых содержание ЛПНП выше нормы или уровень триглицеридов 2,3–5,6 ммоль/л, при одновременном повышении уровня холестерина, не относящегося к ЛПВП, рекомендуется назначать ингибиторы HMG-CoA-редуктазы (статины). Учитывая возможность развития серьезных межлекарственных взаимодействий отдельных статинов с ИП при ВИЧ-инфекции, предпочтительнее использование двух препаратов этого класса: правастатина (в дозе 20–40 мг в сутки) или аторвастатина (в дозе 10–20 мг в сутки). При повышении уровня триглицеридов выше 5,6 ммоль/л наиболее целесообразно использовать препараты из группы фибратов: гемфиброзил в дозе 600 мг 2 раза в сутки или фенофибрат в дозе 145–200 мг в сутки. Возможно применение комбинации фибратов со статинами, что позволяет значительно снизить дозу довольно токсичных статинов. Альтернативой статинам и фибратам может быть использование ниацина (никотиновой кислоты) per os в дозе 2–4 г в сутки, уменьшающего уровни как триглицеридов, так и ЛПНП. Следующий препарат – эзетимиб (в дозе 10 мг в сутки) снижает уровень холестерина за счет ингибирования его абсорбции в кишечнике. Метформин в дозе по 500 мг 2 раза в сутки способствует снижению объема висцерального жира, повышению чувствительности тканей к инсулину, улучшению липидного профиля и эндотелиальной функции. Однако метформин следует с осторожностью использовать у пациентов с липоатрофией в связи с риском еще большего снижения объема ПЖК. В этом случае препаратами выбора могут быть тиазолидиндионы пиоглитазон и росиглитазон [51].
Таким образом, для течения ВИЧ-инфекции характерны метаболические нарушения, проявляющиеся как клинически, так и в виде изменений лабораторных показателей. Некоторые из этих проявлений могут прогрессировать на фоне АРВТ, что обусловлено не столько токсичностью препаратов, сколько необходимостью многолетнего их приема. Однозначно то, что возможность развития побочных эффектов ни в коей мере не может рассматриваться как основание для отказа от АРВТ, поскольку она на сегодняшний день является единственным эффективным методом контроля над течением ВИЧ-инфекции. Тем не менее несомненная связь вышеуказанных метаболических нарушений с развитием эндотелиальной дисфункции и ССЗ, а также влияние на качество жизни пациентов и, соответственно, на приверженность к терапии обосновывают необходимость проведения их профилактики и коррекции. В связи с тем, что влияние замены схемы терапии на выраженность симптомов липодистрофии не всегда убедительно (хотя и может иметь эффект у отдельных больных), наиболее перспективным, по-видимому, является подбор схемы первой линии терапии, включающей препараты, оказывающие оптимальное воздействие на липидный профиль. Особенно важна такая тактика у пациентов с неблагоприятным преморбидным фоном в отношении риска ССЗ. Регулярное наблюдение за пациентами, получающими АРВТ, со своевременной коррекцией выявленных нарушений метаболизма позволит сделать лечение ВИЧ-инфекции максимально безопасным и комфортным для больного.


