Природа длительного субфебрилитета остается неизученной. Большинство клиницистов придерживаются точки зрения о полиэтиологичности длительного повышения температуры тела, рассматривая в качестве причины патологию эндокринной, нервной или иммунной систем [1–4].
По ходу изучения этой проблемы неоднократно возникали основания думать, конечно, и о роли инфекционных патогенов, но многочисленные исследования, проведенные в разные годы, не увенчались полным успехом [5–7].
Сегодня, в связи с бурным развитием учения о герпесвирусных инфекциях (ГВИ), появились основания подозревать вирусы семейства Herpesviridae в формировании синдрома длительного субфебрилитета у детей.
Дело в том, что персистирующая ГВИ в современных условиях рассматривается как одна из форм взаимодействия макро- и микроорганизма на клеточном уровне, позволяющая возбудителю не только длительное время находиться в организме в латентном состоянии, но и активно репродуцироваться, быть причиной формирования вторичных иммунодефицитов, аутоиммунной патологии, обладать онкогенным действием, приводить к срывам механизмов адаптации, нарушая тем самым гомеостаз организма, одним из основных составляющих которого является терморегуляция [7–9].
Целью нашей работы явилось исследование роли ГВИ в формировании синдрома длительного субфебрилитета.
Материалы и методы
Под наблюдением находились 127 детей в возрасте от 6 мес. до 15 лет, поступивших в инфекционные отделения Центральной клинической больницы, Республиканской детской клинической больницы, Морозовской детской городской клинической больницы с диагнозами: длительный субфебрилитет неясного генеза (26%), лихорадка неясного генеза (34%), ОРВИ (13%), постинфекционный субфебрилитет (7%), термоневроз (14,4%), реконвалесцент инфекционного мононуклеоза (2%), иммунодефицитное состояние (2%), пиелонефрит (0,8%), остеомиелит (0,8%).
Из них 43 (34%) ребенка были в возрасте от 6 мес. до 3 лет, 34 (27%) – от 3 до 7 лет, 19 (15%) – от 7 до 10 лет и 31 (24%) – от 10 до 15 лет. Мальчиков было 84 (66%), девочек – 43 (34%).
У 36 (29%) детей длительность субфебрилитета была от 2 нед. до 3 мес. (I группа), у 38 (30%) – от 3 до 6 мес. (II группа), у 22 (17%) – от 6 мес. до 1 года (III группа), у 31 (24%) – более года (IV группа).
Заболеваемость зимой и весной была приблизительно одинаковой. Летом отмечался спад, а осенью – подъем заболеваемости.
Обследование больных носило комплексный характер и включало клинический осмотр, лабораторные исследования (общий анализ крови, мочи, биохимический анализ крови); по показаниям выполнялся комплекс серологических исследований (методом иммуноферментного анализа – ИФА) на микоплазменную, хламидийную, пневмоцистную, токсоплазменную инфекцию, боррелиоз, бартонеллез, бруцеллез, описторхоз и токсокароз, респираторные вирусы (аденовирус, РС-вирус); РПГА с иерсиниозным и псевдотуберкулезным, сальмонеллезным и дизентерийным диагностикумами. Проводилось бактериологическое исследование мазков из рото- и носоглотки, мочи, кала, а также инструментальные исследования (электроэнцефалография, эхоэнцефалография, реоэнцефалография, эхокардиография, электрокардиография, фиброгастродуоденоскопия, ультразвуковое исследование внутренних органов). У всех больных оценивалась проба Манту, по результатам которой больные были проконсультированы фтизиатром.
Для решения поставленной задачи сыворотки крови подвергали тестированию на маркеры вируса простого герпеса 1-го и 2-го типа, вируса Эпштейна-Барр (ЭБВ), цитомегаловируса (ЦМВ), вируса герпеса человека 6-го типа (ВГЧ-6). Методом ИФА определяли специфические антитела классов IgM и IgG, методом полимеразной цепной реакции (ПЦР) – ДНК герпесвирусов в крови, слюне, моче. Для обнаружения антигенов герпесвирусов в лейкоцитарных клетках ставилась непрямая реакция иммунофлюоресценции (НРИФ). По мнению зарубежных и некоторых отечественных авторов [12–14], нахождение антигенов вирусов в форменных элементах крови можно считать наиболее достоверным показателем активной ГВИ. Кроме того, показано, что нахождение инфекционного агента в ферментных элементах крови может приводить к синтезу эндогенных пирогенов, являющихся ключевыми в формировании синдрома длительного субфебрилитета у детей [6].
Исследования проводили в лаборатории эпидемиологии оппортунистических инфекций НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздрава России. Использовали критерии диагностики ГВИ, принятые для практики на Х конгрессе детских инфекционистов России (Москва, 7–9 декабря 2011 г.). Различали острую ГВИ, при которой обнаруживали антигены герпесвирусов в форменных элементах крови, ДНК герпесвирусов в крови или специфические антитела класса IgM в сыворотке крови; реактивированную ГВИ, при которой в крови, наряду с антигенами, в форменных элементах крови обнаруживали специфические IgG-антитела в высоком диагностическом титре или отмечали рост титра этих антител в 4 и более раз в динамике заболевания; латентную ГВИ, при которой в крови обнаруживали низкие титры специфических антител класса IgG и ДНК в ПЦР в крови, моче, слюне. Отдельно рассматривались моно- и смешанные формы ГВИ.

Критерии диагностики представлены в табл. 1.
Результаты и их обсуждение
У 15 (11,8%) из 127 детей маркеры ГВИ не были обнаружены. Эти дети имели следующие диагнозы: гипоталамический синдром – 5 человек; аутоиммунный тиреоидит – 1; гипотиреоз – 1; паразитарные инвазии (лямблиоз) – 2; тубинфицированность – 2; ОРВИ, ассоциированнные с хламидийной, микоплазменной и пневмоцистной инфекцией – 4. Поскольку у этих детей маркеры герпесвирусов не обнаруживались в различных сочетаниях, диагноз ГВИ исключался и они были исключены при дальнейшем анализе клинических проявлений.
У 112 (88,2%) из 127 детей с длительным субфебрилитетом была установлена ГВИ. По совокупности клинико-лабораторных данных у 7 (6,3%) детей была острая, у 34 (30,4%) – реактивированная, у остальных 71 (63,3%) – латентная форма ГВИ.
Среди 7 детей с острой ГВИ у 1 ребенка диагностирована ЦМВ-инфекция, подтвержденная обнаружением генома вируса в лейкоцитах крови и наличием специфических антител классов IgM и IgG; еще у 1 ребенка была ЭБВ-инфекция, подтвержденная наличием ДНК ЭБВ в крови и обнаружением антигенов в лейкоцитах крови и специфических антител EA EBV IgG, VCA IgM; у 5 детей была смешанная инфекция ЭБВ + ЦМВ на основании обнаружения ДНК ЦМВ (у 3) и антигенов ЦМВ в лейкоцитах крови (у 2), ЦМВ IgМ (у 5), ЦМВ IgG (у 4), превышающие диагностический уровень в 2–3 раза, ДНК ЭБВ (у 4) и антигенов ЭБВ (у 1), анти-VCA EBV IgM (у 5), анти-VCA EBV IgG (у 4), анти-EA EBV IgG (у 1).
Из анамнеза заболеваний было известно, что у всех этих детей развитию синдрома длительного субфебрилитета предшествовала ОРВИ, в том числе с осложнениями: обструктивный бронхит – у 2, пневмония – у 1, афтозный стоматит – у 1, гингивит – у 1, появление пятнисто-папулезной сыпи – у 2, отек Квинке – у 1, интерстициальный поствирусный нефрит – у 1. В этом случае не наступало полного выздоровления от респираторной инфекции, сохранялся субфебрилитет 37,4–37,8 0С в течение 22–38 дней, а затем состояние ребенка вновь ухудшалось, появлялась фебрильная лихорадка, симптомы интоксикации и клиника вышеописанных осложнений, что и служило поводом для госпитализации. Ранние симптомы заболевания у всех детей характеризовались адинамией, снижением аппетита, повышением температуры тела до субфебрильных цифр, у этой группы больных регистрировался высокий субфебрилитет (37,6–38 0С), с преимущественно вечерними подъемами температуры (у 6 детей). У одного ребенка повышение температуры в ночное время до 38–39 0С сопровождалась заложенностью носа без отделяемого из носовых ходов. У всех больных регистрировались умеренно выраженные катаральные явления верхних дыхательных путей: скудное отделяемое из носа, умеренная разлитая гиперемия слизистой оболочки ротоглотки, продуктивный кашель продолжительностью от 4 до 25 дней, увеличение лимфоузлов (преимущественно шейной группы). У одного ребенка отмечалось изолированное увеличение шейного лимфоузла слева до 2,5 × 1,5 см, затруднение носового дыхания; появление пятнисто-папулезной сыпи (у 2), афтозного стоматита (у 2), болей в коленном суставе (у 1). У 3 детей наблюдалось пальпаторное увеличение печени до 3 см из-под края реберной дуги, у 1 ребенка – гепатомегалия до 7 см, у 4 детей – увеличение селезенки до 1,5–4 см из-под реберного края. При исследовании биохимического анализа крови у 3 детей отмечено повышение АЛТ до 279 МЕ/л и АСТ – до 105 МЕ/л.
При исследовании периферической крови у 4 детей отмечались лейкоцитоз 13–18,5 × 109, увеличение СОЭ до 30–35 мм. рт. ст.; у 2 – атипичные мононуклеары до 8–10%; лимфоцитоз и моноцитоз отмечены у 3 детей. На момент госпитализации у 5 детей субфебрилитет длился 4–5 нед., у 2 детей – 2 мес. Таким образом, по совокупности клинических и лабораторных данных были все основания думать, что у всех этих детей длительный субфебрилитет связан с герпетической инфекцией, протекающей в форме активного лимфопролиферативного процесса.
Реактивированная ГВИ была у 34 (26,7%) детей, у 5 из них – ЭБВ-инфекция. В крови у этих больных выявлялись IgG VCA и IgG EBNA в титрах, превышающих диагностические в 4–12 раз, из них ДНК ЭБВ в крови, слюне и моче – у 2 детей, детекции антигенов в лейкоцитах – у 3. У 2 из 34 пациентов была реактивированная ЦМВ-инфекция, подтвержденная выявлением генома вируса в крови у одного и выявлением антигена в лейкоцитах крови – у второго, наряду с обнаружением IgG, превышающего диагностический титр в 8 раз. Реактивированная ВГЧ-6 была у 1 ребенка, что подтверждалось выявлением генома вируса в крови и слюне, наряду с IgG, превышающим диагностический уровень в 5 раз. У 26 из 34 детей были смешанные формы ГВИ, в том числе у 12 – вызванные ЭБВ + ЦМВ, у 6 – ЦМВ + ВГЧ-6, у 3 – ЭБВ + ВГЧ-6, еще у 3 детей – ЦМВ + ЭБВ + ВГЧ-6, у 2 – ЭБВ + ВПГ.
У детей с реактивированной ГВИ отмечалась вариабельность клинических проявлений: наряду с длительным субфебрилитетом, слабостью, потливостью, головокружением, эмоциональной лабильностью гипотрофия I–II степени отмечалась у 12% больных, отставание в нервно-психическом развитии на 1–2 эпикризных срока – у 15%, тимомегалия (по данным УЗИ) – у 20%, лимфаденопатия – у 76%, хронический тонзиллит – у 67%, ангина – у 23,5%, длительная гепатоспленомегалия – у 41%, проявления атопического дерматита – у 32%, поллиноза – у 29%, бронхиальная астма – у 6%, гастроэнтеропатия с дисбактериозом – у 24%, тубинфицирование – у 14%, боли в суставах – у 11,7%. На фоне острых ОРВИ у 67% детей развился бронхообструктивный синдром, у 14% – отит, у 14% – гингивостоматит, у 14,7% – коньюктивит.
При анализе гемограммы анемия I степени отмечена у 17,6% детей, нейтропения до 600–700 тыс./мкл – у 14,7%, лимфоцитоз до 72–82% – у 32,3%; умеренное ускорение СОЭ (20–27 мм/ч), атипичные мононуклеары отсутствовали. У 4 (12%) детей были обнаружены плазматические клетки, у 3 (9%) детей отмечено повышение АЛТ до 270–292 МЕ/л и АСТ – до 105–117 МЕ/л.
Длительность субфебрилитета у 7 (20%) детей составила от 3 до 6 мес., у 16 (47%) – от 6 мес. до 1 года, у 11 (32%) – от 1 года до 3 лет.
Таким образом, по совокупности объективных данных, можно считать причиной длительного субфебрилитета ГВИ, протекающую по варианту реактивированной инфекции. Наиболее типичными клиническими симптомами в этих случаях явились сочетание астено-вегетативного синдрома с лимфаденопатией (76%), тонзиллитом (67%), заложенностью носа (44%), дерматитом (32%), бронхообструктивным синдромом (67%), гепатоспленомегалией (41%), болями в животе (32,3%).
Латентное течение ГВИ было у 71 (63%) ребенка. Диагноз ставили на основании обнаружения специфических антител класса IgG в низких диагностических титрах, из них у 25 человек (обследовано 46 детей) – в сочетании с детекцией антигена в лейкоцитах крови и у 3 – в сочетании с наличием ДНК вируса в моче и слюне; у 1 ребенка выявлена только ДНК ЦМВ в крови без серологического ответа. У детей этой группы, также как и у детей с реактивированной инфекцией, отмечались частые ОРВИ с бактериальными осложнениями: ангиной (37% детей), отитом (19%), пневмонией (75%) и гайморитом (5%). Наряду с этим отмечались изменения со стороны ЦНС: у детей старшего возраста – астеноневротический синдром (31%), гипоталамический синдром (13%), субдепрессивный синдром (11%), диссомнические расстройства (6%), термоневроз (3%); у 3 детей в возрасте до 3 лет – фебрильные судороги. Были диагностированы гастроэнтерологическая патология [язва желудка (3%), дискинезия желчевыводящих путей (29%), реактивный панкреатит (31%), миокардиодистрофия (15%)], аутоиммунные заболевания [панникулит (у 1 ребенка), аортоартериит Такаясу (у 1), ювенильный ревматоидный артрит (у 1)], гистиоцитоз (у 1), а также инфекции [грипп А (у 4детей), парагрипп в сочетании с микоплазмозом (у 2), хламидиоз (у 3), пневмоцистная инфекция (у 6), хронический токсоплазмоз (у 2), лямблиоз (у 4)].
Изучение этиологической структуры активной ГВИ у 41 пациента (7 – с острой и 34 – с реактивированной формой) с длительным субфебрилитетом позволило установить, что она в 3,5 раза чаще встречается при микст-вариантах, чем при моноинфекции – у 32 (78%) и 9 (22%) детей соответственно.
Наиболее частыми этиологическими факторами при смешанной инфекции (п = 41) были ЦМВ И ЭБВ, маркеры которых встречались более чем у половины детей – у 24 (58,4%) и 22 (53,6%) соответственно.
У 17 (41,5 %) детей были выявлены маркеры ВГЧ-6 в разных сочетаниях. Реже всего встречались маркеры ВПГ 1-го и 2-го типа – в 8 (19,5%) случаях. В группе больных с моноинфекцией (п = 9) преобладали дети с маркерами активной ЦМВ-инфекции – 5 (55%). Активная ЭБВ-инфекция определялась у 3 из 9 детей, а ВГЧ-6-инфекция зарегистрирована только у 1 ребенка.
В литературе в качестве этиологического фактора синдрома длительного субфебрилитета чаще всего упоминается один возбудитель. Полученные нами данные детекции смешанной ГВИ показывают большой (78%) удельный вес сочетания различных герпесвирусов у детей с синдромом длительного субфебрилитета.
При наблюдении за детьми с синдромом субфебрилитета отмечено, что с длительностью течения субфебрилитета увеличивается число часто болеющих детей (с 17% в I группе до 56% в IV группе), детей с гастроэнтерологической патологией (с 12 до 56% соответственно) и патологией сердечно-сосудистой системы (с 6 до 47% соответственно). Число детей с патологией нервной системы (цереброастенический, гипоталамический, астеновегетативный синдром) также значимо возросло – с 6 до 96% соответственно. Эти изменения регистрировались наряду с увеличением частоты обнаружения антигенов герпесвирусов в лимфоцитах крови: с 24% в I группе до 66% – в IV, с максимальным подъемом (75%) у детей III группы (длительность субфебрилитета – от 6 мес. до 1 года).
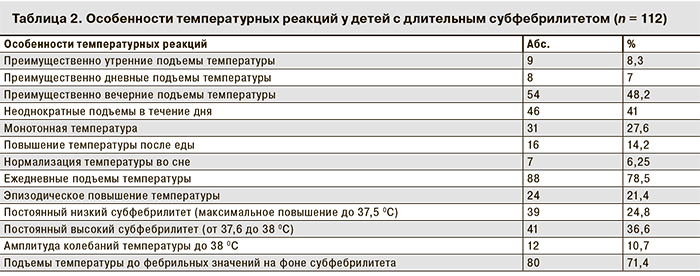
При оценке температурных кривых у детей с длительным субфебрилитетом и различными клиническими вариантами ГВИ не отмечено закономерных колебаний, позволяющих судить о генезе длительного повышения температуры тела (табл. 2).
Таким образом, у детей с острой ГВИ на фоне антигенной нагрузки срабатывает система иммунной адаптации, что выражается в более кратковременном течении субфебрилитета (у всех детей длительность его не превышала 2 мес.). У больных наблюдалась клиническая картина мононуклеозоподобного синдрома и реактивные изменения в гемограмме.
Реактивированная ГВИ протекала на фоне сниженной иммунологической активности, о чем свидетельствует наличие в этой группе большого числа часто болеющих детей (26 человек), детей с отягощенным преморбидным состоянием (задержкой психомоторного развития, гипотрофией I–II степени), различной соматической патологией, более длительным течением субфебрилитета, преимущественным течением заболевания по типу микст-инфекции (27 детей).
Полученные данные могут быть использованы не только для обоснования противовирусной, этиотропной терапии, но, в сочетании с клинико-анамнестическими данными, и в качестве диагностических критериев.
Таким образом, клинический синдром длительного субфебрилитета следует считать одним из симптомов инфекционного заболевания, протекающего в форме латентно-персистирующего, реже – активного процесса.
Среди 127 больных детей с длительным субфебрилитетом, обследованных на вирусы семейства герпесов, у 6,3% была установлена острая ГВИ, у 30,4% – хроническая ГВИ в стадии реактивации и у 63,3% –латентные формы в виде моно- или микст-инфекции.
Клиническими симптомами активной ГВИ у детей с длительным субфебрилитетом являются увеличение лимфоузлов (76% случаев), тонзиллит (67%), осложненное течение ОРВИ (67%), умеренная гепатомегалия (48%), спленомегалия (10%), высыпания на коже (34%). Реже встречаются афтозный стоматит, гломерулонефрит, пневмония, гастроинтерстицинальные расстройства.
В этиологической структуре активной ГВИ при длительном субфебрилитете у детей преобладают смешанные формы (78%), среди которых лидируют сочетания ЦМВ + ЭБВ (20,6%) и ЦМВ + ВГЧ-6 (15,5%); моноварианты ГВИ встречаются в 22 % случаев.
У больных с длительным субфебрилитетом при активной ГВИ патогенетически обоснованным является лечение этиотропными и иммунокоррегирующими препаратами.


