Среди арбовирусных инфекций в Ставропольском крае широкое распространение получила Крымская геморрагическая лихорадка (КГЛ), случаи заболевания которой ежегодно регистрируются на территории Южного и Северо-Кавказского федеральных округов Российской Федерации [1, 2]. Помимо вируса Крымской-Конго геморрагической лихорадки (ККГЛ), на территории края происходит активная циркуляция и других арбовирусов; в наших исследованиях в частности были обнаружены вирусы Западного Нила, клещевого энцефалита, вирусы серогруппы калифорнийского энцефалита (Тягиня, Инко) и вирус Батаи [3].
Одним из аспектов повышения эффективности эпидемиологического надзора за арбовирусными инфекциями является оптимизация эпидемиологического мониторинга. Получаемая в ходе мониторинга информация должна обеспечить возможность проведения оперативной динамической оценки состояния и тенденции развития эпидемического и эпизоотического процессов, а также ретроспективного эпидемиологического анализа [4–6]. В соответствии с этими задачами эпидемиологический мониторинг арбовирусных инфекционных болезней должен включать несколько уровней сбора информации: о состоянии заболеваемости, о циркуляции возбудителей среди основных носителей и переносчиков, о состоянии уровня коллективного иммунитета к арбовирусам среди людей и животных [7].
В различных административных районах такие показатели, как заболеваемость населения и активность циркуляции возбудителей среди носителей и переносчиков, варьируют. Задачей данного исследования было эпидемиологическое районирование территории края по степени риска инфицирования вирусом ККГЛ с учетом приуроченности районов к определенным ландшафтно-географическим зонам.
Материалы и методы
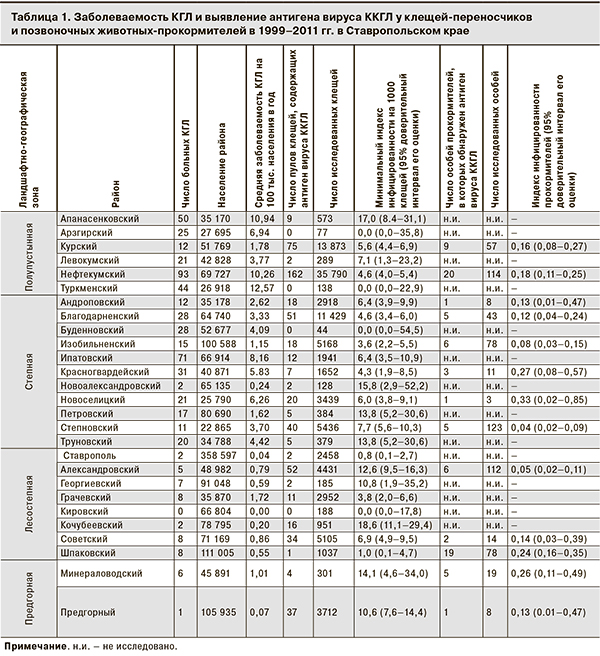
Эпидемиологическое районирование территории Ставропольского края основано на материалах, полученных за 13 лет (с 1999 по 2011 г.) изучения природного очага КГЛ Ставропольским противочумным институтом Роспотребнадзора [1–3, 8]. Проанализирована эпидемическая обстановка в 26 районах края и в Ставрополе (табл. 1). Заболеваемость КГЛ регистрировалась во всех районах, за исключением Кировского. В ходе исследования 104 978 иксодовых клещей-переносчиков ККГЛ, объединенных в 10 677 пулов, найдено 585 ККГЛ-положительных пулов. В 13 районах края проведен также отлов мелких млекопитающих (грызунов) – прокормителей иксодовых клещей. Антиген вируса ККГЛ был обнаружен у 83 из 668 исследованных особей. Клещ или позвоночное животное считалось инфицированным, если в его тканях обнаруживали антиген вируса ККГЛ методом ИФА.
Использовано 3 основных типа показателей: средняя заболеваемость КГЛ на 100 тыс. населения в год, минимальный индекс инфицированности (МИИ) на 1000 клещей-переносчиков, индекс инфицированности (ИИ) прокормителей. При расчете показателя заболеваемости для Предгорного, Минераловодского, Буденновского, Георгиевского и Кочубеевского районов не учитывалось население крупных городов (Пятигорск, Кисловодск, Ессентуки, Железноводск, Лермонтов, Минеральные Воды, Буденновск, Георгиевск, Невинномысск), поскольку заболеваемость КГЛ среди городского населения была пренебрежимо мала.
Величины МИИ, ИИ и 95% доверительный интервал их значений высчитывали с помощью надстройки PooledInfRate, version 4.0 для программы Excel, размещенной в открытом доступе на сайте CDC http://www.cdc.gov/ncidod/dvbid/westnile/software.htm [9]. Использовали наиболее точный и эффективный метод максимального правдоподобия с коррекцией искажений и скорректированной оценкой 95% доверительного интервала (the bias-corrected MLE with 95% corrected score interval). При необходимости достоверность различия показателей МИИ и ИИ в разных районах оценивали также с помощью PooledInfRate [10].
Все статистические расчеты и оценки проведены с помощью лицензионной программы IBM SPSS Statistics 19 [11].
 Для классификации районов по кластерам со сходными значениями показателей использовали иерархическую кластеризацию методом межгрупповых связей с использованием в качестве меры евклидова квадрата расстояний без стандартизации и со стандартизацией по z-значениям.
Для классификации районов по кластерам со сходными значениями показателей использовали иерархическую кластеризацию методом межгрупповых связей с использованием в качестве меры евклидова квадрата расстояний без стандартизации и со стандартизацией по z-значениям.
Для формулировки алгоритма отнесения районов в уже сформированные группы низкого, пониженного, повышенного и высокого риска применяли подпрограмму «дерева решений» (decision trees). При этом: использовали метод построения деревьев CHAID (Chi-squared Automatic Interaction Detection, автоматическое определения связи с помощью критерия χ2); все категории (группы риска), в которые относили объекты классификации (районы), считали одинаково важными; дальнейшее разветвление дерева из вершины (node) или слияние категорий считались допустимыми, если их можно было провести с достоверностью p < 0,05; проводили кросс-валидацию построенного дерева на 25 выборках из исходного массива данных. Для контроля использовали также метод построения деревьев CRT (Classification and Regression Trees, деревья классификации и регрессии).
Для анализа типов растительности в Ставропольском крае были использованы данные спутникового мониторинга [12]. Метод позволяет различать 21 тип поверхности земли. Из этих типов в Ставропольском крае были представлены 7 (в порядке убывания площади): пахотные земли – 55,3%; луга (в эту категорию объединены луга и степи в лесостепной зоне) – 22,7%; степи (в эту категорию объединены «сухие степи», достаточно близкие к полупустыням, и полупустыни) – 16,1%; каменистые почвы с минимумом растительности – 4,7%; лиственные леса – 0,6%; городская застройка – 0,3%; водная поверхность – 0,3%.
Сопоставление количественных независимых переменных проводили с помощью непараметрического критерия Манна–Уитни (для 2 переменных) и критерия Крускала–Уоллиса (для 3 и более переменных), качественных переменных – с помощью критерия χ2; для оценки корреляций использовали непараметрический коэффициент Спирмена [13].
Результаты
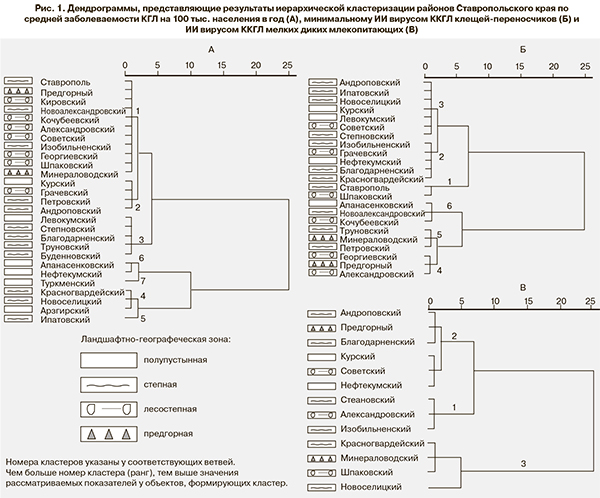
По показателю заболеваемости КГЛ множество районов края можно разбить на 7 кластеров (рис. 1, А). Кластерам присвоен номер (ранг), указанный в табл. 2. Чем выше ранг кластера, тем выше значения заболеваемости в районах, входящих в кластер. Аналогичным образом по минимальному индексу инфицированности клещей множество районов можно разбить на 6 кластеров (рис. 1, Б), присвоив им номер (ранг), указанный в табл. 2. В районах, в которых антиген вируса ККГЛ в клещах не был обнаружен, было собрано и исследовано недостаточное (от 50 до 200 особей) количество клещей (см. табл. 1), вследствие чего нулевое значение МИИ является недостоверным (95% доверительный интервал от 0 до 20–50). Поэтому таким районам ранг присвоен по среднему МИИ для ландшафтно-географической зоны (выделены курсивом в табл. 2).
По индексу инфицированности мелких животных 13 районов, в которых этот показатель был известен, формально говоря, можно разбить на 5 кластеров (рис. 1, В). Однако ошибка определения данного показателя во многих районах достаточно высока (см. табл. 1). Чтобы уменьшить влияние этой ошибки на результат, мы ограничились выделением трёх основных кластеров с рангом от 1 до 3. Как и для клещей, районам, в которых наличие антигена вируса ККГЛ в прокормителях не было исследовано, ранг присвоен по среднему для ландшафтно-географической зоны (выделено курсивом). Мы испытали также вариант, в котором таким районам ранг был присвоен в соответствии с известными рангами соседних районов, но не получили статистически значимо отличных результатов.
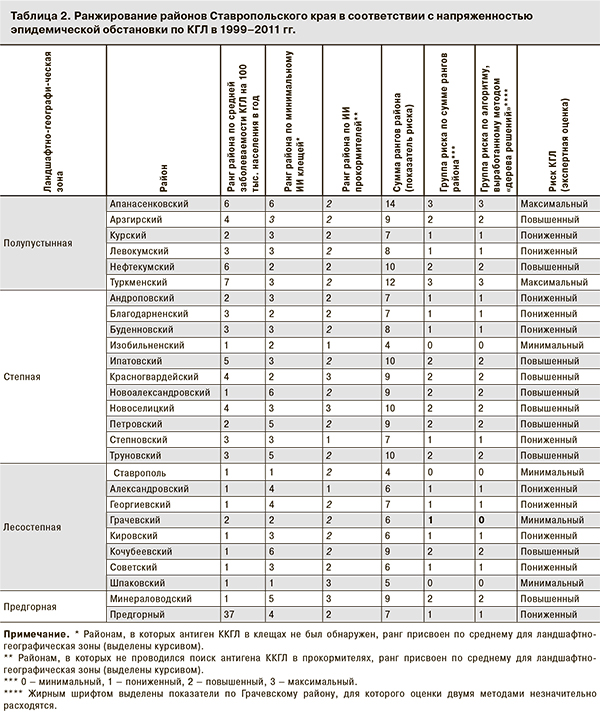
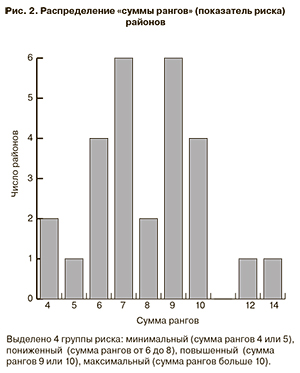
Для интегральной сравнительной оценки эпидемической ситуации по КГЛ по районам мы применили простейший непараметрический метод суммирования ранга районов по трем показателям и трем результатам кластеризации. Суммарный ранг районов как показатель риска приведен в табл. 2, а его распределение – на рис. 2. Теоретически суммарный ранг может варьировать от 3 (1+1+1) до 16 (7+6+3), но реально находится в диапазоне от 4 до 14. Поскольку распределение имеет явный минимум в середине (сумма рангов = 8) и небольшие подъемы по краям, представляется естественным выделить 4 группы риска: минимальный (сумма рангов 4 или 5), максимальный (сумма рангов больше 10), повышенный (сумма рангов 9 или 10) и пониженный (сумма рангов от 6 до 8). При этом отнесение соседних Левокумского и Буденновского районов (сумма рангов = 8) к группе пониженного риска носит условный характер, поскольку их можно было присоединить и к группе повышенного риска.
В ряде случаев метод «дерева решений» позволяет на основании уже проведенной классификации объектов сформулировать более очевидный алгоритм их классификации. Применив метод CHAID, мы получаем следующие логические правила для концевых вершин (terminal nodes) дерева (рис. 3, см. на вклейке):
- если заболеваемость КГЛ выше 10,5 случая на 100 тыс. населения в год, район относится к группе максимального риска по КГЛ;
- если заболеваемость КГЛ ниже или равна 10,5, но выше 4,1 случая на 100 тыс., то район относится к группе повышенного риска по КГЛ;
- если заболеваемость КГЛ ниже или равна 4,1 на 100 тыс., а МИИ на 1000 клещей выше 12,7, то район относится к группе повышенного риска по КГЛ;
- если заболеваемость КГЛ ниже или равна 4,1 на 100 тыс., а МИИ ниже или равен 12,7, но выше 4,0, то район относится к группе пониженного риска по КГЛ;
- если заболеваемость КГЛ ниже или равна 4,1 на 100 тыс., а МИИ ниже или равен 4,0, то район относится к группе минимального риска по КГЛ.
При этом расщепление дерева именно на эти 5 вершин характеризуется высокой значимостью (p < 0,001) и не требует привлечения (отклоняет его на основании статистических критериев) показателя ИИ прокормителей.
Имел место только 1 случай расхождения классификаций: по сумме рангов Грачевский район отнесен к группе пониженного риска (с суммой рангов 6, минимально возможной в этой группе), в то время как «дерево решений» включает его в группу минимального риска (см. табл. 2). Это расхождение можно объяснить двумя обстоятельствами. Во-первых, истинная зараженность прокормителей в Грачевском районе не была исследована. Если она минимальна, как в соседнем Александровском районе, Грачевский район переходит в группу с минимальной оценкой риска с помощью суммы рангов. Во-вторых, в «центральном» Грачевском районе, недалеко от Ставрополя, предположительно успешнее проводится выявление и диагностика случаев КГЛ и энтомологические исследования клещей. Возможно, показатели заболеваемости КГЛ и МИИ клещей в Грачевском районе ближе к реальным, а на более отдаленных территориях они отчасти занижены. Впрочем, метод CRT дает 100% совпадение с определением риска по сумме рангов: проводя тонкое различие между Изобильненским (МИИ = 3,6) и Грачевским (МИИ = 3,8) районами, он позволяет не включать последний в группу минимального риска. Однако мы считаем это проявлением свойства «слишком хорошей классификации» (overfitting), присущего методу CRT. В реальности доверительные диапазоны для МИИ в Изобильненском и Грачевском районах практически одинаковы.
Исходя из вышеизложенного, мы сочли допустимым на рис. 3 отнести Грачевский район к группе минимального риска. В результате по сумме рангов в группы минимального, пониженного, повышенного и максимального риска включено 4, 11, 10 и 2 района соответственно.
Примечательно, что активность энтомологических исследований различалась в районах с разной степенью риска. Так, в районах, включенных нами в группы повышенного и пониженного риска, было собрано и исследовано в среднем соответственно по 4500 и 4300 клещей на район. В районах из группы минимального риска этот показатель был ниже (2900 клещей на район), а в двух районах максимального риска было исследовано всего 711 клещей. Сходным образом обстояло дело с исследованиями мелких млекопитающих. В группах минимального, повышенного и пониженного риска были отловлены и исследованы в среднем соответственно по 39, 33 и 15 особей на район. В районах максимального риска отлов не производился.
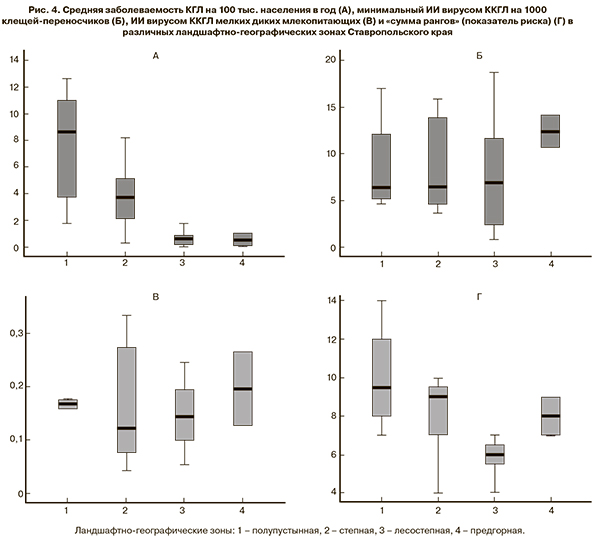
Очевидно, что значения показателей заболеваемости и МИИ клещей в районах градуально возрастают по мере повышения риска (p < 0,05 по критерию Крускала–Уоллиса). Интереснее, как эти показатели соотносятся в разных ландшафтно-географических зонах (рис. 4). Характеристики районов предгорной зоны трудно описать достоверно, поскольку таких районов только 2. В ряду «лесостепная – степная – полупустынная зона» заболеваемость КГЛ явно и статистически значимо возрастает (p = 0,001 по критерию Крускала–Уоллиса). Показатели МИИ и ИИ существенно варьируют в каждой из ландшафтно-географических зон, их средние значения не различаются для разных зон (p > 0,6 по критерию Крускала–Уоллиса). Несмотря на это интегральная оценка риска (сумма рангов) также значимо нарастает в ряду «лесостепная – степная – полупустынная зона» (p = 0,007).
В районах Ставропольского края от 91 до 98% площади занято тремя типами растительности – пахотными землями, «лугами» и «сухими степями». «Луга» занимают в полупустынной, степной, лесостепной и предгорной зонах в среднем (медиана) 16% (диапазон – от 8 до 36%), 12% (от 10 до 33%), 34% (от 17 до 61%) и 54% (от 45 до 62%) соответственно. Напротив, доля «сухих степей» падает в ряду «полупустынная – степная – лесостепная – предгорная зона»: соответственно 33% (от 3 до 62%), 5% (от 0,2 до 27%), 1% (от 0 до 12%) и 0,2% (от 0 до 0,4%). Пахотными угодьями заняты приблизительно равные площади во всех ландшафтно-географических зонах: в полупустынной, степной, лесостепной и предгорной зонах соответственно 47% (от 19 до 69%), 69% (от 55 до 85%), 61% (от 29 до 77%) и 39% (от 31 до 48%).
Заболеваемость КГЛ статистически значимо возрастает по мере уменьшения доли «лугов» (коэффициент корреляции Спирмена -0,67; p < 0,001) и увеличения доли «сухих степей» (коэффициент корреляции 0,71; p < 0,001). Эти зависимости сохраняются при отдельном анализе по районам, включенным в группу пониженного риска: коэффициент корреляции с долей «лугов» равен -0,74 (p = 0,01), а с долей степей – 0,64 (p = 0,04). В группах повышенного и минимального риска статистически значим только рост заболеваемости КГЛ по мере увеличения доли «сухих степей»: соответствующие коэффициенты корреляции равны 0,84 (p = 0,002) и 1,0 (p = 0,01). Значимой корреляционной связи МИИ и ИИ с преобладающими в районе типами растительности не обнаружено.
Обсуждение
В результате проведенного районирования выделено 4 группы районов Ставропольского края с различной степенью риска инфицирования возбудителем КГЛ (см. табл. 2; рис. 5, на вклейке).
Два района – Апанасенковский и Туркменский – из полупустынной зоны на севере края образуют группу максимального риска. В группу повышенного риска вошли 10 районов: Арзгирский и Нефтекумский – из полупустынной зоны, Ипатовский, Красногвардейский, Новоалександровский, Новоселицкий, Петровский и Труновский – из степной зоны, а также Кочубеевский – из лесостепной зоны и Минераловодский – из предгорной зоны. При этом заслуживают внимания 4 района (Новоалександровский, Петровский, Кочубеевский и Минераловодский), которые включены в группу повышенного риска на основании высокого уровня инфицированности клещей, несмотря на низкую заболеваемость КГЛ. Это можно трактовать как наличие эпидемического потенциала КГЛ, не реализуемого в силу меньшей доли сельского населения, особенностей его социально-экономической активности или иных причин.
Районы, отнесенные к группе пониженного риска, расположены преимущественно в лесостепной (Александровский, Георгиевский, Кировский и Советский) и степной (Андроповский, Благодарненский, Буденновский и Степновский) зонах. В группу вошли также 2 района (Курский и Левокумский) из полупустынной зоны и Предгорный район. Большинство районов с минимальным риском (Грачевский и Шпаковский районы и Ставрополь) находятся в лесостепной зоне, за исключением Изобильненского района из степной зоны.
Связь активных очагов КГЛ с полупустынной и степной зонами подтверждается и тем, что заболеваемость КГЛ в районах в сильной степени коррелирует с тем, какую долю площади в нем занимают «сухие степи».
Вариабельность показателя заболеваемости среди районов со сходным типом растительности может быть связана с тем, что, по мнению отечественных и зарубежные специалистов, для очагов КГЛ, кроме типа растительности, характерен так называемый «фрагментированный, саванно-подобный» тип ландшафта (смесь пастбищ, степей и кустарников), являющийся оптимальным для развития клещей-переносчиков вида Hyalomma marginatum [2, 14, 15]. Степень фрагментации ландшафта в Ставропольском крае нами рассмотрена не была.
Выше напряженность эпидемической обстановки по КГЛ оценивалась нами с опорой на относительные показатели заболеваемости и МИИ, и это методически правильно. Однако необходимо учитывать также районы, в которых зарегистрировано наибольшее количество клинических случаев КГЛ. Кроме Апанасенковского и Туркменского районов (50 и 44 случая), это (в порядке убывания) Нефтекумский, Ипатовский, Красногвардейский, Благодарненский, Буденновский и Арзгирский районы (по 93, 71, 31, 28, 28 и 25 случаев КГЛ соответственно). С социально-экономической точки зрения противоэпидемические и профилактические мероприятия в этих районах могут оказаться в настоящее время более эффективными, чем в районах с меньшим числом больных КГЛ.
Резко ухудшившаяся в XXI столетии эпидемическая обстановка по КГЛ, появление новых и расширение площади старых очагов этой жизнеугрожающей вирусной инфекции, по отношению к которой не существует ни общепризнанных средств этиотропной терапии, ни препаратов для специфической вакцинопрофилактики, требует усиления борьбы с ней эпидемиологическими методами [2, 16–18]. Предложенная нами методика районирования отличается от использованной ранее [19] тем, что: 1) основана на данных не 4-, а 13-летних наблюдений; 2) рассматривает не только заболеваемость КГЛ, но и инфицированность переносчиков и их прокормителей; 3) опирается на современные методы иерархической кластеризации и «дерева решений», позволяющие формализовать алгоритмы ранжирования и интегральной оценки риска. Важным является и то, что данная методика позволяет оптимизировать эпидемиологический надзор за КГЛ и борьбу с этой инфекцией.
В районах максимального и повышенного риска нет необходимости доказывать активность природных очагов КГЛ. Мероприятия должны быть в первую очередь направлены на улучшение лабораторной диагностики, лечения и профилактики клинических случаев КГЛ. Энтомологический мониторинг может быть использован для прогнозирования развития эпидемической ситуации в наступающем году и для оценки эффективности акарицидных обработок. При этом следует учитывать, что более-менее достоверные оценки МИИ получаются при исследовании не менее 1000 клещей (см. табл. 1). Районы, отнесенные к группе пониженного риска, являются в некотором смысле наиболее проблемной областью, поскольку в них возможно неожиданное ухудшение эпидемической ситуации. Именно в них должен проводиться и в реальности проводится эпидемиологический и эпизоотологический мониторинг в полном объеме. В районах минимального риска, а также в регионах юга России, где заболеваемость КГЛ к настоящему времени не выявлена, необходимо проводить серологический мониторинг населения, исследовать материал от больных с подозрением на КГЛ и проводить разведочные энтомологические и эпизоотологические исследования с целью оценки активности потенциальных природных очагов КГЛ. Такие исследования должны в первую очередь проводиться в зонах с фрагментированным полупустынным и степным ландшафтом. Необходимо понимать, что при реально низких или нулевых показателях МИИ и ИИ «находки» антигена вируса ККГЛ серологическим методом будут в большом проценте случаев ложноположительными результатами и должны быть обязательно проверены и подтверждены более специфическим методом ПЦР.
Использованная методология оценки риска по КГЛ обладает потенциалом развития. В настоящее время технологии геоинформационных систем и методы математико-картографического анализа все шире применяются для выявления регионов риска по природно-очаговым инфекциям [20–22]. С учетом необходимости своевременного анализа и прогноза эпидемической ситуации на больших территориях привлекаются методы дистанционного спутникового мониторинга и потокового анализа информации [23–27]. В нашей работе также используются данные спутникового мониторинга для характеристики ландшафтно-географических зон [12]. Планируется переход от статического выделения регионов риска по КГЛ к ежедневному динамическому наблюдению с целью выявления и контроля экологических и климатических факторов риска [28]. Не менее важным представляется учет при районировании риска комплекса демографических и экономических показателей, доступности медицинской помощи и т. п. в рамках «многокритериального анализа» [21].
Предложенный нами метод районирования может быть использован и в других регионах для любой другой природно-очаговой инфекции с коррекцией отдельных показателей и их диапазонов, характерных именно для этих инфекций и территорий.