Цитокины являются частью межклеточной системы взаимодействия, ответственной за иммунный ответ. При вирусных инфекциях цитокины играют роль как в элиминации возбудителей, так и в повреждении тканей [1]. Th1-клетки характеризуются способностью к продукции Th1-цитокинов [интерферон-гамма (ИФН-γ), интерлейкин-2 (ИЛ-2), фактор некроза опухоли-альфа (ФНО-α)], в то время как Th2-клетки способны синтезировать Th2-цитокины ИЛ-4 и ИЛ-10 [2].
Вирус гепатита В (HBV), вызывающий острые и хронические некровоспалительные заболевания печени, тем не менее, не обладает прямым цитопатическим действием. Ответственным за элиминацию HBV является преимущественно адаптивный иммунитет, неэффективность которого приводит к хронизации HBV-инфекции и дальнейшему прогрессированию поражения печени [3]. Существуют данные, что Тh1-цитокины могут играть ключевую роль в персистировании HBV-инфекции [4].
Интерфероны получили свое название из-за способности воздействовать на репликацию вирусов [5]. Интерфероны I типа, к которым относится интерферон-альфа (ИФН-α), являются одной из первых линий защиты против вирусных инфекций. ИФН-α обладает выраженной противовирусной активностью. Основными его продуцентами в организме являются активированные вирусами макрофаги (дендритные клетки), гранулоциты и фибробласты [1].
Данные о содержании ИФН-α у больных хроническим гепатитом В (ХГВ) несколько противоречивы. Так, одни авторы указывают на отсутствие значимых отличий у больных с ХГВ по сравнению со здоровыми лицами [6]. Наряду с этим отмечается наличие корреляций между биохимическими обострениями воспалительного процесса в печени и колебаниями уровня ИФН-α [6, 7].
В других исследованиях показано, что у пациентов с ХГВ продукция ИФН-α нарушается [8]. Одним из механизмов, лежащих в основе этих нарушений, является подавление HBsAg продукции ИФН-α дендритными клетками косвенным образом. Предполагаемым механизмом является индукция под воздействием HBsAg секреции в моноцитах ФНО-α и ИЛ-10, которые в свою очередь подавляют экспрессию толл-подобных рецепторов TLR9 в дендритных клетках и в дальнейшем препятствуют продукции ИФН-α этими клетками. Плазмацитоидные дендритные клетки (ПДК) являются основными ИФН-α-продуцирующими клетками. Активация ПДК, приводящих к продукции ИФН-α, имеет большое значение для эффективного противовирусного иммунного ответа против HBV [9].
ИФН-γ – наиболее важный цитокин, отвечающий за клеточный иммунитет [5]. Основными продуцентами ИФН-γ в организме являются активированные CD4+- и CD8+-Т-лимфоциты и NK-клетки. Причем если у ИФН-α наиболее выражена противовирусная активность, то для ИФН-γ характерны иммуномодулирующие свойства на уровне всех фаз иммунного и воспалительного ответов [1].
Количество специфичных Th1-клеток, стимулированных HBcAg, продуцирующих ИФН-γ, заметно увеличивается до развития пика обострения ХГВ, а затем происходит его снижение [10]. Изучение содержания ИФН-γ в сыворотке и супернатанте культивированных мононуклеарных клеток периферической крови после стимуляции различными антигенами HBV (HBsAg ad, HBsAg ay и HBcoreAg) показало более низкие его показатели у больных ХГВ, чем у реконвалесцентов HBV-инфекции и здоровых вакцинированных лиц [11].
HBcAg является структурной частью высокоиммуногенной капсидной оболочки HBV. Установлена способность аргинин-содержащего домена HBcAg взаимодействовать с мембраной макрофагов и таким образом вызывать продукцию ими провоспалительных цитокинов ФНО-α, ИЛ-6 и ИЛ-12p40 [12].
ФНО-α – многофункциональный провоспалительный цитокин, образуемый мононуклеарными клетками периферической крови, в основном моноцитами и макрофагами. ФНО-α принимает участие не только в защитных реакциях, но и в процессах деструкции и репарации, сопутствующих воспалению [13].
В свою очередь продукция цитокинов у больных ХГВ и ХГС определяется степенью активности процесса и морфологическими изменениями в печени: снижение индуцированной продукции ИФН-α наблюдается уже при минимальной активности процесса и незначительных морфологических изменениях в печени, а снижение индуцированной продукции ИФН-γ, ФНО-α и ИЛ-6 выявляется у больных с высокой активностью гепатита и максимально выраженными морфологическими изменениями в печени [14]. Отмечается зависимость концентрации провоспалительных цитокинов от активности воспалительного процесса при ХГВ: повышение уровня ФНО-α и ИЛ-1β в период обострения процесса и снижение их уровня с нормализацией показателей в периоде реконвалесценции [15]. Кроме того, у пациентов с ХГВ и ХГС выявлена значительная корреляция между ФНО-α и степенью выраженности фиброза в печени [16].
Противовоспалительный цитокин ИЛ-4 является производным от базофилов, NK Т-клеток, эозинофилов и тучных клеток. ИЛ-4 способствует дифференцировке наивных Т-лимфоцитов H0 в фенотип Th2. ИЛ-4 также имеет немаловажное значение в поддержании аллергических иммунных реакций. В отличие от провоспалительных цитокинов, он ингибирует антитело-зависимую клеточную цитотоксичность мононуклеарных фагоцитов, подавляет экспрессию их Fcγ-рецепторов и дифференциацию в макрофаги, подавляет продукцию оксида азота, ИЛ-1, ИЛ-6 и ФНО-α, и напротив, стимулирует продукцию ИЛ-1ra и ИЛ-10 [5].
Отмечено, что ИФН-γ и ИЛ-4 ответственны за прогрессирование заболевания при ХГВ [17]. Повышение уровня ИЛ-4 у больных ХГВ происходит только на стадии цирроза печени, когда содержание его в сыворотке крови резко увеличивается [6].
ИЛ-10 относится к цитокинам преимущественно противовоспалительного действия. Он является иммунорегуляторным цитокином с множественными биологическими эффектами на разные типы клеток. Основными продуцентами ИЛ-10 являются регуляторные Т-лимфоциты, моноциты и лимфоциты. Известно, что ИЛ-10 ингибирует продукцию ИФН-γ Тh1-лимфоцитами; ИЛ-4 и ИЛ-5 – Тh2-лимфоцитами; ИЛ-1β, ИЛ-6, CXCL8, ИЛ-12 и ФНО-α – мононуклеарными фагоцитами, а ИФН-γ и ФНО-α – NK-клетками [5].
Выявлена способность HBcAg стимулировать продукцию ИЛ-10 мононуклеарными клетками периферической крови. По мнению исследователей [10], данный факт может способствовать развитию иммунной толерантности к HBV. Кроме того, было установлено более высокое содержание Т-клеток и моноцитов, продуцирующих ИЛ-10, при стимуляции HBcAg у пациентов с повышенным уровнем АЛТ и положительными результатами ДНК HBV, чем у пациентов с нормальным уровнем АЛТ и неопределяемой ДНК HBV [10].
ХГВ и ХГС в последние годы получили широкое распространение среди лиц молодого возраста [18], в том числе среди женщин фертильного возраста и беременных [19]. Роль и значение цитокинов при ХГВ у беременных женщин пока не изучены.
Целью исследования является изучение содержания цитокинов в сыворотке крови у женщин с ХГВ в III триместре беременности и оценка их взаимосвязи с показателями аминотрансфераз и уровнем вирусной нагрузки.
Материалы и методы
Исследование у женщин с ХГВ проводили при сроке беременности 28–36 нед. согласно правилам национального стандарта РФ (ГОСТ Р 52379-2005) «Надлежащая клиническая практика» на основании заключения ЛЭК Сибирского государственного медицинского университета (регистрационный № 1371 от 19.04.2010). В исследование были включены 30 беременных с подтвержденным диагнозом ХГВ в фазе репликации без HBeAg и дельта-инфекции, подписавшие информированное согласие. Контрольную группу составили 34 практически здоровые беременные.
Проводилось выяснение анамнеза заболевания, клинический осмотр, биохимические исследования с определением активности АЛТ и АСТ, УЗИ органов брюшной полости. Определение маркерного спектра проводили методом иммуноферментного анализа (ИФА) с использованием наборов реагентов для диагностики гепатита В ЗАО «Вектор-Бест» (Новосибирск). Выявление ДНК HBV в сыворотке крови осуществляли методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией с использованием набора реагентов «АмплиСенс® HBV-FL» (Москва). Количественное содержание ДНК HBV (вирусная нагрузка) определяли методом ПЦР в режиме реального времени с использованием тестовых систем «ДНК-Технология» (Москва). Определение концентрации цитокинов в сыворотке крови проводили методом ИФА с использованием тестовых систем «Вектор-Бест» (Новосибирск). У женщин при сроке беременности 28–36 нед. определяли концентрации ИФН-α и ИФН-γ, ФНО-α, ИЛ-1ß, ИЛ-4, ИЛ-10.
Статистическую обработку полученных данных проводили с помощью программы PASW Statistics for Windows ® Release 18.0 с использованием непараметрических методов статистики. Количественные показатели обозначали в виде медианы (Me), квартилей Q1 (25% перцентиль) и Q3 (75% перцентиль). Проверка статистической значимости различий проводилась с помощью непараметрического критерия U Манна—Уитни. Анализ взаимосвязей между количественными данными проводился на основании непараметрического коэффициента ранговой корреляции Спирмана. Различие сравниваемых величин считали статистически значимыми при p < 0,05.
Результаты и обсуждение
Средний возраст беременных с ХГВ составил 28,5 ± 0,8 года. Первобеременных было 12 (40%), повторнобеременных – 18 (60%), первородящих – 15 (50%). ХГВ был выявлен впервые во время беременности у 22 (73,3%) женщин.
Клинические проявления у большинства женщин с ХГВ отсутствовали. При УЗИ органов брюшной полости признаков цирроза печени у беременных не было обнаружено. Средний диаметр воротной вены составил 10,56 ± 1,21 мм (от 8,0 до 12,0 мм).
Уровень вирусной нагрузки ДНК HBV у беременных варьировал от 1000 до 4 872 000 копий/мл с Me [Q1; Q3] 185 250 [76 375; 2 098 500] копий/мл.
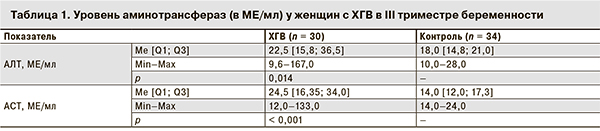
Определение уровня аминотрансфераз показало статистически значимые более высокие значения АЛТ (p = 0,014) и АСТ (p < 0,001) у беременных с ХГВ по сравнению с контрольной группой (табл. 1).
Изучение спектра цитокинов показало низкие концентрации ИФН-α в сыворотке крови как у беременных с ХГВ, так и у женщин контрольной группы (табл. 2). Тем не менее, у большинства беременных с ХГВ содержание ИФН-α в сыворотке крови находилось на нулевом уровне, повышение значений ИФН-α выше порогового уровня (5,0 пг/мл) отмечалось лишь у 5 (16,7%) из 30. Me уровня ИФН-α у беременных с ХГВ была достоверно ниже (см. табл. 2).
Показатели ИФН-γ в сыворотке крови у женщин в III триместре беременности как на фоне ХГВ, так в контрольной группе не превышали пороговых значений (10 пг/мл). При этом имелась тенденция к снижению Me концентрации ИФН-γ у беременных с ХГВ (cм. табл. 2).
Содержание ФНО-α в сыворотке крови у большинства беременных с ХГВ, так же как и у здоровых беременных, было низким и не превышало 5 пг/мл. Незначительное повышение уровня ФНО-α в сыворотке крови отмечалось лишь у 1 беременной с ХГВ. Достоверных отличий концентрации ФНО-α по Me [Q1; Q3] в обеих группах не было выявлено (см. табл. 2).
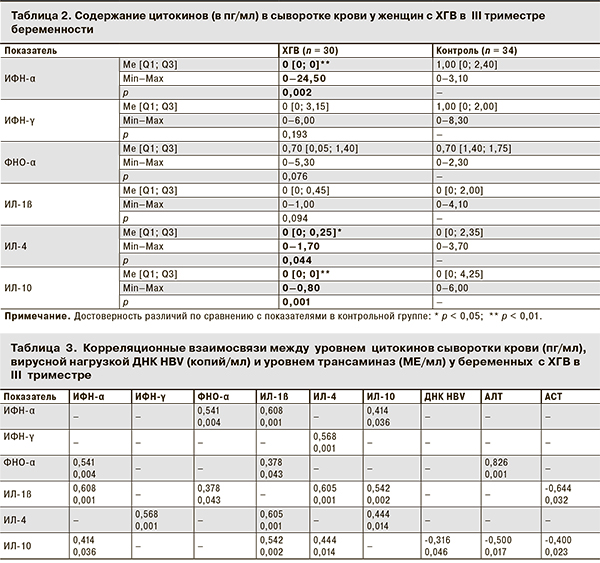
Наряду с этим корреляционный анализ у беременных с ХГВ показал наличие умеренной положительной связи концентрации ФНО-α с содержанием ИФН-α (r = 0,541; p = 0,004;) (табл. 3). Кроме того, была выявлена сильная положительная связь между содержанием ФНО-α в сыворотке крови и уровнем АЛТ (r = 0,826; p = 0,001) (см. табл. 3), что может служить отражением повреждающего действия провоспалительных цитокинов на гепатоциты.
Определение концентрации провоспалительного цитокина ИЛ-1ß в сыворотке крови беременных с ХГВ не выявило статистически значимых отличий при сравнении с показателями в контрольной группе (см. табл. 2). Однако корреляционный анализ показал наличие слабых положительных связей содержания ИЛ-1ß и ФНО-α у беременных с ХГВ (r = 0,378; p = 0,043). Кроме того, у них отмечалась умеренная корреляционная связь концентрации ИЛ-1ß с уровнем ИФН-α (r = 0,608; p = 0,001) и отрицательная связь с уровнем АСТ (r = -0,644; p = 0,032).
Показатели противовоспалительных цитокинов ИЛ-4 и ИЛ-10 в сыворотке крови у беременных с ХГВ варьировали от 0 до 1,70 и от 0 до 0,80 пг/мл соответственно. Сравнительный анализ концентрации ИЛ-4 и ИЛ-10 с аналогичными показателями у здоровых беременных выявил статистически значимое снижение их уровня по Me [Q1; Q3] у беременных с ХГВ (p < 0,05; см. табл. 2). Корреляционный анализ показал наличие у этих женщин положительной связи между содержанием ИЛ-4 и ИЛ-10 (r = 0,444, p = 0,014).
Наряду с этим, в группе беременных с ХГВ были выявлены корреляционные связи между содержанием ИЛ-4 и ИФН-γ (r = 0,568; p = 0,001) и содержанием ИЛ-10 и ИФН-α (r = 0,414; p = 0,036). Кроме того, выявлены отрицательные корреляционные связи между содержанием ИЛ-10 и уровнем вирусной нагрузки ДНК HBV (r = -0,316; p = 0,046) и уровнями АЛТ (r = -0,500; p = 0,017) и АСТ (r = -0,400; p = 0,023).
Результаты данного исследования свидетельствуют об угнетении ИФН-α-продуцирующей активности иммунокомпентных клеток, снижении уровня ИЛ-4 и ИЛ-10 у беременных с ХГВ. Наличие корреляционных связей концентрации ФНО-α с уровнем АЛТ свидетельствует о его роли в развитии воспалительного процесса в печени при ХГВ у беременных. Отрицательные корреляционные взаимосвязи между содержанием ИЛ-10 и уровнем аминотрансфераз и вирусной нагрузкой могут указывать на его регулирующую роль в контроле вирусной репликации и воспалительного процесса в печени при ХГВ у женщин в III триместре беременности.
Выводы
ХГВ у беременных в III триместре сопровождался снижением концентрации в сыворотке крови ИФН-α и противовоспалительных цитокинов ИЛ-4 и ИЛ-10, тенденцией к снижению уровня ИФН-γ, отсутствием достоверных отличий содержания ФНО-α и ИЛ-1ß при сравнении с аналогичными показателями у здоровых беременных.
Корреляционный анализ выявил у беременных с ХГВ наличие положительной взаимосвязи между содержанием ФНО-α в сыворотке крови и уровнем АЛТ и отрицательных связей содержания ИЛ-10 с уровнем аминотрансфераз и вирусной нагрузкой ДНК HBV.