Коклюш является воздушно-капельной инфекцией, которая до начала прошлого века занимала первое место по летальности среди четырех детских капельных инфекций (коклюш, корь, скарлатина, дифтерия). Введение массовой иммунизации детского населения в середине прошлого века коренным образом изменило характер течения эпидемического процесса коклюшной инфекции во всем мире и способствовала значительному уменьшению количества случаев заболеваний, тяжести течения болезни и резкому снижению летальности. Однако коклюш до сих пор является одной из десяти причин летальности у детей младенческого возраста, занимает 5-е место в структуре детской смертности, вызванной вакциноуправляемыми инфекциями, и остается серьезной проблемой здравоохранения даже в странах с высоким уровнем вакцинации [1–7]. В России, несмотря на очевидные успехи проводимой массовой иммунизации детского населения и высокий уровень охвата профилактическими прививками, до настоящего времени также сохраняются подъемы и спады заболеваемости за счет как непривитых, так привитых, отмечается высокая заболеваемость детей раннего возраста, регистрируются тяжелые формы болезни, летальные исходы, а также увеличилась заболеваемость детей школьного возраста [8–11].
Одной из причин продолжающейся циркуляции возбудителя коклюша является изменение его биологических (как фенотипических, так и генотипических) свойств. Молекулярно-генетический мониторинг штаммов B. pertussis, проводимый более чем в 20 странах на 4 континентах, а также в нашей стране, показал, что штаммы B. pertussis подвержены генетической вариабельности, затрагивающей гены, кодирующие основные факторы патогенности возбудителя, что способствует расширению его приспособительных возможностей [1–3, 5–8, 12–17]. Вместе с тем недавние многочисленные исследования показали важность для адаптации болезнетворных микроорганизмов изменений, происходящих в генах, регулирующих экспрессию самих факторов патогенности, которые у возбудителя коклюша находятся под контролем двухкомпонентной регуляторной системы BvgAS [1, 2, 6, 16, 18, 19]. Однако обнаружено, что гены, детерминирующие компоненты системы, также подвержены генетической вариабельности и выявленные мутационные изменения могут приводить к нарушению работы системы [1, 2, 6, 16]. Одним из них является ген ptxP, кодирующий промоторную область коклюшного токсина (КТ), в области которого находятся 6 сайтов связывания с димером BvgA, точность присоединения которого на специфический сайт и прочность образуемой связи влияют на экспрессию гена и, следовательно, на уровень продукции КТ.
Целью настоящего исследования явился анализ особенностей структуры регуляторного гена ptxP у штаммов B. pertussis, выделенных от больных коклюшем в России в настоящее время.
Материалы и методы
Объектами исследования служили штаммы B. pertussis, выделенные от больных коклюшем в Москве, Московской, Новосибирской и Владимирской областях в 2000–2010 гг., а также штаммы, выделенные в 1948–1999 гг. (из коллекции ФБУН Московский НИИ эпидемиологии и микробиологии им. Г.Н. Габричевского Роспотребнадзора). Идентификацию штаммов B. pertussis проводили путем изучения их культурально-морфологических и серологических свойств, как описано в литературе [20]. Молекулярно-генетическое типирование проводили в сотрудничестве с профессором F. Mooi и M. van Gent (National Institute of Public Health and the Environment, Bithoven, Netherlands). Выделение ДНК, амплификацию и секвенирование фрагментов гена ptxР осуществляли согласно протоколу, приведенному в работе F. Mooi и соавт. [6]. Анализ нуклеотидных последовательностей гена ptxР выполняли с применением геномной и программной базы BLAST и базы данных EMBL/GenBank (http://www.ncbi.nlm.nih.gov/entrez). Охарактеризованные штаммы B. pertussis депонировали в коллекцию ФБУН Московский НИИ эпидемиологии и микробиологии им. Г.Н. Габричевского Роспотребнадзора.
Результаты и обсуждение
В ходе работы исследовано 117 штаммов B. pertussis, выделенных от больных коклюшем. В результате секвенирования фрагментов гена ptxP было выявлено 3 варианта последовательности нуклеотидов, которые различались между собой в двух положениях (рис. 1). Так, для варианта 1 и 3 в положении -167 характерным был нуклеотид С, в то время как для варианта 2 – нуклеотид Т. Во втором положении - 65 для варианта 1 и 2 последовательностей нуклеотидов гена ptxР характерным был нуклеотид G, а для варианта 3 – нуклеотид А. Полученные при секвенировании последовательности нуклеотидов полностью соответствовали последовательностям, опубликованным в международной базе данных генотипов EMBL/GenBank (http://www.ncbi.nlm.nih.gov/entrez) и соответствовали трем аллелям гена ptxР: вариант 1 последовательности нуклеотидов соответствовал ptxР1-аллелю, вариант 2 – ptxР2-аллелю и вариант 3 – ptxР3-аллелю гена. Первый аллель этого гена – ptxР1, согласно базе данных, является «вакцинным» аллелем, так как все штаммы, используемые в различных странах мира для производства цельноклеточных вакцин, несут этот аллель гена. Замена нуклеотида С на Т в положении -167 является контрастной и приводит к замене аминокислоты – гистидина (Н) на тирозин (Т) в положении Н57Т промотора КТ. Эти аминокислоты являются полярными, гидрофильными, алифатическими, но имеют следующие различия: гистидин является незаменимой аминокислотой с более низкой молекулярной массой (М=115,16) и высоким показателем изоэлектрической точки (pI=7,6); в то время как тирозин является заменимой аминокислотой с более высокой молекулярной массой (М=181,19) и более низкой изоэлектрической точкой (pI=5,63), т.е. замена нуклеотида С на Т является контрастной. Вторая замена нуклеотида G на А в положении -65 также является контрастной и приводит к замене аминокислоты – глицина (G) на аспарагиновую кислоту (Asp) в положении G22Asp промотора КТ. Эти аминокислоты являются алифатическими, заменимыми, но имеют следующие различия: глицин является неполярной, гидрофильной аминокислотой с более низкой молекулярной массой (М=75,07) и с высоким показателем изоэлектрической точки (pI=5,97), в то время как аспарагиновая кислота является полярной, гидрофобной аминокислотой с более высокой молекулярной массой (М=133,1) и более низкой изоэлектрической точкой (pI=2,77) (http://www.ncbi.nlm.nih.gov/Class/Structure), т.е. замена нуклеотида С на G является контрастной заменой. Следовательно, замены нуклеотидов в положениях -167 и -65 нуклеотидной последовательности гена ptxР, кодирующего промоторную область КТ, являются контрастными заменами. Вторая замена расположена в области, отвечающей за связывание с BvgA-димером в области регуляции транскрипции, что обеспечивает повышенную прочность связи и, как показали исследования [6, 16], приводит к увеличению продукции КТ.
Особенности структуры гена ptxP, кодирующего промоторную область КТ, и динамика ее изменения прослежены при изучении штаммов B. pertussis, выделенных от больных коклюшем в различные периоды эпидемического процесса коклюшной инфекции. Обнаружено, что 49 (41,9%) штаммов B. pertussis имели, согласно международной базе данных генотипов GenBank (http://www.ncbi.nlm.nih.gov/entrez), «вакцинный» ptxP1-аллель, 20 (17,1%) штаммов – «невакцинный» ptxP2-аллель и 48 (41%) штаммов несли новый «невакцинный» ptxР3-аллель гена.
При анализе динамики распространения штаммов B. pertussis с различными аллельными вариантами гена ptxР оказалось (рис. 2), что среди штаммов B. pertussis, выделенных в допрививочный период (1948–1959 гг.), 71,4% штаммов имели «невакцинный» ptxР2-аллель и 28,6% штаммов – «вакцинный» ptxР1-аллель. «Невакцинный» ptxР2-аллель, как показано выше, отличается от «вакцинного» ptxР1-аллеля наличием одной «немолчащей» мутации в положении -167 с заменой на аминокислотном уровне (Н57Т) в промоторе КТ. Однако данная мутация расположена за пределами области, содержащей 6 сайтов, отвечающих за связывание с BvgA-димером, влияющим на экспрессию КТ.
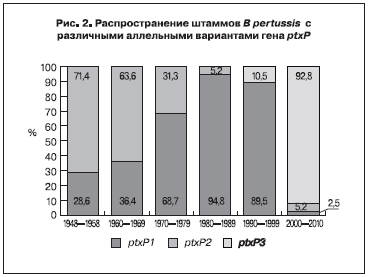
В последующие годы отмечается постепенное увеличение удельного веса штаммов с ptxР1-аллелем до 36,4% в 1960–1969 гг. и 68,7% в 1970–1979 гг. и уменьшение удельного веса штаммов с ptxР2-аллелем до 63,6% в 1960–1969 гг. и 31,3% в 1970–1979 гг. В 1980–1989 гг. удельный вес штаммов с ptxР1-аллелем составил 94,8%, а с ptxР2-аллелем снизился до 5,2%. Среди штаммов B. pertussis, выделенных в 1990–1999 гг., впервые появились штаммы (в 10,5% случаев) с новым «невакцинным» ptxР3-аллелем гена, которые в последние 10 лет становятся наиболее распространенными (в 92,8% случаев) среди циркулирующих штаммов. Однако по-прежнему сохраняются штаммы с «невакцинным» ptxР2-аллелем (в 5,2% случаев) и «вакцинным» ptxР1-аллелем (в 2,5% случаев). Следовательно, проведенный анализ структуры гена, кодирующего промоторную область КТ, у штаммов B. pertussis, выделенных от больных коклюшем в различные периоды эпидемического процесса коклюшной инфекции, показал, что в современной циркулирующей популяции штаммов произошли существенные изменения в структуре этого гена. Появились штаммы, несущие новый «невакцинный» ptxP3-аллель гена, имеющий контрастные мутационные изменения, затрагивающие функциональную область, отвечающую за связывание с BvgA-димером, входящим в глобальную регуляторную систему, что приводит к усилению прочности связи и как следствие к увеличению продукции КТ.
Для выявления влияния обнаруженных мутационных изменений, произошедших в структуре гена ptxР и приводящих к серьезным изменениям на аминокислотном уровне, проведены сопоставления вирулентных свойств 15 современных штаммов и структуры этого гена. Исследование проводились in vivo на мышах путем их интраназального заражения и последующего расчета LD50. Оказалось, что все штаммы с высокой и один штамм со средней степенью вирулентности, LD50 которых была < 18,3 млн микробных клеток, несли новый «невакцинный» ptxР3-аллель гена. В то время как среди двух современных слабовирулентных штаммов, LD50 которых значительно превышала критерий оценки слабовирулентности штаммов (>25 млн микробных клеток), один штамм характеризовался новым «невакцинным» ptxР3-аллелем, а другой штамм – старым «вакцинным» ptxР1-аллелем гена. Следовательно, изучение структуры гена ptxР штаммов B. pertussis, выделенных от больных коклюшем в настоящее время в России, показало, что большинство изученных вирулентных штаммов B. pertussis, вызывающих заболевания коклюшем в настоящее время, имеют значительные мутационные изменения в структуре регуляторного гена ptxР – характеризуются «невакцинным» ptxР3-аллелем, что может объяснять высокую продукцию ими КТ. При сопоставлении генетической структуры промоторной области с аллельными вариантами генов ptxA и ptxC, кодирующих субъединицы А- и В-комплексов КТ, оказалось, что в большинстве случаев (91,6%) штаммы с новыми «невакцинными» аллелями этих генов несут и новый «невакцинный» ptxР3-аллель гена, кодирующий промоторную область КТ. Высокая распространенность высоковирулентных штаммов со значительными мутационными изменениями как в генах патогенности, так и в регуляторном гене может указывать на риск подъема заболеваемости коклюшем, который регистрируется с 1990-х годов в различных странах мира. Полученные в работе данные согласуются с наблюдениями зарубежных коллег, показавшими [1, 2, 6, 16, 17], что замещение штаммов со старым «вакцинным» ptxР1-аллелем на штаммы с новым «невакцинным» ptxР3-аллелем наблюдается в 11 странах 4 континентов: Азии, Европе, Северной и Южной Америке и не отмечается в Африке. Широкое распространение в настоящее время штаммов с новым ptxР3-аллелем также подтверждается исследованиями по типированию штаммов возбудителя коклюша в 8 европейских странах c помощью электрофореза в пульсирующем поле (PFGE), которые показали, что в 5 из 8 стран превалируют штаммы одного PFGE-профиля – BpSR11 [5].
Подтверждением значительности произошедших в гене ptxР мутационных изменений являются исследования [6, 16], проведенные в Нидерландах с помощью ELISA, по сравнительному анализу количества продукции КТ штаммами B. pertussis с различными аллельными вариантами этого гена. Установлено, что штаммы B. pertussis, несущие новый «невакцинный» ptxР3-аллель, продуцировали значительно больше (в 1,62 раза) КТ, чем штаммы со старым «вакцинным» ptxР1-аллелем этого гена. Клинико-лабораторные сопоставления показали корреляцию между частотой выделения штаммов с ptxР3-аллелем и ростом числа зарегистрированных заболеваний, более тяжелым клиническим течением, а также сдвигом преобладания заболевания в сторону старших возрастных групп населения. Распространение штаммов с этим аллелем гена также связано с подъемом заболеваемости коклюшем в Финляндии, где в 2003 г. наблюдалась эпидемия в масштабе всей страны.
Важным остается вопрос о том, есть ли связь между вакцинацией и штаммами с новым «невакцинным» ptxP3-аллелем. Некоторые данные могут свидетельствовать в пользу этого предположения. Во-первых, штаммы с таким аллелем регуляторного гена не встречались в допрививочный период. Кроме того, штаммы с ptxP3-аллелем выделены в высоком проценте случаев у вакцинированного населения в 1990-х годах, их не обнаружили в Сенегале, где массовую вакцинопрофилактику ввели лишь в 1987 г. [17]. Созданные на основе математического моделирования вакцины для уменьшения роста патогенности могут приводить к эволюции возбудителей с более высоким уровнем вирулентности [21]. Поэтому можно полагать, что замещение штаммов на штаммы с новой генетической структурой произошло вследствие изменения ситуации в результате вакцинации. У лиц, которые получили первый комплекс вакцинации, увеличенная продукция КТ может замедлять эффективный иммунный ответ, ускорять передачу и, следовательно, приспособленность возбудителя [22]. В свою очередь увеличенная продукция КТ также может быть полезна возбудителю, так как для его нейтрализации требуются более высокие уровни антитоксических антител. Антигенная дивергенция между вакцинными и современными штаммами может действовать синергидно с ptxP3-полиморфизмом посредством увеличения передачи возбудителя привитыми лицами [6, 16]. Коклюш среди недавно привитых лиц встречается редко, это свидетельствует о том, что адаптация возбудителя не играет существенной роли, если иммунитет не ослаблен. Следовательно, можно полагать, что ослабленный иммунитет и адаптация возбудителя (наряду с другими факторами) могут способствовать широкой его циркуляции и возникновению подъемов заболеваемости коклюшем.
Таким образом, в настоящее время в популяции штаммов B. pertussis доминируют штаммы с новым «невакцинным» ptxP3-аллелем гена, кодирующим промоторную область КТ, и имеющие высокую степень вирулентности. Полученные нами результаты и данные зарубежных исследователей позволяют говорить о клональной перестройке циркулирующей популяции возбудителя коклюша, которая проходит по пути появления вариабельности в генетической структуре штаммов B. pertussis с возникновением новых «невакцинных» аллелей, имеющих существенные мутационные изменения в генах, кодирующих как основные факторы патогенности, так и их регуляторные структуры, отвечающие за уровень их экспрессии.


