Современная живая гриппозная вакцина (ЖГВ) представляет собой трехвалентный препарат, состоящий из аттенуированных вирусов гриппа типа А (H1N1 и H3N2) и В, которые в результате репродукции в клетках верхнего респираторного тракта человека индуцируют образование противовирусного иммунитета, сходного с иммунитетом, приобретенным в ответ на перенесенное заболевание. Штаммы отечественной ЖГВ представляют собой 6:2 реассортанты. С шестью внутренними генами от доноров аттенуации А/Ленинград/134/17/57 (H2N2) и В/СССР/60/69 – холодоадаптированных, температурочувствительных, созданных в лаборатории штаммов – они наследуют аттенуированный фенотип, а антигенную актуальность приобретают вместе с двумя белками оболочки, наследуемыми от эпидемического родителя [1]. Генетическая стабильность неоднократно подтверждена как для российской ЖГВ, так и для используемой в США вакцины FluMist [2–4].
Для оценки эффективности ЖГВ изучают иммунный ответ у вакцинированных лиц и приживляемость вакцинных штаммов в клетках носоглотки. Приживляемость ЖГВ у привитых оценивается культивированием их назальных мазков в чувствительных к вирусам гриппа лабораторных системах. Важной характеристикой вакцинных штаммов вируса гриппа является также отсутствие трансмиссивности (способности к передаче аттенуированного вируса от вакцинированных контактным лицам). Вероятность трансмиссивности вакцинных вирусов гриппа, обладающих высокой способностью к реассортации, вызывает настороженность у специалистов, так как теоретически может привести к появлению нового эпидемического варианта в результате скрещивания с дикими циркулирующими вирусами. Хорошая приживляемость вакцинных вирусов не свидетельствует о возможности его высокой трансмиссивности.
Несмотря на то что реассортантные вакцинные штаммы успешно получают в лабораторных условиях в развивающихся куриных эмбрионах (РКЭ), некоторые современные вирусы гриппа удается выделить исключительно из клеток млекопитающих и они сложно поддаются переадаптации к РКЭ [5, 6], поэтому в настоящем исследовании для накопления вакцинных вирусов из носовых мазков привитых использовались две системы: РКЭ и перевиваемая культура клеток почки собаки MDCK.
В настоящем исследовании проведено изучение иммуногенности и приживляемости вакцинных штаммов у детей 3–6 лет, привитых живой гриппозной реассортантной тривакциной, а также предпринята попытка выделить вакцинные штаммы от непривитых детей, находящихся в тесном контакте с вакцинированными, т. е. оценить возможную трансмиссивность ЖГВ.
Материалы и методы
Вирусы. Коммерческая живая гриппозная реассортантная тривакцина. В состав вакцины входили реассортантные вирусы А/17/Новая Каледония/20/99 (H1N1), А/17/Вайоминг/03/8 (H3N2) и В/60/Джилин/03/1, подготовленные на основе штаммов, рекомендованных ВОЗ на эпидемический сезон 2004–2005 гг. (А/Новая Каледония/20/99 (H1N1), А/Вайоминг/3/03 (H3N2) и В/Джилин/20/03 – В/Пекин/184/93–like), и ХА доноров аттенуации А/Ленинград/134/17/57 (H2N2) и В/СССР/60/69.
Контингент. В исследовании принимали участие дети 3–6 лет, посещающие детские дошкольные учреждения. В эпидемический сезон 2004–2005 гг. 24 ребенка были привиты однократно коммерческой живой гриппозной тривакциной. 28 детей, находящихся в тесном контакте с привитыми, получили препарат плацебо. Выделение вирусов из носовых ходов детей проводили через 2, 3 и 4 дня после введения вакцины параллельно в куриных эмбрионах и культуре клеток MDCK. Забор мазков осуществляли в стерильный 13% раствор пептона (0,5 мл) («БиолоТ», Санкт-Петербург). Взятие крови для реакции торможения гемагглютинации (РТГА) проводилось до вакцинации и через 21 день после вакцинации.
Накопление изолятов в культуре клеток MDCK проводили в соответствии с рекомендациями ВОЗ [2]. Для работы использовали 24-луночные полистироловые планшеты («SARSTEDT», Германия). Каждым образцом в количестве 100 мкл заражали одну лунку планшета. Через 40 мин контакта инокулят удаляли и на клетки наносили 500 мкл среды DMEM («БиолоТ», Санкт-Петербург), содержащей 2 мкг/мл TPCK трипсина. Зараженные клетки инкубировали 6 сут при 32°С в атмосфере 5% СО2. Наличие вируса определяли по гемагглютинации с 1% эритроцитами человека группы 0(I), Rh+. При отрицательном результате реакции гемагглютинации (РГА) проводили два «слепых» пассажа исследуемого материала.
Накопление изолятов в куриных эмбрионах. Каждым образцом заражали по 2 десятидневных РКЭ в объеме 0,1 мл. Эмбрионы инкубировали 3 сут при 32°С. Наличие вируса определяли по положительной РГА с 1% эритроцитами человека группы 0(I), Rh+. При отрицательном результате РГА проводили два «слепых» пассажа исследуемого материала.
Все выделенные вирусы типировались в РТГА со специфическими крысиными антисыворотками.
Иммуногенность вакцинных штаммов определяли по количеству приростов титров антител в сыворотках привитых, предварительно обработанных препаратом RDE («Denka Seiken Co.», Япония) для удаления термостабильных ингибиторов гемагглютинации. Титры сывороточных антител определяли в стандартной РТГА с 4 АЕ антигена и 1% взвесью эритроцитов человека группы 0(I), Rh+. В качестве антигенов использовали варианты вирусов гриппа, гомологичные вакцинным штаммам.
Результаты и обсуждение
Выделение вирусов гриппа из мазков в РКЭ и культуре клеток MDCK. 24 ребенка 3–6 лет были привиты однократно коммерческой ЖГВ. Мазки от привитых детей собирали на 2-е, 3-и и 4-е сутки после вакцинации. Результаты выделения вакцинных вирусов представлены в табл. 1.
Примечание. Здесь и в табл. 2: «–» – вирус не выделен после трех пассажей в РКЭ или культуре клеток MDCK.
Процент выделения вируса в РКЭ и культуре MDCK составил 87,5 и 98,5 соответственно, причем у 21 ребенка вирус был выделен одновременно и в РКЭ, и в культуре MDCK, а у 2 – только в культуре. У 1 из 24 детей вирус не был выделен ни в РКЭ, ни в культуре. В целом, в одной или в другой системе культивирования в 96% случаев был выделен хотя бы один из компонентов вакцины.
Выделенные вирусы гриппа типировались в РТГА с гипериммунными крысиными сыворотками к вирусам А/Новая Каледония/20/99 (H1N1), А/ Вайоминг/3/03 (H3N2) и В/Джилин/20/03. В табл. 2 приведены результаты типирования вакцинных вирусов, выделенных в РКЭ и в культуре клеток MDCK. Показано, что в двух изолятах, которые удалось накопить только в культуре MDCK, типировались A(H1N1) либо A(H3N2) компоненты вакцины. В 29% (7 из 24) исследованных образцов в «эмбриональном» и культуральном изолятах типировались одинаковые вакцинные компоненты. Так, от 3 привитых лиц в РКЭ и в культуре был выделен только вирус A(H1N1), а от 4 – только вакцинный вирус гриппа В.
Представляет интерес тот факт, что в 5 (21%) образцах, положительных как в РКЭ, так и в культуре MDCK, в разных системах выделились разные вакцинные составляющие. В 4 из них РКЭ были чувствительны только к компоненту A(H1N1), тогда как культура клеток – к компоненту В. В одном образце с помощью РКЭ выделился вирус A(H3N2), а с помощью культуры – A(H1N1).
Очевидное преимущество культуры для выделения вакцинных вирусов демонстрирует группа из 6 (25%) образцов, в которых с помощью этой системы удалось выделить большее количество компонентов ЖГВ, причем все выделенные в РКЭ составляющие также выделялись и в культуре. Только у одного ребенка (4%) наблюдалась обратная картина – в MDCK выделился всего один вакцинный вирус (B), а в РКЭ – два: A(H1N1) и В. По два вакцинных компонента типировалось в двух культуральных и «эмбриональных» изолятах, при этом в сумме из данных образцов выделились все три составляющие ЖГВ.
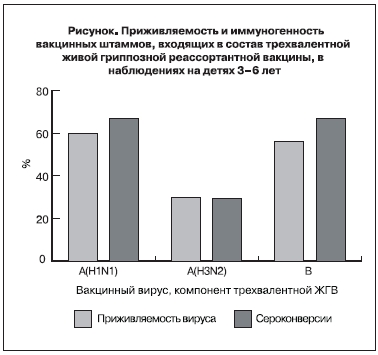
Таким образом, приживляемость штаммов трехвалентной ЖГВ у вакцинированных детей, выявленная с помощью обеих систем культивирования изолятов (РКЭ и МDСК), составила 66,7% (16 из 24) для компонентов А/17/Новая Каледония/99/145 (H1N1) и В/60/Джилин/03/1 и 29,2% (7 из 24) для компонента А/17/Вайоминг/03/8 (H3N2).
Параллельно с группой детей, привитых трехвалентной ЖГВ, анализировалась равнозначная по числу лиц группа детей (28 человек), получивших препарат плацебо (аллантоисная жидкость куриного эмбриона). Отбор детей в обе группы проводили так, чтобы в отдельных коллективах находилось примерно равное число представителей каждой группы. Ни у кого из 28 лиц группы плацебо после трех пассажей вирусы не выделились ни в РКЭ, ни в культуре MDCK (табл.2). Эти результаты свидетельствуют о том, что не происходит передачи вакцинных штаммов от привитых контактным лицам, т.е. ЖГВ не трансмиссивна.
Иммуногенность живой гриппозной вакцины. Для оценки иммуногенности ЖГВ для детей изучались парные сыворотки крови, взятые до вакцинации и через 21 день после вакцинации. Достоверным приростом титров сывороточных антител считали их 4-кратное и более увеличение во второй сыворотке по сравнению с первой. Процент сероконверсий рассчитывался как отношение количества лиц с 4-кратным и более приростом титра антител к общему числу привитых.
На рисунке представлены результаты изучения иммуногенности и приживляемости вакцинных штаммов, входящих в состав трехвалентной ЖГВ. Продемонстрировано, что приживляемость вакцинного вируса хорошо коррелирует с его иммуногенностью.
В настоящем исследовании проведен анализ приживляемости, трансмиссивности и иммуногенности ЖГВ, подготовленной на эпидемический сезон 2004–2005 гг. Проведена оценка чувствительности двух систем культивирования вирусов – РКЭ и культуры MDCK – для выделения вакцинных штаммов ЖГВ от привитых лиц. Ранее эти две системы сравнивались лишь по их сродству к циркулирующим эпидемическим вирусам [5, 7, 8]. Авторы отмечали сложности выделения современных вирусов гриппа в системе РКЭ. Большинство вирусов гриппа A(H3N2) и В в последние эпидемические сезоны вообще не удавалось выделить в РКЭ, часто они были неспособны даже искусственно адаптироваться к этой системе. При этом эпидемические вирусы A(H1N1) (А/Новая Каледония/20/99-подобные вирусы) способность к репродукции в куриных эмбрионах сохранили [5, 6]. Полученные нами данные подтверждают эту тенденцию. Так, наиболее успешно в куриных эмбрионах удавалось выделить вакцинный штамм на основе вируса А/Новая Каледония/20/99 (H1N1), тогда как вакцинный компонент В выделялся от привитых детей достоверно чаще в клетках MDCK, несмотря на то, что сам вакцинный вирус был хорошо адаптирован к репродукции в РКЭ в процессе его подготовки.
Сравнительно низкая (29,2%) частота выделения вакцинного штамма A(H3N2) может быть обусловлена тем, что в два предшествующих эпидемических сезона (2002–2003 и 2003–2004 гг.) вирусы именно этого сероподтипа являлись основными возбудителями гриппа на территории России [5, 6] и часть детей могла иметь иммунитет к антигеннородственному штамму. Этот вывод подтверждают также данные о невысокой иммуногенности вакцинного компонента A (H3N2) (30,2%).
Иммуногенность вакцинных штаммов ЖГВ хорошо коррелировала с частотой их изоляции от привитых. Следует отметить, что до 2004 г. реассортантные вакцинные штаммы ЖГВ для детей и для взрослых готовили на двух разных донорах аттенуации. Вакцинные штаммы ЖГВ для взрослых – на доноре аттенуации А/Ленинград/134/17/57 (H2N2), а штаммы ЖГВ для детей – на гиператтенуированном доноре А/Ленинград/134/47/57 (H2N2) [1]. В 2003 г. Комитет медицинских иммунобиологических препаратов счел целесообразным рекомендовать взрослый вариант вакцины для иммунизации детей в возрасте 3–6 лет с внесением соответствующих изменений в инструкцию по применению препарата [9]. Высокая иммуногенность компонентов A(H1N1) и В после однократной иммунизации детей 3–6 лет и отсутствие побочных эффектов в очередной раз подтверждают оправданность такого перехода.
Несмотря на то что приживляемость того или иного вакцинного компонента составила в нашем исследовании 96%, трансмиссивность вируса от привитых контактным детям не наблюдалась. Не было выделено ни одного вакцинного штамма в группе плацебо. Хорошая приживляемость вакцинных вирусов не свидетельствует о возможности его высокой трансмиссивности, возможно, для передачи вируса контактным лицам требуется больше вирусных частиц, чем обычно выделяют привитые [4].
Таким образом, результаты выделения и типирования вакцинных штаммов от привитых лиц позволяют сделать вывод о том, что наилучший эффект выделения вакцинных вирусов дает использование комбинации двух систем культивирования – РКЭ и культуры клеток MDCK. В таком случае удается получить наиболее полный набор изолятов и более адекватно оценить приживляемость вакцинных штаммов ЖГВ. Изучение трансмиссивности ЖГВ показало, что вакцинные штаммы не передаются от привитых детей лицам, находящимся с ними в тесном контакте. Приживляемость вакцинного вируса в клетках респираторного тракта хорошо коррелирует с его иммуногенностью для детей. Хорошая приживляемость вакцинных вирусов не свидетельствует о возможности их трансмиссивности.


