Острые кишечные инфекции (ОКИ) продолжают занимать ведущее место в инфекционной патологии детского возраста, уступая по массовости и экономическому ущербу только острым респираторным заболеваниям и гриппу [1]. В этиологической структуре ОКИ в настоящее время в нашей стране, как и во всем мире, ведущее место стали занимать вирусные диареи, однако из бактериальных инфекций за последние годы на первое место вышли сальмонеллезы. По данным официальной статистики, после снижения в 90-е годы и дальнейшей стабилизации заболеваемости сальмонеллезами начиная с 2006 г. отмечается ее рост, преимущественно за счет заболеваемости детей (с 75,6 в 2005 г. до 111,7—109 в 2008—2009 гг. на 100 000 детского населения) [2], которая далеко опередила заболеваемость шигеллезами, снизившуюся за 11 лет в 10 раз (рис.1). Если в 1999 г. заболеваемость шигеллезами превышала заболеваемость сальмонеллезами в 4,7 раза, то в 2009 г. она стала в 2,5 раза ниже.
Рисунок 1. Заболеваемость детей сальмонеллезами и шигеллезами в последние годы по статистическим данным РФ (на 100 000 детского населения).
На основании длительного (более 30 лет) слежения за ОКИ в профильном детском стационаре
Москвы (ДИБ №5) нами установлено увеличение доли сальмонеллезов в этиологической структуре
расшифрованных ОКИ, которые в последние годы составляют почти половину расшифрованных
заболеваний (40,6—43,1%), уступая лишь ротавирусной инфекции.
С середины 80-х годов ХХ века на смену доминирующим ранее S. typhimurium пришли S. enteritidis,
которые, по данным Российского референс-центра по мониторингу за сальмонеллезами, в последние годы на большинстве территорий Российской Федерации с наибольшей частотой выделяются как от больных людей, так и от животных и с объектов окружающей среды [3]. Кроме того, из числа зарегистрированных в 2004 — 2008 гг. эпидемических вспышек сальмонеллеза 70,8 — 96,7% были вызваны S. еnteritidis. По данным профильного стационара Москвы, доля S. еnteritidis среди подтвержденных сальмонеллезов у госпитализированных детей увеличилась в 19 раз — с 3,4%
в 1977—1982 гг. до 63,4% в 1988—1989 гг. (рис. 2) и в последние 10 лет сохраняется стабильно высокой (66,5—86%).
Рисунок 2. Эволюция этиологической структуры Сальмонеллезов у детей по данным ДИБ №5, %.
В отличие от доминировавшего ранее сальмонеллеза Typhimurium, поражавшего чаще всего
детей раннего возраста, в возрастной структуре больных, госпитализированных с диагнозом
сальмонеллез Enteritidis, за все годы наблюдений преобладали дети в возрасте 1—7 лет (57,3—66,6%),
не посещающие детские учреждения (62,1—68,6%), что связано с преимущественно пищевым путем
инфицирования. Установлено, что в годы доминирования S. еnteritidis (2000—2010) по сравнению
с периодом времени доминирования S. typhimurium (1987—1982) достоверно чаще предполагался пищевой путь инфицирования (70,3—54 против 21,7% соответственно), в том числе в семейных очагах
(27,4—42,1 против 11,5% соответственно), и резко уменьшилась доля больных с внутрибольничным
заражением (1,3 против 59,3% соответственно).
Рисунок 3. Эволюция тяжести сальмонелезов у детей разного возраста по данным ДИБ №5, %.
Важной проблемой является и тяжесть течения современного сальмонеллеза Enteritidis у детей. По данным анализа 1802 статистических карт всех детей с сальмонеллезом Enteritidis, находившихся
на лечении в профильном стационаре в 2000—2008 гг. (рис.3), частота тяжелых форм болезни
в разные годы колебалась от 3,6 до 28% у детей раннего возраста и от 7,8 до 21,6% у детей старше года, при этом почти в течение всего анализируемого периода она была выше у последних. По данным
анализа 402 историй болезни, в 2005—2008 гг. произошло снижение частоты тяжелых форм болезни по сравнению с таковой в 1992—2002 гг. (16,3 и 25,7% соответственно, р<0,05), как за счет симптомов интоксикации (гипертермия у 18,7 против 43% соответственно, р<0,001), так и за счет эксикоза (9,9 и 30,1% соответственно, р<0,05).
Клиническая диагностика сальмонеллеза Enteritidis у детей представляет известные трудности в связи со сходством его с шигеллезами [4,5], что связано с выявленной нами ранее частотой выработки этими возбудителями шигаподобного токсина [6]. Характерны острое или подострое начало болезни; сочетание симптомов интоксикации (вялость, адинамия, снижение аппетита, бледность кожных покровов) с распространенным поражением желудочно-кишечного тракта (у половины детей — гастроэнтероколит, у трети — энтероколит) и частым (у половины детей) развитием геморрагического колита; абдоминальный синдром; синдром дистального колита; гепатоспленомегалия; нередко — волнообразное течение болезни. Отличиями от шигеллезов являются более позднее появление примеси крови в испражнениях (в 1-й день болезни — только у трети детей до года, у 18,2% детей в возрасте от 1 года до 3 лет и у 13,2% — старше 3 лет); достоверно большая частота спленомегалии (28,5 и 8,1%) и меньшая — дистального колита (27,3 и 39,5% соответственно). Поэтому при учете вышеописанного симптомокомплекса и эпидемиологических данных (редкость шигеллезов в настоящее время, сезонность, «пищевой» анамнез) предварительная клиническая диагностика современного сальмонеллеза у детей возможна.
В связи с высокой частотой распространения вирусных диарей у детей (а среди них на первом месте — ротавирусная инфекция) актуальной проблемой является сочетанное течение этих двух лидирующих ОКИ (сальмонеллеза и ротавирусной инфекции). При анализе 741 истории болезни детей, госпитализированных в стационар в 2000—2008 гг. с лабораторно подтвержденным сальмонеллезом и обследованных на ротавирусную инфекцию (иммуноферментный анализ, полимеразная цепная реакция, иммунохроматография), эта микстинфекция выявлена у 30,9% больных. При этом у детей до 3 лет она регистрировалась достоверно чаще, чем у более старших (43,9 и 13,5% соответственно, р<0,05), и преимущественно в холодное время года — 46,3% во II против 5,1% (р<0,001) в III квартале, что определяется зимне-весенней сезонностью ротавирусной инфекции. При сопоставлении клинической картины у 61 ребенка с микстсальмонеллезом и 74 детей с моносальмонеллезом при сочетанной инфекции установлена большая частота синдрома водянистой диареи (42,3 и 13,5% соответственно, р<0,001) и рвоты (75,4 и 58,8%, р<0,05), что приводит к большей частоте эксикоза (24,6 и 10,8%, р<0,05) и гастроэнтероколитов (81,4 и 57,7% соответственно, р<0,05). При микстинфекции заболевание протекает тяжелее и в 3 раза чаще имеет волнообразное течение (30,2 и 10,0% соответственно, р<0,05); в 2,4 раза чаще регистрируется повторное бактериовыделение после этиотропной терапии (61,1 и 25% соответственно, р<0,05) и наблюдается большая длительность диареи (в среднем 11,2 и 7,4 дня соответственно, р<0,05). Таким образом, при сочетанной сальмонеллезно-ротавирусной инфекции сохраняются основные клинические проявления
сальмонеллеза, но утяжеляется и пролонгируется его течение, задерживаются клиническое выздоровление и санация от возбудителя.
Еще одной проблемой современных сальмонеллезов у детей является выявленный нами впервые периодический рост лекарственной резистентности у доминирующих ныне S. еnteritidis. Нами изучена антибиотикорезистентность 418 штаммов S. еnteritidis (с использованием пластин АТВ G фирмы BioMerieux, Франция), выделенных от детей, госпитализированных в 2005—2009 гг., к 27 антибактериальным препаратам, относящимся к разным группам (современные пенициллины, цефалоспорины I—IV поколений, хинолоны и фторхинолоны, аминогликозиды, котримоксазол, тетрациклин). Полученные данные сопоставлены с результатами изучения лекарственной резистентности в этом же стационаре в прошлые годы методом серийных разведений в агаре (рис. 4). Установлен рост лекарственной резистентности S. еnteritidisссередины90-хгодов, вначале за счет снижения (в 17 раз) доли штаммов, чувствительных ко всем препаратам, и роста (в 3 раза) устойчивых к 1—2 антибиотикам. А в 2005—2007 гг. уже увеличивается (в 3,5 раза) доля штаммов, резистентных к 3—5 препаратам, и впервые появляются штаммы, резистентные к 6 препаратам и более (28,9%), в том числе 5,1% — к 11—16 препаратам. Однако в 2008—2009 гг. вновь резко увеличилась доля чувствительных штаммов (с 3,8 до 79% соответственно) и снизилась (в 3 раза) — полирезистентных (до 5,7%).
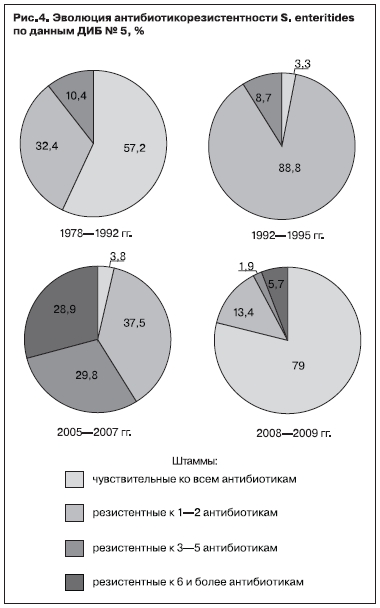
Подобные колебания лекарственной резистентности, но более растянутые во времени, наблюдались нами ранее только у S. typhimurium, при этом изменялись и эпидемиология заболеваний, вызванных полирезистентными штамамми (преобладало контактно-бытовое внутрибольничное распространение у детей раннего возраста), и клиническая картина болезни (частота генерализованных форм с постепенным началом и длительным волнообразным течением) [7]. Однако на клиническую картину сальмонеллеза Enteritidis пока существенного влияния лекарственной резистентности возбудителя мы не выявили (при сопоставлении ее у 60 детей, у которых выделены чувствительные штаммы, и у 130 детей, у которых выделены штаммы, резистентные к 3 антибиотикам и более), что свидетельствует о том, что у S. еnteritidis еще не сформировались госпитальные штаммы, как это было с S. typhimurium. Это может быть связано как с различными механизмами антибиотикорезистентности у этих сероваров и их влиянием на вирулентность возбудителя, так и с кратковременностью этого эпизода у S. еnteritidis. Однако отмечается отчетливая тенденция к большей частоте повторного бактериовыделения после курса этиотропной терапии при сальмонеллезе Enteritidis, вызванном резистентными штаммами, по сравнению с таковой при сальмонеллезе, вызванном чувствительными штаммами (33,3 против 13,% соответственно, td=1,9).
Поэтому следующей важной проблемой современных сальмонеллезов у детей является рост длительности постинфекционного бактерионосительства. При изучении частоты повторного бактериовыделения сальмонелл в стационаре после курса этиотропной терапии у 272 госпитализированных детей (преобладали больные старше года со среднетяжелым сальмонеллезом Enteritidis) установлены ее достоверный рост в 2004—2006 гг. по сравнению с 2000—2003 гг. (63,9 против 26,5% соответственно, р<0,001) и достоверное снижение (до 36,1%, р<0,05) в 2008—2009 гг., что соответствует вышеописанному волнообразному изменению лекарственной резистентности доминирующих S. еnteritidis. Однако при изучении частоты повторного бактериовыделения у 63 детей в катамнезе после выписки из стационара она оставалась высокой в течение всего анализируемого периода (57,1% в 2000—2004 гг. и 45,7% в 2008—2010 гг., р>0,05), а у трети детей (25—42,9% в разные годы) продолжали высеваться сальмонеллы дольше 1,5 мес (максимальный срок в наших наблюдениях — 9 мес), что свидетельствует о затяжном течении сальмонеллеза. При этом продолжали высеваться сальмонеллы и у детей с отрицательными результатами повторного бактериологического обследования в стационаре перед выпиской. По-видимому, это можно объяснить особенностями патогенеза сальмонеллезов — способностью сальмонелл к сохранению и размножению в фагоцитах и эпителиоцитах, а при снижении иммунореактивности организма — и к перемещению из инфицированных эпителиоцитов в неинфицированные [8, 9]. Поэтому еще одной причиной длительного бактерионосительства может быть снижение иммунной защиты организма, что было подтверждено и нашими исследованиями: у детей с затяжным бактериовыделением по сравнению с больными с благоприятным течением сальмонеллеза в 2 раза чаще был снижен иммунорегуляторный индекс CD4+/CD8+ (42,8 и 20% соответственно, р<0,05).
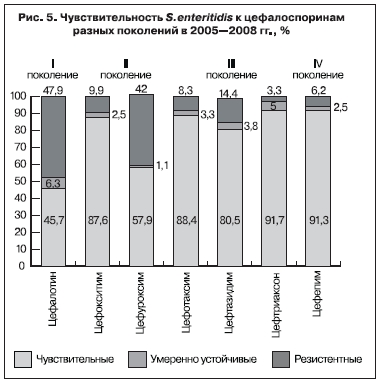
Одной из основных проблем современных сальмонеллезов у детей является недостаточная эффективность этиотропной терапии, связанная прежде всего с развитием лекарственной резистентности к наиболее распространенным стартовым антибактериальным препаратам. Нами
установлены рост числа штаммов, устойчивых к налидиксовой кислоте, гентамицину и даже амикацину, и соответственно снижение клинической и санирующей эффективности этих препаратов. Так, доля детей, у которых получен полный клинический эффект от налидиксовой кислоты, в 2009 г. по сравнению с 2000—2005 гг. уменьшилась в 1,3 раза (48,3 против 61% соответственно, р<0,05), а от амикацина (при пероральном применении) — в 1,7 раза (31,7 против 53,9% соответственно, р<0,05). Санирующий эффект снизился более существенно у налидиксовой кислоты (с 74,2 до 29,4% соответственно, р<0,05), чем у амикацина (66,7 и 50% соответственно, р>0,05). Эффективность препаратов резерва (рифампицин, нетромицин, норфлоксацин) в течение всех лет оставалась достаточно высокой, но тоже имела тенденцию к снижению: полный клинический эффект у 96,1 и 70,8% детей соответственно (р<0,05), а санирующий эффект — у 100 и 80% соответственно (р>0,05). Кроме того, эти препараты или имеют возрастные ограничения (норфлоксацин), или токсичны (нетромицин при парентеральном введении, рифампицин). В качестве альтернативы для этиотропной терапии сальмонеллезов у детей представляется перспективным использование цефалоспоринов III
поколения, как парентеральных (цефотаксим, цефтриаксон, цефтазидим), так и пероральных
(цефиксим). Их достоинствами являются широкий спектр антимикробного действия, высокая биодоступность, хорошая переносимость и безопасностьдлядетейлюбоговозраста,разнообразие
лекарственных форм и, наконец, высокая чувствительность к ним доминирующих S. еnteritidis,
установленная нами (рис. 5). Изучение терапевтической эффективности этих препаратов у 45
детей (основная группа) показало их высокую эффективность, как клиническую, так и санирующую, сопоставимую с таковой у препаратов резерва, применявшихся у 28 детей (группа сравнения). Полный клинический эффект наблюдался у 75,6 и 85,7% соответственно (р>0,05), а санация от возбудителя — у 63,6 и 80% соответственно (р>0,05). В связи с этим цефалоспорины III поколения целесообразно более широко использовать для лечения тяжелой и среднетяжелой форм сальмонеллезов у детей, как в качестве препаратов резерва (при неэффективности стартовых), так и в качестве стартовых (при тяжелом и генерализованном течении болезни; у детей группы риска по иммунодефицитам; при соче-
тании с бактериальными осложнениями ОРЗ). Возможна ступенчатая терапия.
Недостаточная эффективность общепринятых методов лечения детей с длительным постинфекционным сальмонеллезным бактерионосительством (повторные курсы антибиотиков и бактериофага, КИП) и нарушения иммунного статуса у этих детей, описанные выше, послужили обоснованием для применения в этих случаях иммунокорригирующей терапии. С этой целью мы использовали ликопид — отечественный иммунокорректор, мягко действующий на все звенья иммунитета, не имеющий возрастных ограничений и не оказывающий побочного действия. Первый опыт лечения ликопидом (3 курса по 10 дней с перерывом 20 дней) 15 детей (10 — с сальмонеллезом
Enteritidis), в том числе 11 детей, у которых высевались сальмонеллы в течение 1,5—9 мес, оказался
удачным. Все дети освободились от возбудителя, о чем свидетельствовали 4 отрицательных результата бактериологического обследования (3 — через день и 4-й — через месяц).
Таким образом, с целью оптимизации комплексной терапии современных сальмонеллезов у детей
могут быть использованы в качестве альтернативных этиотропных препаратов в острой фазе
болезни цефалоспорины III поколения, а при длительном постинфекционном бактерионосительстве и иммуномодуляторы (ликопид).
Выводы
1. Заболеваемость сальмонеллезами у детей в России в последние годы увеличивается, превышая таковую шигеллезов, и сальмонеллез стал занимать первое место в этиологической структуре расшифрованных бактериальных ОКИ у госпитализированных детей.
2. Произошла смена доминирующего серовара с S. typhimurium на S. еnteritidis, которые вызывают
заболевания преимущественно у детей в возрасте 1—7 лет, не посещающих детские учреждения,
с пищевым путем инфицирования.
3. Заболевания, вызванные доминирующими в настоящее время S. еnteritidis, имеют типичную «дизентериеподобную» клиническую картину и нередко протекают в тяжелой форме (чаще
у детей старше года), частота которой в последние годы снижается.
4. Современные сальмонеллезы у трети детей протекают в сочетании с широко распространенной ротавирусной инфекцией (чаще у детей раннего возраста и в холодное время года), которая
утяжеляет и пролонгирует течение сальмонеллеза.
5. Лекарственная резистентность доминирующих в настоящее время S. еnteritidis подвержена
колебаниям в разные годы, при этом рост антибиотикорезистентности возбудителей в 2005—
2007 гг. существенно не изменил клинического течения болезни, но привел к снижению эффективности общепринятых стартовых этиотропных препаратов. Целесообразно продолжать постоянное слежение за лекарственной резистентностью сальмонелл.
6. У половины детей, выписанных из стационара, продолжают высеваться сальмонеллы, в том
числе у трети — более 1,5 мес, что диктует необходимость диспансерного наблюдения и обследования всех детей, перенесших сальмонеллез (не менее 3 мес).
7. Существующие этиотропная терапия сальмонеллезов у детей в острой фазе болезни и комплекс лечения при постинфекционном бактерионосительстве недостаточно эффективны. Альтернативой могут служить цефалоспорины III поколения и иммунотропные препараты (ликопид).


