Противовирусная активность фавипиравира в отношении новых вариантов SARS-CoV-2 дельта и омикрон
DOI: https://dx.doi.org/10.18565/epidem.2022.12.1.110-4
Крышень К.Л., Волок В.П., Шустова Е.Ю., Шипунов Г.А., Зинченко А.В., Самсонов М.Ю., Филон О.В., Шипаева Е.В.
1) НПО «Дом Фармации», Ленинградская обл., Россия;
2) Федеральный научный центр исследования и разработки иммунобиологических препаратов им . М.П. Чумакова РАН (Институт полиомиелита), Москва, Россия;
3) АО «Р-Фарм», Москва, Россия
Цель исследования. Изучение противовирусной активности фавипиравира в отношении различных вариантов SARS-CoV-2.
Материалы и методы. Была изучена in vitro противовирусная активность препарата против 3 вариантов коронавируса SARS-CoV-2: штаммов В.1.1, дельта и омикрон, в клетках Vero. Результаты оценивали по уменьшению урожая вирусной РНК в зараженных клетках методом ПЦР с обратной транскрипцией с детекцией в режиме реального времени.
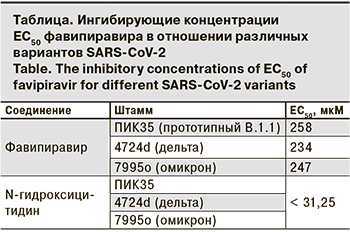
Результаты. Фавипиравир эффективно ингибировал репродукцию SARS-CoV-2, при этом ингибирующая концентрация ЕС50 существенно не различалась между вариантами вируса, находясь в интервале 200–300 мкM для всех штаммов.
Заключение. Эволюционные изменения вируса SARS-CoV-2 не оказали значимого влияния на активность препарата in vitro, которая сохраняется в отношении новых вариантов SARS-CoV-2
В декабре 2019 г. в Ухане (КНР) возникла эпидемическая вспышка острого респираторного заболевания COVID- 19, ассоциированного с вирусом SARS-CoV-2. Инфекция стремительно распространилась по всей территории Китая. 31 декабря 2019 г. ВОЗ признала вспышку инфекции, а 30 января 2020 г. объявила чрезвычайную ситуацию на международном уровне и глобальную пандемию – 11 марта 2020 г. Случаи коронавирусной инфекции были зарегистрированы в большинстве стран мира [1].
С начала пандемии эпидемическая ситуация по COVID- 19 динамично изменяется. В 2021 г. широкое распространение получил сначала вариант коронавируса дельта, характеризующийся более высокой смертностью, а затем южноафриканский вариант – омикрон, отличающийся значительной скоростью распространения в человеческой популяции за счет высокого коэффициента передачи [1].
Фавипиравир (Ф) является ингибитором РНК-зависимой РНК-полимеразы (RdRp) – ключевого белка, участвующего в репликации генома вируса SARS-CoV-2. Попадая в клетку, он метаболизируется до активного метаболита трифосфата Ф, который, связываясь с RdRp, эффективно подавляет размножение вируса двумя возможными путями: остановкой синтеза РНК после присоединения двух остатков фавипиравира в растущую цепь [2, 3], либо встраиванием в РНК вируса и индукцией летального мутагенеза [4–6]. Ф активен в отношении различных классов вирусов с РНК-геномами, в том числе из семейства Coronaviridae [7–11]. При этом основным механизмом действия в отношении SARS-CoV-2 является индукция летального мутагенеза вследствие аккумуляции ошибок в геноме вируса [11]. Ранее была продемонстрирована активность препарата в отношении SARS-CoV-2 в исследованиях in vitro [12–14] и in vivo [12, 15], а также в ряде клинических исследований [16–21], что позволило внести препараты на основе Ф в клинические рекомендации по лечению новой коронавирусной инфекции [22]. Однако большинство исследований было проведено на ранних вариантах SARS-CoV-2. В ряде более поздних клинических исследований Ф не показал статистически значимого различия по сравнению с плацебо [23–26], это дало основания предположить, что, хотя изменения в гене RdRp вследствие эволюции вируса незначительны, Ф мог утратить свою эффективность в отношении новых вариантов SARS-CoV-2 дельта и, возможно, омикрон. Таким образом, возникла необходимость оценки эффективности ингибирования Ф новых вариантов SARS-CoV-2 для понимания возможности его дальнейшего использования в лечении новой коронавирусной инфекции. Поэтому настоящее исследование было посвящено изучению фармакологической активности Ф in vitro в отношении вариантов SARS-CoV-2 дельта и омикрон в сравнении с более ранним прототипным «европейским» штаммом клада В.1.1.
Материалы и методы
Линия клеток почки зеленой мартышки Vero получена из Biologicals (ВОЗ, Швейцария). Клетки вели на среде Игла, модифицированной Дульбекко (ДМЕМ, ФНЦИРИП им. М.П. Чумакова РАН, Россия) с добавлением 5% фетальной бычьей сыворотки (FBS, Gibco) и смеси антибиотиков (стрептомицин, 0,1 мг/мл и пенициллин penicillin 100 Ед/мл) («ПанЭко», Россия).
Штаммы вируса SARS-CoV-2 [прототипный штамм ПИК35 (клад Pango B.1.1, GISAID ID EPI_ISL_428852), вариант дельта штамма 4724d (GISAID ID EPI_ISL_8799478) и вариант омикрон штамма 7995o (GISAID ID EPI_ISL_9613539)] были выделены в Москве из назофарингеальных мазков пациентов с COVID-19. Вирусы прошли 3–5 пассажей в клетках Vero cells и хранились в виде замороженной суспензии зараженных клеток при -70 °C.
Готовили серию 2-кратных разведений стоковых растворов субстанции и контрольного соединения, начиная с концентрации 1:50, на среде ДМЕМ. Для Ф диапазон концентраций составлял 62,5–1000 мкМ, для контрольного препарата N-гидроксицитидина (NHC) – 6,25–100 мкМ. Приготовленные разведения добавляли к клеткам Vero и инкубировали 4 ч при 37 °С в СО2-инкубаторе. Готовили рабочие разведения вирусов для заражения клеток с 0,0001 MOI (множественность заражения) (ТЦД50/кл) и добавляли их к клеткам с соединениями. Клетки инкубировали 2 ч при 37 °С в СО2-инкубаторе для адсорбции и проникновения вируса, затем среду с вирусом удаляли и заменяли на соответствующие разведения соединений. После чего инкубировали клетки при 37 °С в СО2-инкубаторе 40 ч для прототипного штамма ПИК35 и 4724d варианта штамма дельта, 114 ч – для 7995о варианта штамма омикрон. После инкубации количество вирусной РНК оценивали в супернатанте с помощью коммерческого набора реагентов ПОЛИВИР SARS-CoV-2 (НПФ «Литех», Россия) для полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) c детекцией в режиме реального времени согласно инструкции производителя, определяли Ct (пороговый цикл флуоресценции). В каждом эксперименте проводили титрование препарата позитивного (N-гидроксицитидин, активный метаболит молнупиравира) и отрицательного контроля (растворитель без носителя). Эксперимент независимо повторен 2 раза для расчета среднего значения ЕС50.
Готовили серию 2-кратных разведений стоковых растворов, начиная с 1000мкМ, на среде ДМЕМ (ФНЦИРИП им. М.П. Чумакова РАН, Россия). Приготовленные разведения добавляли к клеткам Vero и инкубировали 40 ч при 37 °С в СО2-инкубаторе. Затем среду удаляли и заменяли на 0,03 мг/мл раствор резазурина в среде ДМЕМ. Клетки инкубировали 4 ч при 37 °С в СО2-инкубаторе. Флуоресценцию детектировали при 544 nm Ex/590 nm Em (Fluoroskan, ThermoFisher Scientific, США).
Результаты и обсуждение
Использованная в исследовании клеточная линия Vero, хотя и не является клеточной линией легочного эпителия, характеризуется высоким уровнем экспрессии ангиотензинпревращающего фермента 2 (ACE2) на поверхности клеток, который служит рецептором для вируса SARS-CoV-2, отвечая за связывание и проникновение его в клетки [27, 28]. Эта клеточная линия широко применяется в рамках исследований SARS-CoV-2 и скрининга противовирусных соединений in vitro.
В более ранних исследованиях фармакологическую активность Ф in vitro изучали на клеточных культурах VeroE6 [11–14], Calu-3 [29], а также Caco-2 [12, 29]. Данные по ингибирующей активности препарата в разных исследованиях сильно разнились в зависимости от дизайна эксперимента (вида вируса, диапазона исследованных концентраций, времени инкубации с вирусом и активным веществом, MOI и др.), а также детектируемого параметра (концентрации вирусной РНК в супернатанте, цитопатического эффекта или окрашивания по белку S). Таким образом, диапазон ингибирующих концентраций (EC50) для Ф составлял от 62 до более 500 мкМ. При этом в части исследований ЕС50 не была достигнута из-за ограниченного диапазона исследуемых концентраций [14, 29, 30].
Мы подобрали оптимальные условия для проведения экспериментальной оценки противовирусной активности Ф in vitro, при которых отсутствовали как цитотоксичность, вызванная инкубацией с препаратом, так и цитопатический эффект вируса, которые могут затруднить интерпретацию полученных результатов. В данном исследовании клетки Vero инкубировали в течение 4 ч с Ф в серийных разведениях от 32,5 мкМ до 1000 мкМ, после чего к ним добавляли вирус в дозе MOI 0,0001 и инкубировали с клетками в течение 40 ч для прототипного штамма и варианта дельта и 114 ч – для варианта омикрон из-за более медленной репликации вируса и отсутствия значимых различий между положительным и отрицательным контролем после инкубации в течение 40 ч. Концентрацию вирусного урожая в супернатанте определяли методом ОТ-ПЦР с детекцией в реальном времени.
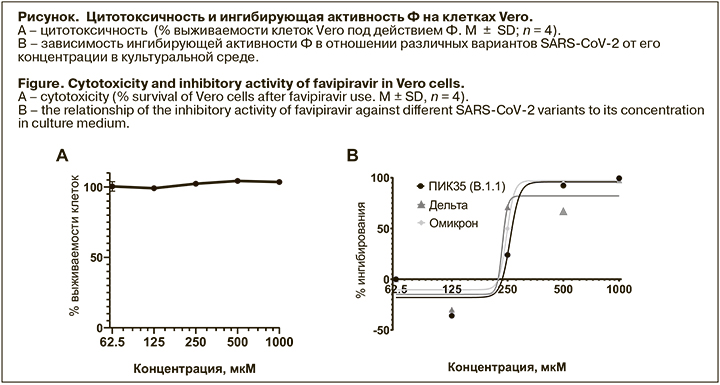
Ф ингибировал репродукцию штаммов всех трех вариантов SARS-CoV-2 в диапазоне концентраций 200 –300 мкМ (см. рисунок), при этом отсутствовали статистически достоверные различия в значениях ингибирующих концентраций ЕС50 между штаммами (см. таблицу). Кроме того, не было выявлено токсического эффекта Ф в исследованном диапазоне концентраций при инкубации с клетками как в течение 40 ч, так и при более длительной экспозиции (144 ч). Таким образом, ингибирующая активность Ф сохраняется в отношении появляющихся новых вариантов SARS-CoV-2.
Анализ мутаций вариантов SARS-CoV-2 показал, что изменения в основном затрагивают поверхностный S-белок вириона коронавируса, что приводит к существенному снижению активности нейтрализующих антител [29], специфически связывающихся с рецептор-связывающим доменом S-белка. Однако изменения в белках, играющих ключевую роль в реализации генома вируса (RdRp, протеазы и др.), не столь существенны и в основном находятся вдали от активных центров. Вследствие этого низкомолекулярные ингибиторы соответствующих мишеней не теряют своей ингибирующей активности в отношении SARS-CoV-2 (31, 32]. Виду того, что Ф является ингибитором RdRp, снижения его ингибирующей активности в отношении новых вариантов SARS-CoV-2 не происходит.
Тем не менее, Ф ингибирует SARS-CoV-2, в отличие от вируса гриппа и других коронавирусов [4, 33], в достаточно высоких концентрациях, как минимум на порядок выше, чем у других перспективных ингибиторов, например, N-гидроксицитидина, использованного в нашем эксперименте в качестве положительного контроля, который практически полностью подавлял репродукцию SARS-CoV-2 во всем диапазоне исследованных концентраций.
Согласно ряду фармакокинетических исследований, такие концентрации в плазме вполне соответствуют наблюдаемым при применении Ф в стандартном режиме дозирования [1800 мг 2 раза в день (нагрузочная доза) и 800 мг 2 раза в день в последующие дни)] с Cthrough на 3-й день терапии около 200 мкМ [33]. Длительное и стабильное поддержание уровня Cthrough в плазме выше ЕС90, являющееся одним из условий, обеспечивающих стойкий противовирусный эффект препарата, достижимо не всегда и не у всей популяции пациентов, что может приводить к смазанным показателям клинической эффективности [34]. Однако снижение уровня Cthrough не всегда означает снижение эффективности Ф, концентрация активного метаболита – трифосфата Ф – в тканях может превышать ингибирующую концентрацию в отношении РНК полимеразы SARS-CoV-2 [35, 36]. Моделирование фармакокинетики вместе с уровнями концентрации активного метаболита Ф в тканях показывает, что при стандартном режиме дозирования (1600/800 мг) достаточный уровень в тканях (20 мкМ трифосфата Ф) сохраняется как минимум в течение 3 дней, а при режиме 1600/1200 мг – до 9 дней [37]. Таким образом, применение Ф в более высоких дозах потенциально могло бы улучшить показатели его эффективности при новой коронавирусной инфекции, однако в таком случае потребуется дополнительная оценка безопасности его применения.
Заключение
В исследовании 3 разных вариантов вируса SARS- CoV-2 было показано, что эволюционные изменения вируса не привели к существенным изменениям противовирусной активности Ф in vitro. Полученные ингибирующие концентрации в целом соответствуют результатам предыдущих исследований. Таким образом, Ф остается эффективным противовирусным средством, в том числе в отношении новых вариантов SARS-CoV-2.
Литература
- Kupriyanov S.V., Semenova Y.V., Semenova L.M. New Coronavirus Infection. Today’S View of the Pandemic. Acta medica Eurasica 2021; (3): 48–59. DOI: 10.47026/2413-4864-2021-3-48-59
- Sangawa H., Komeno T., Nishikawa H., Yoshida A., Takahashi K., Nomura N. et al. Mechanism of action of T-705 ribosyl triphosphate against influenza virus RNA polymerase. Antimicrob. Agents Chemother. 2013; 57(11): 5202–8.
- Jin Z., Smith L.K., Rajwanshi V.K., Kim B., Deval J. The ambiguous base-pairing and high substrate efficiency of T-705 (Favipiravir) Ribofuranosyl 5’-triphosphate towards influenza A virus polymerase. PLoS One 2013; 8(7): e68347.
- Baranovich T., Wong S.-S., Armstrong J., Marjuki H., Webby R.J,. Webster R.G. et al. T-705 (favipiravir) induces lethal mutagenesis in influenza A H1N1 viruses in vitro. J. Virol. 2013; 87(7): 3741–51.
- Escribano-Romero E., Jiménez de Oya N., Domingo E., Saiz J.C. Extinction of West Nile Virus by Favipiravir through Lethal Mutagenesis. Antimicrob. Agents Chemother. 2017; 61(11): e01400-17. doi: 10.1128/AAC.01400-17
- de Ávila A.I., Gallego I., Soria M.E., Gregori J., Quer J., Esteban J.I. et al. Lethal Mutagenesis of Hepatitis C Virus Induced by Favipiravir. PLoS One 2016; 11(10): e0164691–e016461. https://pubmed.ncbi.nlm.nih.gov/ 27755573
- Julander J.G., Shafer K., Smee D.F., Morrey J.D., Furuta Y. Activity of T-705 in a hamster model of yellow fever virus infection in comparison with that of a chemically related compound, T-1106. Antimicrob. Agents Chemother. 2009; 53(1): 202–9.
- Gowen B.B., Wong M.-H., Jung K.-H., Sanders A.B., Mendenhall M., Bailey K.W. et al. In vitro and in vivo activities of T-705 against arenavirus and bunyavirus infections. Antimicrob. Agents Chemother. 2007; 51(9): 3168–76.
- Mendenhall M., Russell A., Juelich T., Messina .EL., Smee D.F., Freiberg A.N. et al. T-705 (favipiravir) inhibition of arenavirus replication in cell culture. Antimicrob. Agents Chemother. 2011; 55(2): 782–7.
- Rocha-Pereira J., Jochmans D., Dallmeier K., Leyssen P., Nascimento M.S.J., Neyts J. Favipiravir (T-705) inhibits in vitro norovirus replication. Biochem. Biophys. Res. Commun. 2012; 424(4): 777–80.
- Shannon A., Selisko B., Le N.-T.T., Huchting J., Touret F., Piorkowski G. et al. Rapid incorporation of Favipiravir by the fast and permissive viral RNA polymerase complex results in SARS-CoV-2 lethal mutagenesis. Nat. Commun. 2020; 11(1): 4682. https://doi.org/10.1038/s41467-020-18463-z
- Driouich J.-S, Cochin M., Lingas G., Moureau G., Touret F., Petit P.-R. et al. Favipiravir antiviral efficacy against SARS-CoV-2 in a hamster model. Nat. Commun. 2021; 12(1): 1735. https://doi.org/10.1038/s41467-021-21992-w
- Wang M., Cao R., Zhang L., Yang X., Liu J., Xu M. et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res. 2020; 30(3): 269–71. https://doi.org/10.1038/ s41422-020-0282-0
- Jeon S., Ko M., Lee J., Choi I., Byun S.Y., Park S. et al. Identification of Antiviral Drug Candidates against SARS-CoV-2 from FDA-Approved Drugs. Antimicrob. Agents Chemother. 2020; 64(7): e00819–20. doi: 10.1128/AAC.00819-20
- Kaptein S.J.F., Jacobs S., Langendries L., Seldeslachts L., Ter Horst S., Liesenborghs L. et al. Favipiravir at high doses has potent antiviral activity in SARS-CoV-2-infected hamsters, whereas hydroxychloroquine lacks activity. Proc. Nat. Acad. Sci. USA 2020; 117(43): 26955–65. doi: 10.1073/pnas.2014441117
- Ruzhentsova T.A., Oseshnyuk R.A., Soluyanova T.N., Dmitrikova E.P., Mustafaev D.M., Pokrovskiy K.A. et al. Phase 3 trial of coronavir (favipiravir) in patients with mild to moderate COVID-19. Am. J. Transl. Res. 2021; 13(11): 12575–87. https://pubmed.ncbi.nlm.nih.gov/34956474
- I vashchenko A.A., Dmitriev K.A., Vostokova N.V., Azarova V.N., Blinow A.A., Egorova A.N. et al. Avifavir for Treatment of Patients With Moderate Coronavirus Disease 2019 (COVID-19): Interim Results of a Phase II/III Multicenter Randomized Clinical Trial. Clin. Infect. Dis. an Off. Publ. Infect. Dis. Soc. Am. 2021; 73(3): 531–4. doi: 10.1093/cid/ciaa1176
- Shinkai M., Tsushima K., Tanaka S., Hagiwara E., Tarumoto N., Kawada I. et al. Efficacy and Safety of Favipiravir in Moderate COVID-19 Pneumonia Patients without Oxygen Therapy: A Randomized, Phase III. Clinical Trial. Infect. Dis. Ther. 2021; 10(4): 2489–509. doi: 10.1007/s40121-021-00517-4
- Manabe T., Kambayashi D., Akatsu H., Kudo K. Favipiravir for the treatment of patients with COVID-19: a systematic review and meta-analysis. BMC Infect. Dis. 2021; 21(1): 489. doi: 10.1186/s12879-021-06164-x
- Hassanipour S., Arab-Zozani M., Amani B., Heidarzad F., Fathalipour M., Martinez-de-Hoyo R. The efficacy and safety of Favipiravir in treatment of COVID-19: a systematic review and meta-analysis of clinical trials. Sci. Rep. 2021; 11(1): 11022. doi: 10.1038/s41598-021-90551-6
- Finberg R.W., Ashraf M., Julg B., Ayoade F., Marathe J.G., Issa N.C. et al. US201 Study: A Phase 2, Randomized Proof-of-Concept Trial of Favipiravir for the Treatment of COVID-19. Open. Forum Infect Dis. 2021; 8(12): 563. doi: 10.1093/ofid/ofab563
- Временные методические рекомендации Минздрава России «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». М., 2021; версия 14. 233 с. https://base.garant.ru/403310712/?
- Ömeroğlu Ş.K., Temel F., Altun D., Öztop B. Effects of hydroxychloroquine and favipiravir on clinical course in outpatients with COVID-19. Turkish J. Med. Sci. 2021; 51(6): 2827–34. doi: 10.3906/sag-2101-146
- Bosaeed M., Alharbi A., Mahmoud E., Alrehily S., Bahlaq M., Gaifer Z. et al. Efficacy of favipiravir in adults with mild COVID-19: a randomized, double-blind, multicentre, placebo-controlled clinical trial. Clin. Microbiol. Infect. 2022. https://www.sciencedirect.com/science/article/pii/S1198743X2100 7345
- https://www.appilitherapeutics.com/newsfeed/Appili-Therapeutics-Provides-Update-on-Phase-3-PRESECO-Clinical-Trial-Evaluating-Avigan%C2% AE%2FReeqonus%E2%84%A2
- Solaymani-Dodaran M., Ghanei M., Bagheri M., Qazvini A., Vahedi E., Hassan Saadat S. et al. Safety and efficacy of Favipiravir in moderate to severe SARS-CoV-2 pneumonia. Int Immunopharmacol. 2021; 95: 107522. doi: 10.1016/j.intimp.2021.107522
- Case J.B., Bailey A.L., Kim A.S., Chen R.E., Diamond M.S. Growth, detection, quantification, and inactivation of SARS-CoV-2. Virology 2020; 548: 39–48. https://pubmed.ncbi.nlm.nih.gov/32838945
- Jureka A.S., Silvas J.A., Basler C.F. Propagation, Inactivation, and Safety Testing of SARS-CoV-2. Viruses 2020; 12(6): 622 doi: 10.3390/v12060622
- Bojkova D., Widera M., Ciesek S., Wass M.N., Michaelis M., Cinatl J. Reduced interferon antagonism but similar drug sensitivity in Omicron variant compared to Delta variant of SARS-CoV-2 isolates. Cell Res. 2022. https://doi.org/10.1038/s41422-022-00619-9
- Tomita Y., Takeda M., Matsuyama S. The anti-influenza virus drug favipiravir has little effect on replication of SARS-CoV-2 in cultured cells. Antimicrobial agents and chemotherapy. 2021; 65: e00020-21 doi: 10.1128/AAC.00020-21
- Takashita E., Kinoshita N., Yamayoshi S., Sakai-Tagawa Y., Fujisaki S., Ito M. et al. Efficacy of Antibodies and Antiviral Drugs against Covid-19 Omicron Variant. New Engl. J. Med. 2022. 386(10): 995–8. doi: 10.1056/NEJMc2119407
- Vangeel L., Chiu W., De Jonghe S., Maes P., Slechten B., Raymenants J. et al. Remdesivir, Molnupiravir and Nirmatrelvir remain active against SARS-CoV-2 Omicron and other variants of concern. Antiviral Res. 2022; 198: 105252. doi: 10.1016/j.antiviral.2022.105252
- Wang Y., Zhong W., Salam A., Tarning J., Zhan Q., Huang J.-A. et al. Phase 2a, open-label, dose-escalating, multi-center pharmacokinetic study of favipiravir (T-705) in combination with oseltamivir in patients with severe influenza. EBioMedicine 2020; 62: 103125. http://europepmc.org/abstract/ MED/33232871
- Irie K., Nakagawa A., Fujita H., Tamura R., Eto M., Ikesue H. et al. Pharmacokinetics of Favipiravir in Critically Ill Patients With COVID-19. Clin. Trans. Sci. 2020; 13(5): 880–5. doi: 10.1111/cts.12827
- Du Y.-X., Chen X.-P. Favipiravir: Pharmacokinetics and Concerns About Clinical Trials for 2019-nCoV Infection. Clin. Pharmacol. Ther. 2020; 108(2): 242–7. doi: 10.1002/cpt.1844
- Arshad U., Pertinez H., Box H., Tatham L., Rajoli R.K.R., Curley P. et al. Prioritization of Anti-SARS-Cov-2 Drug Repurposing Opportunities Based on Plasma and Target Site Concentrations Derived from their Established Human Pharmacokinetics. Clin. Pharmacol. Ther. 2020; 108(4): 775–90. doi: 10.1002/cpt.1909
- Pertinez H., Rajoli K.R., Khoo S.H., Owen A. Pharmacokinetic modelling to estimate intracellular favipiravir ribofuranosyl-5’-triphosphate exposure to support posology for SARS-CoV-2. J. Antimicrob. Chemother. 2021; 76 (Suppl 1). DOI:10.1093/jac/dkab135
Об авторах / Для корреспонденции
Крышень Кирилл Леонидович – руководитель отдела специфической токсикологии и микробиологии, НПО «ДОМ ФАРМАЦИИ», Ленинградская обл., Россия; kryshen.kl@doclinika.ru; http://orcid.org/ 0000-0003-1451-7716
Волок Виктор Петрович – младший научный сотрудник лаборатории полиомиелита и других ЭВИ с референс-центром ВОЗ по надзору за полиомиелитом, отдел актуальных и вновь возникающих инфекций с пандемическим потенциалом, ФНЦИРИП им. М.П. Чумакова РАН (Институт полиомиелита), Москва, Россия; volok_vp@chumakovs.su; http://orcid.org/0000-0002-9659-723X
Шустова Елена Юрьевна – научный сотрудник лаборатории полиомиелита и других ЭВИ с референс-центром ВОЗ по надзору за полиомиелитом, отдел актуальных и вновь возникающих инфекций с пандемическим потенциалом, ФНЦИРИП им. М.П. Чумакова РАН (Институт полиомиелита), Москва, Россия; shustova_eu@chumakovs.su; http://orcid.org/0000-0003-1314-0152
Шипунов Георгий Александрович – специалист отдела доклинических исследований АО «Р-Фарм», Москва, Россия; shipunov@rpharm.ru; http://orcid.org/0000-0003-4495-7050
Филон Ольга Владимировна – директор департамента доклинической и клинической разработки, АО «Р-Фарм», Москва, Россия; ov.filon@rpharm.ru; http://orcid.org/0000-0002-8735-7429
Самсонов Михаил Юрьевич, к.м.н., медицинский директор АО «Р-Фарм», Москва, Россия; shipunov@rpharm.ru; http://orcid.org/0000-0003-2685-1623
Шипаева Елена Владимировна – к.м.н., руководитель отдела доклинических исследований, АО «Р-Фарм», Москва, Россия; shipaeva@rpharm.ru; http://orcid.org/0000-0002-5953-984X
Похожие статьи




