В 2003 г. ВОЗ была поставлена задача элиминации кори (К). Теоретическая и практическая возможности элиминации К были обусловлены следующими факторами: возникновением стойкого иммунитета после перенесенного заболевания К, единым в мире антигенным вариантом вируса К, типичной клинической картиной заболевания, отсутствием вирусоносительства и других резервуаров в природе, кроме человека. К практическим достижениям в борьбе с К в мире и в Российской Федерации относятся создание и применение отечественной эффективной живой коревой вакцины (ЖКВ) с 1967 г., резкое снижение заболеваемости К, практически полная ликвидация смертности, обосновывающие возможность ликвидации эндемичной К в конкретном регионе. В Российской Федерации в соответствии с разработанной программой стояла задача ликвидации К к 2010 г.
Однако в связи с осложнением эпидемической ситуации по К в странах Европы, учитывая растущее число отдельных случаев заболевания и формирование ряда вспышек К, в частности в центральной и западной частях региона, 60-я сессия Европейского регионального бюро ВОЗ перенесла достижение региональных целей элиминации К и краснухи с 2010 на 2015 г. [1].
Однако и эта конечная цель программы так и не была достигнута из-за недостаточного уровня популяционного иммунитета, что привело к необходимости разработки в Российской Федерации дополнительных профилактических и противоэпидемических мероприятий, реализация которых происходит в настоящее время [2–4].
Важно отметить, что даже в периоды благополучия эпидемический процесс возникновения К в течение года не прерывался только на 3 из 85 территорий – в Москве, Московской области и Республике Дагестан, которые ежегодно определяли суммарную заболеваемость К в стране и считались территориями повышенного риска, требовавшими разработки и внедрения дополнительных профилактических мероприятий [5].
В стране в годы подъема заболеваемости К (2014 и 2019 г.) показатель достигал 3,3 и 3,1 на 100 тыс. населения соответственно; в годы спада (2015 и 2016 г.) он снижался до 0,58 и 0,12 на 100 тыс. населения. Эпидемический процесс К во многом определили локальные вспышки этой инфекции, которые регистрировались как в медицинских организациях, так и в образовательных учреждениях, преимущественно среди непривитых детей и взрослых [6–9].
Актуальность проблемы внутрибольничного заражения К обусловлена не только реализацией программы элиминации К, но и необходимостью выполнения одной из стратегических задач здравоохранения в рамках Национальной концепции профилактики инфекций, связанных с оказанием медицинской помощи, – обеспечения качества медицинской помощи и создания безопасной среды пребывания для пациентов и персонала [10].
Цель исследования – анализ заболеваемости К в детской больнице для определения стратегических направлений контроля внутрибольничного распространения этой инфекции.
Материалы и методы
Анализ заболеваемости К на территории Москвы и ВАО Москвы проводили по данным формы федерального государственного статистического наблюдения № 2 за 2007–2019 гг. Для анализа внутрибольничных вспышек коревой инфекции использовали акты эпидемиологического расследования Территориального отдела Управления Роспотребнадзора в ВАО Москвы за 2017 г. и оперативные донесения о случае К, поступившие из филиала ФБУЗ «Центр гигиены и эпидемиологии в городе Москве» в ВАО Москвы. Были проанализированы 52 электронные карты заболевших К, оформленные в автоматизированной информационной системе по регистрации инфекционной заболеваемости (АИС «ОРУИБ») и 52 карты эпидемиологического расследования случаев К или случаев, подозрительных на эту инфекцию.
В работе использовали эпидемиологический и статистический методы. Исследование носило ретроспективный характер. При анализе полученных данных использовали общепринятые статистические приемы. Для анализа заболеваемости К рассчитывали показатели инцидентности и среднемноголетний уровень заболеваемости (СМУ). Для оценки активности эпидемических очагов К рассчитывали индекс (ИО) и коэффициент очаговости (КО), а также показатели воспроизводства инфекции (репродуктивные показатели). КО рассчитывался как доля (%) очагов с вторичными заболеваниями к общему числу зарегистрированных очагов. ИО определялся как среднее число заболеваний в одном очаге. Показатель воспроизводства инфекции, или репродуктивный показатель (R), определяли путем деления суммы вторичных случаев на число очагов с распространением. Достоверность различий показателей заболеваемости корью в Москве и ВАО оценивали по тесту Стьюдента. Различия считали достоверными при р < 0,05. Расчеты проводили с помощью пакета прикладных программ Microsoft Office 2013.
Для подтверждения диагноза К проводили лабораторную диагностику сыворотки крови заболевших методом иммуноферментного анализа в вирусологической лаборатории Регионального центра по надзору за корью и краснухой (Москва) путем выявления специфических антител, относящихся к IgМ. Взятие крови для исследований осуществлялb на 4–5-й день с момента появления сыпи. Результаты лабораторного исследования отражались в электронных картах заболевших R, оформленных в АИС «ОРУИБ», и в картах эпидемиологического расследования случая R или подозрительного на эту инфекцию, которые подвергались анализу.
Результаты
Первая волна коревой инфекции на территории Москвы была зарегистрирована в период с 2011 по 2015 г. (5 лет) со СМУ 3,06 ± 0,32 (рис. 1). Этот подъем заболеваемости был связан с локальными вспышками инфекции при ее заносе с неблагополучных территорий [2]. Далее, после некоторого снижения з в 2016 г., начиная с 2017 г. снова был зарегистрирован резкий подъем заболеваемости за счет локальных эпидемических вспышек К в различных организациях [10–13].
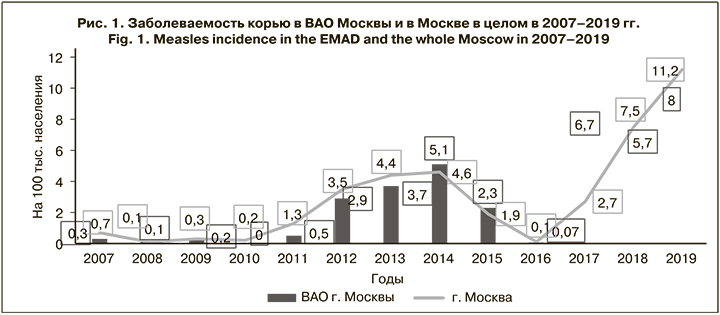
Заболеваемость К в ВАО несколько отличалась от таковой в целом по Москве – по уровню, году начала подъема и СМУ. При этом наиболее высокий ее уровень, как и в Москве, пришелся на 2019 г. Так, показатель заболеваемости корью по ВАО составил в 2019 г. 11,2 на 100 тыс. населения, а по Москве – 8,0 на 100 тыс. (t < 2; p > 0,05). При детальном анализе эпидемического процесса коревой инфекции в ВАО было установлено, что подъем заболеваемости в 2017 г. обусловлен локальными вспышками К в одной из детских больниц.
При расследовании крупного очага К в детской медицинской организации (МО) на территории ВАО в 2017 г. было установлено, что заболеваемость представляет собой не единый очаг, а серию локальных вспышек, вызванных периодическими заносами инфекции в непрофильные отделения. Всего от 5 источников инфекции заразились и заболели 47 чел. (см. таблицу).
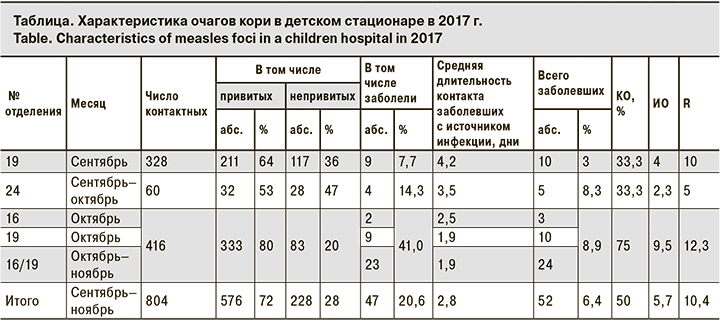
Все заболевшие К лица на момент госпитализации не были привиты или не имели документированных сведений о вакцинации. В последующем 2 детей, достигших прививочного возраста, вакцинировали в стационаре по эпидемическим показаниям (на 3-й и 5-й день от момента контакта с источником инфекции), что не смогло предотвратить их заражение и заболевание. Дети заболели на 7-й и 9-й день после контакта с первым заболевшим.
В возрастной структуре заболевших 46,0% составили дети в возрасте от 6 мес. до 1 года, 30,7% – дети 1–2 лет, остальные 23,3% были старше двух лет.
В первой вспышке распространение инфекции произошло при госпитализации ребенка с симптомами острой респираторной вирусной инфекции (ОРВИ) из Центра содействия семейному воспитанию в отделение кишечных инфекций № 19, где он послужил источником инфекции для 9 чел. (8 детей и 1 взрослого – сопровождающего лица).
Во втором очаге (отделение № 24) источником инфекции стал «пропущенный случай К». Ребенок поступил в палатное отделение стационара с диагнозом «ОРВИ, герпетическая ангина, экзантема». Источник этой вспышки был установлен в процессе ретроспективного санитарно-эпидемиологического расследования ситуации с анализом историй болезни детей, находившихся на лечении в эпидемиологически значимый период. В этом отделении корью заразились 4 ребенка.
Третий и четвертый заносы К произошли одномоментно в 2 отделения, расположенные в одном корпусе на 4-м и 5-м этажах (рис. 2, см. на вклейке). В одном случае (отделение № 16) мать ребенка, послужившего источником инфекции, преднамеренно скрыла, что сама в течение последнего месяца переболела К, а ее ребенок был контактным, в результате этого в отделении на 4-м этаже было зарегистрировано 2 случаи заболевания среди пациентов, контактных с больным К. Во втором случае (отделение № 19) в результате заноса инфекции произошло ее распространение среди 9 детей: 8 пациентов отделения, расположенного на 5-м этаже, и 1 ребенка из другого отделения. Дополнительным фактором, который способствовал распространению коревой инфекции в больнице, стал ряд дефектов в маршрутизации пациентов по стационарным и диагностическим отделениям.
Пятый случай заноса кори послужил источником инфекции для пациентов 2 отделений детской больницы. В результате контактов между пациентами заболели 23 чел. (рис. 3, см. на вклейке). В этой ситуации тоже были отмечены дефекты в маршрутизации пациентов, которые способствовали распространению коревой инфекции в МО.
Только у 1 ребенка, заболевшего К (источником для которого стал занос инфекции № 4), было проведено исследование методом ПЦР на антиген вируса в моче, в результате которого был выделен вирус К генотипа B3 Dublin, который имел африканское происхождение и характеризовался широкой циркуляцией в ряде стран Европейского региона на протяжении 2016–2017 гг., а также активно циркулировал в Москве в этот же период [5].
При оценке эффективности ряда мероприятий больничной гигиены в детской МО были выявлены нарушения в системе организации воздухообмена, очистки и дезинфекции воздуха. Так, вытяжные вентиляционные системы, которые функционировали в корпусе, не были оборудованы устройствами обеззараживания воздуха или фильтрами тонкой очистки, а часть вентиляционных установок вовсе находилась в нерабочем состоянии, что создало дополнительные риски распространения инфекции в МО.
Обсуждение
По результатам проведенного исследования были выявлены следующие причины и условия распространения кори в стационаре: низкая привитость пациентов и сопровождающих лиц, отсутствие информации о прививках против К в направительных документах, поздняя диагностика К у первых и последующих заболевших (в одном отделении выявление источника вспышки произошло только в процессе ретроспективного расследования), а также ряд дефектов в маршрутизации пациентов в лечебном учреждении и нарушения в выполнении мероприятий по обеспечению гигиены больничной среды.
Данные факторы являются весьма существенными в формировании внутрибольничных очагов К. Аналогичные результаты были представлены и в других исследованиях [7, 10, 14–17]. Соответственно, вектор профилактических и противоэпидемических мероприятий должен быть направлен на устранение именно этих факторов.
Особенно важным направлением противоэпидемической работы является обеспечение высокого охвата населения прививками против К как в «индикаторных» возрастных группах (1 год и 6 лет), так и среди взрослого населения, а также в части вакцинации по эпидемическим показаниям в случае контакта с источником инфекции. Метаанализ эпидемиологических исследований напряженности иммунитета у населения России 2020 г. показал, что уровень коллективного иммунитета является недостаточным. Среди медицинских работников доля серопозитивных лиц составила 84,5% (95% ДИ 83,7–85,3), среди условно здорового населения – 75,4% (95% ДИ 74,1–76,6), что является фактором риска распространения вируса К как среди населения, так и среди медицинских работников [18].
Отдельное внимание должно быть уделено формированию высокой приверженности прививкам различных групп населения, что в настоящее время может быть эффективно реализовано, в том числе с использованием для мониторинга современных ресурсов в сфере социальных медиа и онлайн-СМИ, а также smart-технологий, применяемых в концепциях и программах «digital marketing» [19].
Риск заноса коревой инфекции в больницы, особенно в детские стационары, ВАО и Москвы в целом требует настороженности медицинского персонала в отношении ранней диагностики К. При этом настороженность сотрудников МО для выявления К требуется в периоды как высокой заболеваемости на территории, так и эпидемиологического благополучия, так как такой крупный мегаполис, как Москва, по данным Единой межведомственной информационно-статистической системы (ЕМИСС), имеет высокий коэффициент миграционного прироста и является территорией повышенного риска распространения этой инфекции [20].
Заключение
Таким образом, проведенное исследование показано, что коревая инфекция не теряет своей актуальности на современном этапе и по-прежнему остается инфекцией с высокой контагиозностью и риском воспроизводства среди непривитых детей и взрослых, что требует регулярного контроля ситуации и принятия новых управленческих решений. Основными причинами распространения К в детской больнице стали недостаточный уровень специфической защиты пациентов и сопровождающих лиц, низкая настороженность медицинского персонала в отношении этой инфекции, поздняя диагностика и позднее проведение противоэпидемических мероприятий, нарушения противоэпидемического режима в МО.
Для контроля ситуации по коревой инфекции необходимо обеспечить высокий охват населения прививками против К, оперативность при организации противоэпидемических мероприятий, обследование и изоляцию заболевших с симптомами К, а также постоянный мониторинг ситуации на территории дислокации МО.


