Несмотря на последние достижения высокотехнологичной хирургии, исход проведенных операций часто определяется инфекцией, связанной с оказанием медицинской помощи (ИСМП), которая является важнейшей причиной заболеваемости и смертности пациентов, перенесших трансплантацию органов [1–7].
В последние годы растущей проблемой как в мире, так и в нашей стране стали ИСМП, вызванные внутрибольничными штаммами Acinetobacter baumannii и Klebsiella pneumoniaе с множественной лекарственной устойчивостью [8–14]. Кроме того, эти патогены могут длительное время сохраняться в окружающей среде стационаров и формировать биопленки на различных поверхностях [15–20]. В некоторых странах уже проводится тщательный мониторинг распространения этих видов грамотрицательных бактерий на предметах обихода в стационарах, а также в качестве контаминантов кожи персонала и пациентов [21–24].
Данные отдельных исследований по профилактике ИСМП в кардиохирургических стационарах, включающей введение ежедневной обработкой кожи пациентов 2–4% водным раствором хлоргексидина, свидетельствуют об уменьшении риска возникновения послеоперационных осложнений микробной этиологии при снижении общей обсемененности кожи условно патогенными микроорганизмами [25–35].
Так как для больных, перенесших трансплантацию органов, наибольшую опасность представляют ИСМП, вызванные полирезистентными штаммами Acinetobacter baumannii и Klebsiella pneumoniaе, определенный интерес представляет влияние показателей высеваемости этих контаминантов как с кожи пациентов, так и с окружающих их предметов [36–38].
Цель исследования – оценить значимость контаминации кожных покровов пациентов после ортотопической трансплантации сердца (ОТТС) и окружающей их внешней среды представителями рода Acinetobacter и Klebsiella для риска развития бактериальной инфекции крови (БИК), связанной с этими возбудителями.
Материалы и методы
Исследования проводили в период с января 2013 г. по декабрь 2016 г. В работу включена информация о 194 пациентах после ОТТС, средний возраст которых составлял 45 лет.
Бактериологические исследования для выявления микроорганизмов рода Acinetobacter и/или Klebsiella проводили в ранний послеоперационный период, начиная с третьих суток в течение 2 нед. после операции, так как в этот срок наиболее часто у больных проявлялись первые признаки развития БИК.
У пациентов ежедневно исследовали пробы крови, смывы с кожи (в зоне послеоперационного шва, локтевого сгиба, кистей рук, груди и области прилегания катетеров) на наличие на коже указанных видов микроорганизмов.
Для выявления контаминации объектов внешней среды Acinetobacter и Klebsiella использовали смывы с катетеров, мебели, стоек капельниц, аппаратуры, кранов раковин, постельного белья, а также со спецодежды, защитных масок и кистей рук ухаживающего персонала.
Схемы дезинфекционной обработки оставались стандартными для данного стационара все время проведения исследования и соответствовали нормативным требованиям. Выделение микроорганизмов проводили общепринятыми бактериологическими методами. Для идентификации возбудителей использовали панели BDCristal, базы данных BBLCristalMIND и панели Micrо ScanWalkAway 96 plusSystem (США).
Если хотя бы в одной из сделанных проб обнаруживали Klebsiella или Acinetobacter, пациент считался условно контаминированным.
Для статистической обработки данных использовали программный пакет для ПК Statistica 10 («StatSoft Inc.», США).
Проведен ретроспективный анализ данных пациентов. Сравнение непрерывных переменных и различий пропорций качественных признаков (факторов) осуществляли посредством t-теста Стьюдента и критерия χ2 Пирсона. Двусторонний уровень р < 0,05 выбран для обозначения статистической значимости (общепринятый для медицинских исследований).
Результаты
В работе приведены данные обследования 194 пациентов после ОТТС, которые первоначально составили 2 группы. В 1-ю были включены 132 (68%) пациента с контаминацией кожи и/или внешней среды, во 2-ю – 62 (32%) пациента без контаминации.
В обеих группах были зарегистрированы случаи БИК, связанной с Klebsiella и Acinetobacter: в 1-й группе – у 41 (31,1%) пациента, во 2-й – у 5 (8,1%). У большинства пациентов после проведения ОТТС Klebsiella и/или Acinetobacter выделяли и с кожи, и(или) из внешней среды, при этом в 1-й группе БИК встречалась почти в 4 раза чаще, чем во 2-й.
Для более глубокого анализа влияния контаминации представителями Acinetobacter или Klebsiella на возможность развития БИК, вызванной этими микроорганизмами, среди пациентов 1-й группы были выделены 3 подгруппы в зависимости от наличия контаминации только кожи, только внешней среды и сочетанной контаминации кожи и внешней среды (табл. 1).
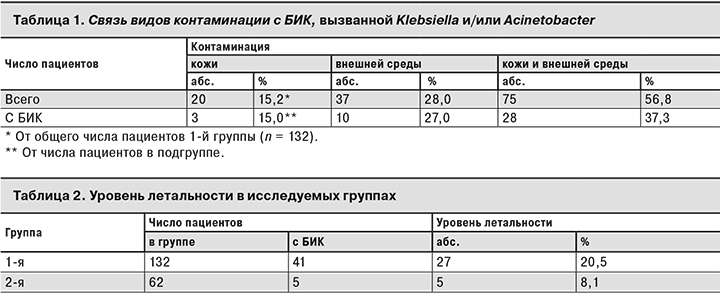
Как видно из табл. 1, у большинства пациентов микроорганизмы Klebsiella и/или Acinetobacter выделяли с кожи и из внешней среды. Контаминированная внешняя среда вокруг пациента увеличивала вероятность возникновения БИК, а присоединение обсеменения кожи приводило к резкому увеличению числа БИК у пациентов.
Необходимо отметить, что в некоторых случаях при развитии БИК у условно контаминированных пациентов из крови выделяли не только Klebsiella и/или Acinetobacter, но и другие микроорганизмы (от 1 до 4 видов), что значительно утяжеляло течение заболевания и вызывало затруднения при проведении антибиотикотерапии.
Как видно из табл. 2, контаминация пациентов Klebsiella и/или Acinetobacter сопутствует увеличению летальности пациентов более чем в 2 раза.
Выводы
- Контаминация кожи представителями рода Acinetobacter или Klebsiella выступает не только как статистически значимый фактор риска, но и как предиктор развития БИК, ассоциированной с этими микроорганизмами.
- Раннее выявление контаминации кожи представляется эффективным прогностическим методом, способствующим корректному подбору схемы антибиотикопрофилактики БИК.
- Активный микробиологический контроль состояния кожи пациентов в раннем послеоперационном периоде поможет предотвратить возникновение БИК в этот период.
* * *
Доложено на Ежегодном конгрессе с международным участием «Контроль и профилактика инфекций, связанных с оказанием медицинской помощи (ИСМП–2017)». Москва, 14–15 ноября 2017 г. (симпозиум «Эпидемиология и профилактика гнойно-септических инфекций в хирургии и реанимации»).


