Дифтерийная инфекция (ДИ) отличается клиническим многообразием от бессимптомного течения (бактерионосительство) до очень тяжелых форм [1–5].
Актуальность проблемы заключается в постоянной циркуляции штаммов в окружающей человека среде. Классическая дифтерия, вызванная C. diphtheria (КБД) ранее рассматривалась как исключительно антропонозная инфекция. Существование естественного резервуара ДИ проявляется клиническими случаями заболевания повсеместно и наличием эндемичных очагов высокой заболеваемости в Африке к югу от Сахары, в Индии и Индонезии. В 2013 г. дифтерия привела к гибели 3300 человек.
 До сих пор остается открытым вопрос о наличии связи между массовым одномоментным выводом советских войск в 1990 г. из эндемичного по ДИ Афганистана и началом эпидемии дифтерии в 90-х годах в России и в республиках СССР. По оценкам Красного Креста, в СССР в 1991 г. было 2000 случаев заболевания дифтерией. К 1998 г. эти цифры выросли в 100 (!) раз, и число смертельных исходов превысило 6000 [2, 6–9].
До сих пор остается открытым вопрос о наличии связи между массовым одномоментным выводом советских войск в 1990 г. из эндемичного по ДИ Афганистана и началом эпидемии дифтерии в 90-х годах в России и в республиках СССР. По оценкам Красного Креста, в СССР в 1991 г. было 2000 случаев заболевания дифтерией. К 1998 г. эти цифры выросли в 100 (!) раз, и число смертельных исходов превысило 6000 [2, 6–9].
Наблюдается постоянная трансформация циркулирующих штаммов с изменением степени их патогенности [10–14]. Родственная по микробиологическим характеристикам Corynebacteruium ulcerans, постоянно циркулирующая в окружающей среде, вызывает сходное по клинике с классической дифтерией заболевание [15–20]. Описаны случаи экссудативного фарингита и острых респираторных заболеваний, вызванных Corynebacteruium pseudodiphtheria, Nondiphtheriae Corynebacterium species и нетоксигенными штаммами КБД. Клинические проявления заболеваний, вызванных этой группой возбудителей, могут быть различными: поражения кожи, клапанов сердца, урогенитального тракта, верхних и нижних дыхательных путей [21–28].
Ранее в медицинской практике C. ulcerans не рассматривалась как возбудитель болезни, пока в 2000 г. официально не была зарегистрирована смерть пациентки от заболевания, вызванного C. ulcerans [15]. Почти все случаи инфорования патогенными штаммами C. ulcerans сопровождались развитием сходных с классической дифтерией симптомов, что объясняется наличием в хромосоме возбудителя генов умеренного β-профага, несущего оперон дифтерийного токсина [16].
 В настоящее время заболевания, вызванные различными патогенными коринебактериями, постоянно регистрируются среди животных, находящихся рядом с человеком (зоопарки, фермы, охотоведческие хозяйства) с подтвержденной передачей возбудителя от больного животного человеку [18, 19, 28–32].
В настоящее время заболевания, вызванные различными патогенными коринебактериями, постоянно регистрируются среди животных, находящихся рядом с человеком (зоопарки, фермы, охотоведческие хозяйства) с подтвержденной передачей возбудителя от больного животного человеку [18, 19, 28–32].
Полученные материалы заставляют ученых пересмотреть точку зрения на дифтерию как на исключительно антропонозное заболевание, особенно после того, как J.M. Bonnet и N.T. Begg доказали возможность передачи инфекции от животного человеку [8].
Эпидемические подъемы дифтерии в мире регистрируются в среднем каждые 25 лет. Хронологическое описание цикличности эпидемий ДИ внутри и за пределами Российской Федерации подробно представлено в монографиях Л.А. Фаворовой и соавт. [1] и Н.М. Беляевой и соавт. [2].
Эпидемический надзор за дифтерией указывает на наличие изменчивости циркулирующих штаммов КБД с повышением их патогенности, а также на снижение уровня антитоксической защиты населения в России [9, 11, 14], в Европе и в мире [10, 24, 28–39].
Наиболее уязвимыми считаются возрастные группы старше 40 и младше 2 лет, лица с невыясненным прививочным анамнезом, в том числе мигранты и беженцы. У детей в возрасте до 5 лет и у взрослых старше 40 лет летальность при дифтерии достигает 20%. Неблагоприятные условия жизни в закрытых поселениях также способствуют циркуляции КБД среди мигрантов и беженцев [40].
С момента последней эпидемии 90-х годов XX века врачи утратили бдительность в отношении ДИ, не соблюдается требование обязательного исследования мазков из ротоглотки на наличие C. diphtheria при всех случаях лакунарной ангины [11].
Ситуация усугубляется тем, что антитоксический иммунитет не защищает от заболевания дифтерией, а только обеспечивает нейтрализацию выделяемого бактериями дифтерийного токсина (ДТ). Описаны случаи повторного заболевания дифтерией, в том числе «токсические» формы с летальными исходами у привитых детей и взрослых [40–43].
 До настоящего времени ДИ считается недостаточно изученной. Точная характеристика дифтерии как забытой, но не исчезнувшей болезни («Diphtheria: forgotten, but not gone»), данная N.R. Adler и соавт. [7], лучше всего подчеркивает актуальность существующей проблемы.
До настоящего времени ДИ считается недостаточно изученной. Точная характеристика дифтерии как забытой, но не исчезнувшей болезни («Diphtheria: forgotten, but not gone»), данная N.R. Adler и соавт. [7], лучше всего подчеркивает актуальность существующей проблемы.
В период эпидемии 90-х годов XX века 75% всех клинических случаев заболевания зарегистрированы в России. По итогам последней эпидемии медицинским сообществом были проделаны следующие шаги [41, 44–46]:
- в 2000 г. создан и функционирует межгосударственный комитет по изучению ДИ в Европе [44];
- сформулирована и одобрена ВОЗ к применению международная классификация ДИ предложенная Н. Бегг (1993) (табл. 1).
Предложенная классификация удобна, так как позволяет вести эпидемиологический учет клинических форм дифтерии, исходя из локализации первичного очага инфекции. Существенным ее недостатком является полное отсутствие упоминания о специфических дифтерийных поражениях внутренних органов.
Хотя в 1993 г. ВОЗ официально утвердила международную классификацию Н. Бегга, в России все это время практические врачи продолжали пользоваться классификацией дифтерии, сформулированной проф. С.Н. Розановым еще в 1949 г. (табл. 2) [1, 3, 5].
По итогам эпидемии в России было опубликовано около тысячи научных материалов по дифтерии, включая сотню работ диссертационного уровня, в которых критиковалась действующая российская классификация, вызывавшая нарекания и путаницу при систематизации больных по степени тяжести инфекционного процесса.
Даже в скорректированном разными авторами виде классификация по-прежнему не устраивала врачебное сообщество. В частности, сохранились устаревшие нозологические формы – субтоксическая, токсическая (I, II и III степеней) и гипертоксическая дифтерия – тогда как многочисленные исследования доказали, что дифтерийный токсин обнаруживается в крови при любых вариантах, включая субклиническое течение болезни (рис. 1).
При катаральном варианте дифтерии ротоглотки (старый термин «бактерионосительство») наблюдали нефрозы и миокардиты, а нарушения функциональных характеристик эритроцитов, по данным Е.Н. Копачковой, при субклинических вариантах болезни были выражены в большей степени, чем при манифестных. Следовательно, любой клинический вариант дифтерии является токсическим.
 Термин «бактерионосительство» не выдержал критики и в дальнейшем был изменен на «катаральный» вариант локализованной дифтерии ротоглотки.
Термин «бактерионосительство» не выдержал критики и в дальнейшем был изменен на «катаральный» вариант локализованной дифтерии ротоглотки.
Другим недостатком указанной классификации следует считать оценку тяжести течения болезни, исходя из площади отека подкожной клетчатки шеи (ПКШ), который определяет I, II или III степень тяжести «токсической» дифтерии. При локализации очага в ротоглотке развивающийся отек ПКШ, хотя и не удовлетворяет требованиям высокой чувствительности, помогает в первичной диагностике «токсических» форм дифтерии и позволяет определиться со стартовой дозой противодифтерийной сыворотки. Тогда как при дифтерии гортани и расположенных ниже дыхательных путей рыхлый, тестоватой консистенции отек над областью подчелюстных лимфоузлов и на шее может отсутствовать. Отек и сдавливание тканей развиваются внутри, что приводит к стенозу гортани с угрозой асфиксии, а это уже само по себе – признак тяжелой формы болезни. При дифтерийном крупе отсутствие наружного отека ПКШ часто приводит к диагностическим ошибкам [2]. Аналогичная ситуация имеет место при дифтерии половых органов с развитием выраженного отека половых органов, распространяющегося по наружной поверхности бедер [5].
Таким образом, существующая классификация специфический дифтерийный отек рассматривает как патогномоничный критерий тяжести течения дифтерии только при его появлении в области шеи, что, с нашей точки зрения, неправомерно.
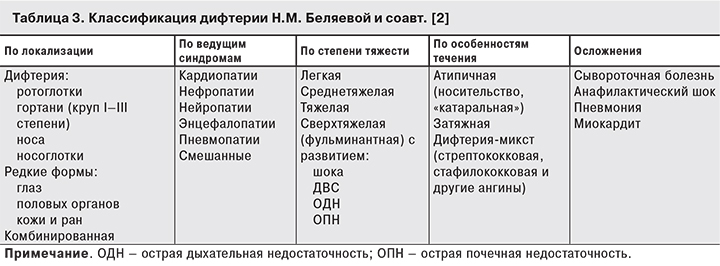
В 1996 г. Н.М. Беляевой и сотрудниками кафедры инфекционных болезней РМАПО была предложена российская классификация ДИ, которая предполагала принципиальную замену устаревшей классификации 50-х годов прошлого века (табл. 3).
Предложенная классификация была более удачной, так как авторы, перечислив специфические органные нарушения, развивающиеся при дифтерии, впервые указали, что кардиопатия, нефропатия и нейропатия являются не осложнениями (!), а ведущими синдромами заболевания.
Но эта классификация дифтерии, к сожалению, не была включена в стандарты нормативных документов Минздрава России, несмотря на ее достоинства [2–5].
В 90-е годы XX века уже было доказано, что при снижении иммунного надзора субклинические варианты дифтерии трансформируются в манифестные, в том числе в тяжелые формы болезни. Тогда же стало ясно, что за пределы первичного очага распространяется как ДТ, так и сам возбудитель – C. diphtheria [47, 48].
 В то же время в классификации в числе осложнений ДИ остались сывороточная болезнь и анафилактический шок, которые не имеют прямого отношения к КБД и представляют собой сопутствующую (ятрогенную) болезнь – реакцию на чужеродный белок противодифтерийной сыворотки. Близкие термины «кардиопатия» и «миокардит» авторы поместили в разных разделах классификации (см. табл. 3).
В то же время в классификации в числе осложнений ДИ остались сывороточная болезнь и анафилактический шок, которые не имеют прямого отношения к КБД и представляют собой сопутствующую (ятрогенную) болезнь – реакцию на чужеродный белок противодифтерийной сыворотки. Близкие термины «кардиопатия» и «миокардит» авторы поместили в разных разделах классификации (см. табл. 3).
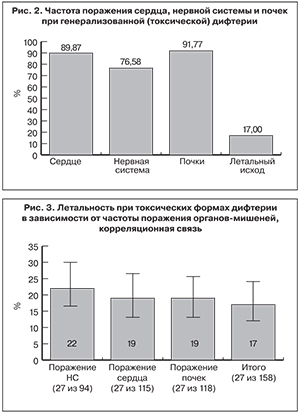
Проведенный нами ретроспективный анализ медицинских карт 158 больных токсическими формами ДИ, находившихся на лечении в инфекционной клинической больнице № 2 Департамента здравоохранения города Москвы, показал, что специфическое поражение сердца, нервной системы и почек встречается в абсолютном большинстве случаев (рис. 2).
Развитие триады поражения органов-мишеней определяло степень тяжести дифтерии и исход заболевания. У больных токсическими формами дифтерии летальность коррелировала с тяжестью поражения нервной системы (22%; r = 0,29), сердца (19%; r = 0,22) и почек (19%; r = 0,21) с уровнем значимости р < 0,001 (рис. 3).
Наше собственное исследование позволяет согласиться с выводами авторов, рассматривающих кардиопатию как специфическое, острое поражение сердца, затрагивающее все его анатомические отделы. Дифтерийный миокардит (с выраженным отеком сердечной мышцы, тоно- и миогенной дилатацией) сочетается с развитием перикардита (с подтвержденным высевом КБД из перикардиальной жидкости), поражением клапанного аппарата сердца, нарушениями проводимости (вплоть до полной атриовентрикулярной блокады) и острой сердечной недостаточности [49].
То же самое можно сказать о нервной системе. Дифтерийная полинейропатия протекает по демиелинизирующему или аксонально-демиелинизирующему типу и представляет собой специфическую картину острого поражения нервной системы (парезы черепно-мозговых нервов, бульбарный паралич, паралич диафрагмы, периферическая полинейропатия) [49–51].
Дифтерийное поражение почек (инфекционная нефропатия) от полиморфного мочевого синдрома (гематурия разной степени выраженности, протеинурия) с дисфункцией мочевого пузыря до острой почечной недостаточности) хорошо согласуется с современным международным термином «острое поражение почек» [52].
Согласно современным представлениям, причиной развития тяжелых форм ДИ является прорыв иммунного барьера [43, 44]. Специфические органные поражения как клинические признаки генерализации инфекционного процесса были описаны многими авторами [1–3, 5, 40–42,47–54].
Наиболее высокая плотность рецепторов ГС-ЭФР, с которыми взаимодействует ДТ, была обнаружена на клетках миокарда, нервной ткани, почек, надпочечников и эндотелия кровеносных сосудов, что объясняет избирательность повреждения токсином перечисленных органов [2].
О генерализации ДИ свидетельствует также работа С.Н. Кадыровой и соавт. [48], обнаруживших не токсин, а КБД (!) в ткани почек, перикарде, сердечной мышце, легочной ткани и головном мозге умерших больных.
Еще одним доказательством участия возбудителя в развитии специфического дифтерийного поражения тканей служат наши работы [53]. Как было установлено ранее, агрегационные свойства тромбоцитов в опытах in vitro снижаются в большей степени при инкубации клеток с надосадочной жидкостью, содержащей комбинацию ДТ и других продуктов жизнедеятельности КБД в сравнении с очищенным ДТ.
Оба варианта российских классификаций излишне детализированы, что усложняет их практическое применение.
Слабым звеном существующей классификации остается привязка дозы противодифтерийной сыворотки (ПДС) к клинической форме и величине отека ПКШ (без учета тяжести состояния больного), что приводило к рассогласованному назначению лечебных доз. В России во время последней эпидемии дифтерии курсовые дозы ПДС колебались в интервале от 100 000 МЕ до нескольких миллионов (!) МЕ [2, 9].
При старте сывороточной терапии следует руководствоваться принципом оптимально достаточной дозы ПДС. Отек ПКШ служит удобным критерием диагностики токсической дифтерии у постели больного и определения стартовой дозы ПДС.
Дальнейшее введение сыворотки должно проводиться, исходя из оценки количества анатомических областей, покрытых дифтерийными пленками, с учетом скорости обратного развития отека и исчезновения пленок. Окончательно определиться с тяжестью дифтерийного процесса поможет оценка состояния пораженных органов-мишеней.
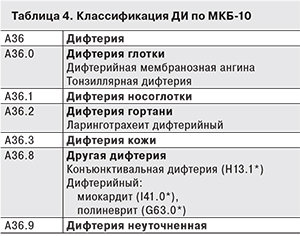
Не лишена недостатков и существующая международная классификация болезней (МКБ-10) с поправками 2016 г. Согласно ей, дифтерия носа, дифтерия половых органов и комбинированная дифтерия кодируются «A36.8. Другая дифтерия», вместе с «дифтерийным миокардитом» и «полиневритом» (табл. 4).
С нашей точки зрения, комбинированную дифтерию, дифтерию носа и дифтерию половых органов правильнее обозначать отдельными кодами, так как анатомическая локализация и площадь дифтерийных пленок влияют на тяжесть заболевания [1–3, 5, 43, 45–51].
Далее, в МКБ-10 под кодом «A36.0 Дифтерия глотки» расположены «дифтерийная мембранозная ангина» и «тонзиллярная дифтерия», между которыми нет принципиальных различий. При этом МКБ-10 не указывает на различия между локализованной и генерализованной дифтерией – наличие поражений органов-мишеней (сердца, нервной системы и почек).
Как известно, дифтерийная пленка с миндалин часто распространяется на слизистую оболочку полости рта (uvula, мягкое и твердое небо, десны, щеки и язык). Поэтому вместо «дифтерии глотки» логично было бы оставить анатомически чуть менее правильный, но более привычный термин «дифтерия ротоглотки».
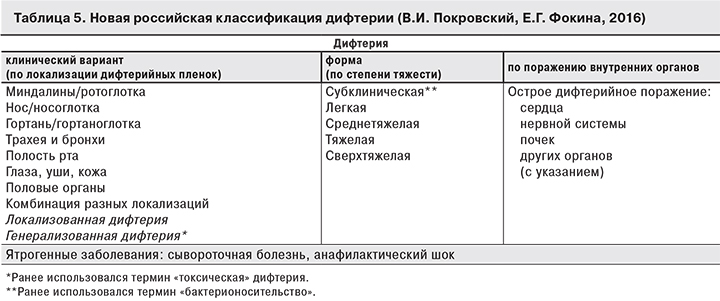
Переосмысление накопленного ранее клинико-лабораторного материала по дифтерии и представления его в новом формате позволило разработать новую, более современную российскую классификацию ДИ (табл. 5).
Степень тяжести дифтерии следует определять по совокупности эпидемиологических, клинических и лабораторных данных с учетом картины полиорганных нарушений в динамике наблюдения при поступлении и далее в разгаре заболевания, исходя из:
- определения числа анатомических областей, вовлеченных в инфекционный процесс (с примерной оценкой размеров фибриновой пленки);
- обнаружения специфического дифтерийного отека подкожной клетчатки и окружающих тканей;
- результатов лабораторного исследования на обнаружение возбудителя дифтерии и уровень ДТ-токсинемии;
- клинической картины поражения органов-мишеней.
Следует учитывать патогенетические механизмы развития заболевания:
- в органах-мишенях развивается выраженный отек, который сдавливает нервные волокна и нарушает кровоснабжение. Деструкция тканей, инициированная ДТ и продуктами жизнедеятельности КБД, усугубляется гипоксией и повреждением нервных клеток;
- в результате генерализации инфекции (незавершенный фагоцитоз КБД, выход депонированного ДТ из лимфоузлов за пределы первичного очага) возможен волнообразный характер поражения органов-мишеней;
- при наличии клинической картины болезни отсутствие токсигенного штамма КБД в результатах бактериологических посевов не исключает диагноза дифтерии;
- отек ПКШ – диагностический признак генерализованной (токсической) дифтерии ротоглотки, который удобно использовать для начала сывороточной терапии и подбора стартовой дозы ПДС;
- определиться с дальнейшей тактикой введения ПДС позволяет динамическое наблюдение за больным (скорость исчезновения дифтерийных пленок и обратное развитие отека);
- при постановке окончательного диагноза следует ориентироваться на клиническую картину поражения органов-мишеней;
- синдром полиорганной недостаточности и развитие любого из осложнений [острой дыхательной недостаточности, острой почечной недостаточности (острой патологии почек), острой сердечной недостаточности, острой недостаточности кровообращения и клинической манифестации ДВС («геморрагическая» форма)] служат ранними предикторами неблагоприятного течения ДИ [1, 53, 54].
Предлагаем варианты формулировки клинического диагноза:
- Локализованная дифтерия носа, легкое течение (КБД gravis токсигенная).
- Генерализованная дифтерия ротоглотки и гортани, тяжелая форма. Стеноз гортани II–III степени. Дифтерийное поражение сердца (миокардит, неполная AV-блокада, недостаточность кровообращения I степени). Дифтерийное поражение нервной системы (парез IX–X пары черепно-мозговых невров). Дифтерийное поражение почек (протеинурия, гематурия). Диагноз установлен клинически (в мазке со слизистой оболочки ротоглотки КБД не обнаружена). Осложнения: левосторонняя нижнедолевая пневмония. ДН 1.
Замена прежней классификации дифтерии на более современный вариант – актуальная задача практического здравоохранения.
Предлагаемая новая классификация дифтерии была обсуждена на VIII Ежегодном Всероссийском Конгрессе по инфекционным болезням с международным участием (Москва, 28–30 марта 2016 г.).


