Препарат долутегравир (DTG; 50 мг – 1 таблетка в сутки) в сочетании с тенофовиром/эмтрицитабином (TDF/FTC) или абакавиром/ламивудином (ABC/3TC) специалисты как США, так и Евросоюза рекомендуют в качестве предпочтительных режимов лечения больных ВИЧ-инфекцией [1, 2]. В Национальных рекомендациях по диспансерному наблюдению и лечению больных ВИЧ-инфекцией, утвержденных Национальным научным обществом инфекционистов DTG включен в предпочтительные режимы АРВТ первого ряда для особых групп пациентов.
Основанием для включения в предпочтительные режимы АРТ препарата DTG в сочетании с TDF/FTC или с AВC/3TC были результаты трех крупных международных исследований III фазы: SPRING-2, SINGLE и FLAMINGO [4–6]. В этих исследованиях эффективность и безопасность препарата DTG сравнивали с наиболее изученными и эффективными лекарственными средствами, относящимися к трем основным классам антиретровирусных препаратов (АРВП), которые являются третьим базовым компонентом наряду с двумя препаратами из группы нуклеозидных ингибиторов обратной транскриптазы ВИЧ (НИОТ) схемы АРТ: ИИ RAL, ненуклеозидный ингибитор обратной транскриптазы (ННИОТ) эфавиренз (EFV), ингибитор протеаз ВИЧ (ИП) дарунавир (DRV). Во всех трех исследованиях 1067 больных получали схемы АРТ, включавшие DTG, при этом неэффективность терапии была отмечена только у 63 (5,9%) больных. Исследование резистентности ни в одном случае не выявило мутаций резистентности вируса к ИИ, что свидетельствует о высоком генетическом барьере DTG, сопоставимом с ИП. В то же время среди больных с вирусологической неэффективностью, получавших RAL (n = 29) и EFV (n = 33), регистрировали развитие мутаций резистентности к ИИ (3%) и ННИОТ (18%).
Наличие высокого генетического барьера позволило рекомендовать использование DTG в схемах АРТ второй и последующих линий, то есть при неудаче предшествующих режимов лечения, включавших не только ИП или ННИОТ, но и ИИ ВИЧ первой генерации – RAL и элвитегравир (EVG). Данные рекомендации были основаны на результатах двух крупных международных исследований SAILING и VIKING-3 [7, 8].
В 2013 г. были опубликованы результаты рандомизированного двойного слепого исследования III фазы ING111762 (SAILING), в котором изучалась безопасность и эффективность DTG в сравнении с RAL у взрослых больных ВИЧ-инфекцией, ранее получавших АРТ, за исключением ИИ [7]. Критерии включения предполагали, что количество РНК ВИЧ должно быть не менее 400 копий/мл при условии, что на этапе скрининга этот показатель превышает 1000 копий/мл. Кроме того, включали только пациентов с резистентностью к двум и более классам АРВП, кроме ИИ. Исходно проводили стратификацию по вирусной нагрузке (> или < 50 000 копий/мл), приему DRV и количеству полностью активных препаратов в оптимизированной базовой терапии (ОБТ), которая назначалась по выбору врача-исследователя.
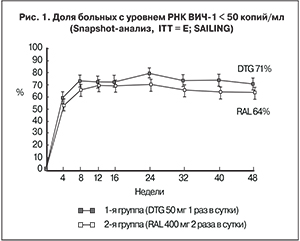 Продолжительность исследования составила 48 недель. Первичной конечной точкой была доля пациентов с РНК ВИЧ-1 < 50 копий/мл на 48-й неделе, определенная у всех участников, распределенных случайным образом в группы лечения и получивших хотя бы одну дозу исследуемого препарата. Предел не меньшей эффективности – 12%; в случае подтверждения сопоставимости проводился анализ на превосходство. Заранее определенная утвержденная ключевая вторичная конечная точка – доля пациентов с мутациями резистентности к ИИ, возникшими на фоне лечения.
Продолжительность исследования составила 48 недель. Первичной конечной точкой была доля пациентов с РНК ВИЧ-1 < 50 копий/мл на 48-й неделе, определенная у всех участников, распределенных случайным образом в группы лечения и получивших хотя бы одну дозу исследуемого препарата. Предел не меньшей эффективности – 12%; в случае подтверждения сопоставимости проводился анализ на превосходство. Заранее определенная утвержденная ключевая вторичная конечная точка – доля пациентов с мутациями резистентности к ИИ, возникшими на фоне лечения.
В исследование было включено 724 пациента из 156 центров Австралии, Канады, Европы, России, Латинской Америки, Тайваня, Южной Африки и США. Первую группу составили 360 пациентов, которые получали DTG в дозе 50 мг 1 раз в сутки с ОБТ, вторую – 364 пациента, получавших RAL в дозе 400 мг 2 раза в сутки также в сочетании с ОБТ. Большинство пациентов обеих групп в качестве ОБТ получали DRV/r, LPV/r или ATV/r в комбинации с TDF. Более 60% больных в группах были мужчины, медиана возраста составила 42 (35–49) года. У половины пациентов выявлена резистентность к трем и более классам препаратов. Исходно 30% пациентов имели уровень РНК ВИЧ > 50 000 копий/мл, а медиана количества CD4+-лимфоцитов составила 200 (95–366) клеток/мкл. В целом группы были хорошо сбалансированы между собой по всем показателям (демографическим, клиническим, лабораторным).
На 48-й неделе DTG продемонстрировал статистически более высокую эффективность по сравнению с RAL: 71 и 64% пациентов, первой и второй групп соответственно имели РНК ВИЧ < 50 копий/ мл (скорректированная разница 7,4%; 95% ДИ 0,7–14,2; р = 0,030) (рис. 1) [7]. Этот результат дал основание сделать вывод о превосходстве DTG над RAL. Иммунологическая эффективность DTG была сопоставима с таковой для RAL: средний прирост СD4+-лимфоцитов в первой группе составил 162 клетки/мл, во второй – 153 клетки/мл.
Вирусологическую неэффективность регистрировали реже у больных первой группы (6% в сравнении с 12% во второй группе). Достоверно меньше пациентов имели вирусологическую неудачу с мутациями резистентности к ИИ на фоне DTG (1% против 5%, скорректированная разница – 3,7%, 95% ДИ; р = 0,003), а также мутации резистентности к ОБТ (1% в сравнении с 3%).
Профиль безопасности был сопоставим в исследуемых группах, а большинство нежелательных явлений (НЯ) имели легкую или умеренную степень выраженности. Частота НЯ 2–4-й степени, связанных с приемом препарата, составила 8% в первой группе и 9% – во второй. Наиболее часто регистрировали диарею (18–20% случаев), инфекции верхних дыхательных путей (8–11%) и головную боль (9%). Серьезные НЯ, связанные с приемом препарата, зарегистрированы у 2 (1%) пациентов первой группы и у 4 (1%) пациентов второй группы.
 Прекращали терапию в связи с НЯ крайне редко: лишь у 1% больных первой группы и у 3% больных второй группы. Летальные исходы были зафиксированы только во второй группе у 3 пациентов и связаны не с принимаемой АРТ, а с метастатической карциномой, полиорганной недостаточностью и цервикальной карциномой [7].
Прекращали терапию в связи с НЯ крайне редко: лишь у 1% больных первой группы и у 3% больных второй группы. Летальные исходы были зафиксированы только во второй группе у 3 пациентов и связаны не с принимаемой АРТ, а с метастатической карциномой, полиорганной недостаточностью и цервикальной карциномой [7].
Лабораторные отклонения также были схожи в обеих группах. Повышение креатинина в сыворотке крови 3–4-й степени имело место менее чем у 1% больных, не сочеталось с прогрессирующим снижением рСКФ и было обусловлено в основном исходной почечной патологией и сахарным диабетом. Как и другие ИИ, DTG обладает низкой гепатотоксичностью. Лишь у 3% пациентов, большинство из которых имели коинфекцию ВИЧ/ВГВ(ВГС), был повышенный уровень АЛТ 3–4-й степени, что не привело к отмене терапии.
Прерывание терапии в первой группе регистрировали реже, чем во второй (16 и 22% соответственно). Основными же причинами прекращения лечения схемой, включающей DTG, были нарушения протокола, соответствие критериям остановки терапии, потеря для наблюдения, решение исследователя и отзыв информированного согласия.
Исследование VIKING-3 – это открытое многоцентровое исследование III фазы с одной группой, в котором ранее получавшие терапию взрослые пациенты с резистентностью к ИИ в течение 7 дней получали DTG по 50 мг 2 раза в сутки, продолжая свой неэффективный режим лечения (уже без RAL или EVG), после чего он был оптимизирован с включением одного или более полностью активных препаратов и продолжением приема DTG [8].
Целью исследования было изучение противовирусной активности и безопасности DTG у взрослых пациентов, инфицированных ВИЧ-1, с предшествующей неудачей АРТ, включающей ИИ первой генерации.
Первичными конечными точками эффективности были среднее изменение уровня РНК ВИЧ-1 от исходных значений на 8-й день терапии и доля лиц с РНК ВИЧ-1 < 50 копий/мл через 24 недели лечения.
Критериями включения в исследование были уровень РНК ВИЧ-1 > 500 копий/мл и наличие подтвержденной (документально или на скрининге) резистентности ВИЧ к RAL и/или EVG и к двум и более классам АРВП.
В исследование было включено 183 больных ВИЧ-инфекцией из 65 центров США, Канады и Европы, 77% (141 пациент) из которых составляли мужчины и 71% (130 пациентов) – лица европеоидной расы. Медиана исходного количества CD4+-лимфоцитов составила 140 (40–330) клеток/мкл. У 102 (56%) больных была установлена стадия С по классификации CDC. Сочетанную инфекцию с ВГВ и/или ВГС имели 38 (21%) пациентов [8].
Медиана продолжительности предшествующей АРТ составляла 14 (8,50–17,33) лет. Медиана количества ранее принимаемых АРВП была равна 14 (3–23) препаратам. 134 (73%) пациента ранее получали DRV/r, 103 (56%) – этравирин (ЕТR), а 89 (49%) – энфувиртид (ENF). У всех 183 больных были обнаружены мутации резистентности ВИЧ к ИИ: T66A/I/K, E92Q/V, Y143C/H/R, Q148H/K/R, N155H (или фенотипическая резистентность – RAL FC > 1,5 или EVG FC > 2,5). У 73% больных мутации резистентности к ИИ были выявлены во время скрининга, а у 27% – при неэффективности предшествующей терапии, включавшей ИИ. Помимо мутаций резистентности к ИИ у 133 (73%) пациентов имели место 3 и более мутаций резистентности к препаратам из группы НИОТ, у 108 (59%) – 2 и более мутаций к ННИОТ и у 129 (70%) – 2 и более мутаций резистентности к ИП.
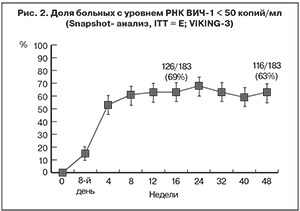
Замена ИИ первой генерации препаратом DTG в схеме АРТ уже через 7 дней лечения обусловила значительное снижение уровня РНК ВИЧ-1 по сравнению с исходным: -1,43 log10 копий/мл (95% ДИ -1,52; -1,34; p < 0,001). Через 24 и 48 недель лечения у 69 и 63% больных соответственно был достигнут уровень РНК ВИЧ-1 < 50 копий/мл (рис. 2) [8, 9]. Кроме того, у 74 и 68% пациентов спустя 24 и 48 недель исследования соответственно уровень РНК ВИЧ-1 был < 400 копий/мл. Проведенный многофакторный анализ продемонстрировал значительную взаимосвязь между исходной чувствительностью к DTG и ответом на терапию. В наибольшей степени вирусологический ответ был снижен у пациентов, имевших сочетание мутации Q148 и двух и более других мутаций резистентности [8].
Переносимость схемы АРТ, включавшей DTG, была хорошей, поскольку только у 15% больных регистрировали НЯ 2-й и более степени токсичности, связанные с принимаемой терапией. 4 (2%) пациента предъявляли жалобы на диарею, по 3 (2%) пациента – на тошноту и головную боль. Серьезные НЯ были отмечены у двух больных: у одного был обморок, а у второго – гипербилирубинемия, повышение уровня АЛТ, токсикодермия, обусловленные течением основного заболевания (прогрессирующей многоочаговой лейкоэнцефалопатии). После выхода пациента из исследования имел место летальный исход, не связанный с приемом исследуемого препарата [8, 9].
Прием DTG 50 мг 2 раза в сутки в течение 48 недель продемонстрировал низкую долю пациентов (4%), прекращающих лечение вследствие развития побочных эффектов, сопоставимую с таковой у пациентов, не получавших ИИ, а также принимавших DTG 50 мг 1 раз в сутки (SPRING 2, SINGLE и FLAMINGO) [4-6].
Таким образом, схема АРТ, включавшая DTG 50 мг с приемом 2 раза в сутки, была эффективна у пациентов, имевших большой опыт терапии и резистентность ВИЧ к ИИ первой генерации (RAL и EVG) и множественную резистентность вируса к другим классам АРВП. DTG в дозе 50 мг 2 раза в сутки хорошо переносился, лишь 8 (4%) из 183 больных прекратили терапию в связи с возникновением НЯ в течение 48 недель лечения. Не обнаружено различий в частоте прерывания терапии из-за развития НЯ к 24-й неделе лечения в зависимости от пола, расы и возраста пациентов.
На основании проведенных исследований можно заключить, что применение DTG в сочетании с другими АРВП имеет более высокую вирусологическую эффективность и генетический порог развития резистентности по сравнению с RAL, а также хорошо переносится в группе пациентов с опытом лечения.
Препарат DTG в составе схемы АРТ может быть рекомендован не только пациентам, начинающим лечение, но и больным с резистентностью ВИЧ к АРВП различных классов, включая ИИ первой генерации.


