Проблема пневмококковой инфекции
Современные эпидемиологические данные свидетельствуют о том, что, несмотря на использование современных антимикробных препаратов, показатели заболеваемости и летальности при пневмококковой инфекции по-прежнему высоки [1]. Наиболее тяжелые формы инфекции, вызванной Streptococcus pneumoniaе, отмечаются у детей раннего возраста и лиц 65 лет и старше. Все случаи пневмококковой инфекции принято подразделять на инвазивные (при которых возбудитель выделяется из стерильных в норме локусов – крови, ликвора и др.) и неинвазивные (локально-очаговые поражения, например, средний отит, синусит и т. д.). При пневмонии инфекция может быть как инвазивной (при наличии бактериемии), так и неинвазивной, а соотношение между этими типами инфекции составляет примерно 1:3 [2]. По оценкам экспертов [3], общее число больных внебольничной пневмонией в России ежегодно составляет более 1,5 млн человек, а доля пневмококков в структуре тяжелой внебольничной пневмонии достигает 30–40%.
В настоящее время терапия пневмококковой инфекции осложняется в результате появления и распространения штаммов S. pneumoniae, резистентных к антибиотикам, традиционно применяемым в лечении подобных инфекций [4–7]. Особую тревогу вызывает факт быстрого нарастания резистентности пневмококков к пенициллину (до 30% и более нечувствительных изолятов), цефалоспоринам III поколения (8–14%) и макролидам (18–33%), особенно в крупных городах (Москва, Санкт-Петербург) и в Дальневосточном федеральном округе [5–7]. Вследствие этого существенно увеличиваются экономические затраты, а смертность при инвазивной пневмококковой инфекции (ИПИ) остается стабильно высокой – около 12% [8]. Примечательно, что высокая резистентность к антимикробным препаратам в большей степени характерна для отдельных серотипов S. pneumoniae (в частности, 23F, 19А, 19F, 14 и др.), входящих в состав пневмококковых вакцин [5, 6, 9].
Очевидно, что проблему пневмококковой инфекции невозможно решить только за счет повышения эффективности антимикробной терапии. Значительно более перспективным представляется предупреждение инфекции путем внедрения программ вакцинопрофилактики, причем не только у детей до 5 лет, но и у пациентов более старших возрастных групп, имеющих определенные факторы риска.
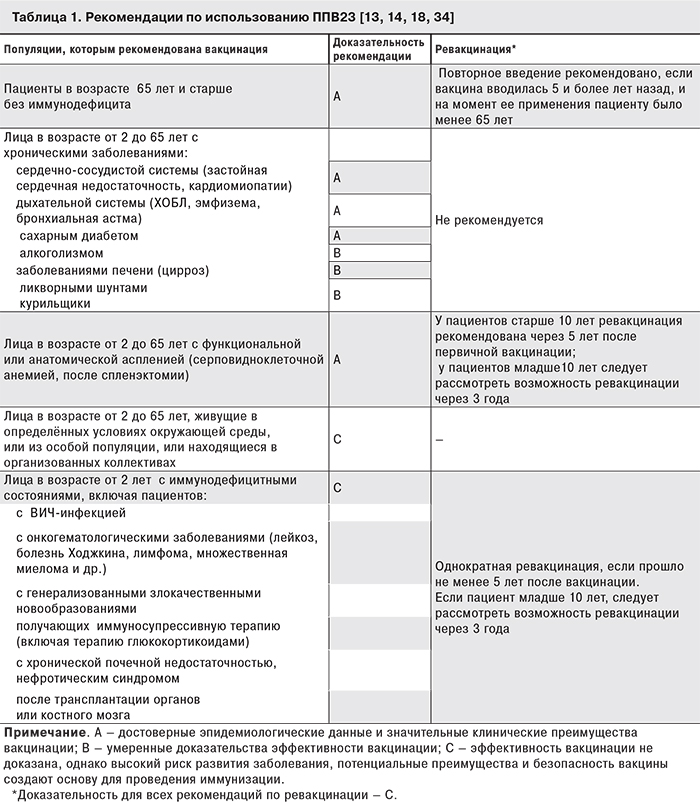
В настоящее время для профилактики пневмококковой инфекции используются 23-валентная пневмококковая полисахаридная вакцина (ППВ23) и пневмококковые конъюгированные вакцины (ПКВ), 10- и 13-валентные (ПКВ10 и ПКВ13) [10–13].
Пневмококковая полисахаридная вакцина
ППВ23 содержит по 25 мкг очищенных капсулярных полисахаридных антигенов 23 серотипов пневмококков и используется в клинической практике с середины 80-х годов прошлого века у пациентов в возрасте 65 лет и старше, а также у лиц в возрасте от 2 до 65 лет из групп риска развития ИПИ или пневмококковой пневмонии (табл. 1). Входящие в ППВ23 серотипы пневмококков ответственны за 80–90% ИПИ у взрослых, а эффективность ППВ23 составляет 60 [15, 16].
Следует отметить, что ППВ23 содержит Т-независимые антигены и, как следствие, недостаточно стимулирует иммунный ответ у детей в возрасте до 2 лет (см. рисунок, а). Такой тип антигенов индуцирует иммунный ответ, который, с одной стороны, не является долговременным, а с другой – не сопровождается формированием «иммунологической памяти» (то есть после бустерного введения вакцины не наблюдается более выраженного иммунного ответа).
Клинические исследования применения пневмококковых полисахаридных вакцин у детей раннего возраста показали или низкую эффективность, или ее отсутствие. Кроме того, для большинства серотипов, которые чаще всего встречаются у штаммов, вызывающих заболевания у данной категории пациентов (6А, 14, 19F и 23F), иммунный ответ может быть недостаточным и у детей младше 5 лет [16].
До сих пор ведутся споры, касающиеся эффективности ППВ23 в профилактике неинвазивной пневмококковой инфекции (в первую очередь, пневмонии), хотя доказательства протективного эффекта от применения вакцины в отношении ИПИ, по меньшей мере, у молодых здоровых взрослых и пациентов старшего возраста без серьезных сопутствующих заболеваний,весьма убедительны [17, 18]. В то же время эффективность вакцины против ИПИ не продемонстрирована у иммунокомпрометированных пациентов и у лиц пожилого возраста [18]. Имеются также данные о том, что у иммунокомпетентных пожилых пациентов эффективность вакцинации может снижаться с возрастом и со временем, прошедшим с момента введения вакцины [19]. В ряде исследований [10] установлена польза от применения ППВ23 в профилактике небактериемических форм инфекций, в то время как в других продемонстрирована ее неэффективность против небактериемических форм пневмококковых инфекций или в снижении летальности. Доказательства протективного эффекта ППВ23 против пневмококковой инфекции у пациентов с ВИЧ-инфекций, относящихся к группе высокого риска, также неубедительны [20]. В связи с вышесказанным аргументы «за» и «против» использования ППВ23 у перечисленных групп пациентов активно обсуждаются медицинским сообществом [15, 21–23].

Существует целый ряд потенциальных причин, объясняющих достаточно противоречивые результаты клинических исследований и мета-анализов, включая различия в качестве и дизайне исследований, популяциях пациентов, принимавших участие в исследованиях; трудности установления диагноза пневмококковой пневмонии без бактериемии; различия в оцениваемых конечных параметрах и некоторые другие причины [10, 18, 22].
В 2009 г. были опубликованы результаты мета-анализа, в котором авторы оценивали эффективность вакцинации против пневмококковой инфекции, в том числе ППВ23, у взрослых пациентов с учетом качества каждого исследования [24]. Конечными параметрами, оцениваемыми в ходе мета-анализа, были вероятная пневмококковая пневмония; пневмония, вызванная любыми другими патогенами; летальный исход от всех причин. Была отмечена значительная гетерогенность исследований, включенных в мета-анализ. Польза от применения вакцины в отношении двух конечных параметров эффективности была установлена во всех без исключения исследованиях. Когда же были проанализированы только исследования высокого методологического качества, оказалась, что польза от применения ППВ23 в отношении конечных критериев оценки эффективности незначительна. Также было получено недостаточно доказательств протективного эффекта ППВ23 у пожилых пациентов и у взрослых с хроническими заболеваниями [24].
В рамках кокрановского мета-анализа, результаты которого были опубликованы в 2013 г., было проанализировано 18 рандомизированных контролируемых исследований с участием 64 852 пациентов и 8 нерандомизированных контролируемых исследований с участием 62 294 пациентов [25]. По данным рандомизированных контролируемых исследований, были получены убедительные доказательства эффективности ППВ23 для профилактики всех ИПИ [отношение шансов (ОШ) = 0,26, то есть ППВ23 предотвращает ¾ всех случаев ИПИ у лиц пожилого возраста] и пневмонии в странах с невысоким уровнем доходов у общей популяции пациентов (ОШ = 0,54). Не было получено доказательств эффективности ППВ23 для профилактики пневмонии в странах с высоким уровнем доходов у общей популяции пациентов (ОШ = 0,71) и у взрослых с хроническими заболеваниями (ОШ = 0,93). Применение ППВ23 не приводило к значимому снижению летальности от всех причин (ОШ = 0,90). По данным нерандомизированных клинических исследований, были получены убедительные доказательства эффективности ППВ23 в отношении профилактики всех ИПИ в популяции пациентов, у которых использовалась вакцина (ОШ = 0,48). Также не было получено доказательств, которые поддерживали бы рекомендации по рутинному использованию ППВ23 для профилактики пневмонии, вызванной всеми патогенами. Таким образом, данный мета-анализ предоставляет доказательства, поддерживающие рекомендации по использованию ППВ23 для предотвращения ИПИ и пневмонии в странах с невысоким уровнем доходов у общей популяции взрослых пациентов.
В популяционном когортном исследовании по оценке эффективности ППВ23, проведенном в Испании у пациентов в возрасте 60 лет и старше, в качестве конечных критериев оценки рассматривались случаи возникновения инвазивных и неинвазивных инфекций и внебольничной пневмонии, вызванной разными патогенами [26]. При выполнении первичного анализа всей когорты пациентов не была установлена эффективность ППВ23 в отношении оцениваемых параметров, однако при детальном скорректированном анализе оказалось, что недавнее (менее 5 лет назад) введение ППВ23 снижало риск развития как пневмококковой пневмонии, так и пневмонии, вызванной другими возбудителями [26].
Интересны результаты исследования типа «случай–контроль» [27], свидетельствующие о том, что ППВ23 имеет протективный эффект у пожилых пациентов в отношении госпитализации по поводу пневмококковой внебольничной пневмонии, причем особенно данный эффект был выражен у женщин. В связи с этим необходимо проведение дальнейших исследований по изучению влияния пола на эффективность вакцинации против пневмококковой инфекции.
Ретроспективное исследование типа «случай–контроль» («случай» – 212 участников с ИПИ, 23 441 – госпитализация по поводу внебольничной пневмонии; «контроль» – 470 070 лиц в возрасте 65 лет и старше), которое проводилось в Израиле с января 2007 г. по декабрь 2010 г., а его результаты были опубликованы в 2015 г. [28], продемонстрировало протективный эффект вакцинации ППВ23 в профилактике ИПИ и внебольничной пневмонии, требующей госпитализации. Так, скорректированное ОШ развития ИПИ после вакцинации ППВ23 составило 0,58, однако не было продемонстрировано протективного влияния ППВ23 на частоту возникновения пневмонии, вызванной разными патогенами и требующей госпитализации (ОШ = 1,01).
Несмотря на разнородность результатов клинических исследований и мета-анализов, ВОЗ сформулировала свою позицию в отношении использования ППВ23 [29]:
- результаты РКИ и мета-анализов подтверждают защитный эффект вакцины ППВ23 в отношении ИПИ и пневмоний, в том числе вызываемых другими возбудителями, среди практически здоровых молодых взрослых и (в меньшей степени) среди лиц в возрасте 65 лет и старше;
- результаты РКИ не продемонстрировали эффективности ППВ23 против ИПИ и пневмоний, вызываемых другими возбудителями, среди групп повышенного риска, таких как дети и взрослые с состояниями, повышающими риск пневмококковой инфекции, или лиц любого возраста с резко выраженной иммуносупрессией;
- большинство обсервационных исследований свидетельствует об эффективности ППВ23 в пределах 50–80% в отношении ИПИ среди здоровых взрослых и лиц с различными сопутствующими заболеваниями, но без значительного снижения иммунитета;
- среди привитых ППВ23, у которых тем не менее возникла пневмония, тяжесть заболевания и риск летального исхода снижены.
Подводя итоги раздела о ППВ23, нельзя не перечислить ключевые аспекты, о которых необходимо помнить при ее применении [10]:
- Вакцина не используется у детей в возрасте до 2 лет из-за низкой иммуногенности пневмококковых полисахаридных антигенов у пациентов данной возрастной группы.
- Эффективность от введения ППВ23 с возрастом уменьшается и в дальнейшем ассоциируется со снижением эффективности с течением времени, прошедшего после вакцинации (5–7 лет), что особенно выражено у пациентов пожилого возраста [19, 30].
- Значимой проблемой при применении ППВ23 является так называемый «феномен гипореспонсивности», когда введение повторных доз ППВ23 не только не даёт бустерного эффекта, но и вызывает даже меньший иммунный ответ, чем при первичном введении вакцины. При анализе случаев бустерного введения вакцины отмечалось повышение среднегеометрического титра антител после ревакцинации, но уровень антител был ниже, чем после первичного введения вакцины, причем возраст пациентов на момент введения бустерной дозы не влиял на выраженность иммунологического ответа очень незначительно. Еще в одном исследовании было установлено, что меньший ответ на вакцинацию при введении полисахаридных антигенов был вызван апоптозом В-клеток памяти [31].
- У пожилых пациентов вакцинация ППВ23 может вызывать образование антител с малой опсонизирующей способностью и сниженным потенциалом антител [32].
- Большинство случаев пневмококковой инфекции – это небактериемические формы внебольничной пневмонии. ИПИ встречаются относительно редко – в 0,5% всех случаев пневмококковой инфекции. Вакцина ППВ23 не продемонстрировала эффективности в профилактике пневмонии у лиц пожилого возраста, в связи с чем необходимо применение эффективной вакцины именно у данной категории пациентов [33].
Пневмококковые конъюгированные вакцины
Недостаточная эффективность ППВ23 у детей в возрасте до 2 лет привела к разработке ПКВ. В то время как ППВ23 вызывает Т-независимый (гуморальный) иммунный ответ, ковалентная конъюгация капсульных полисахаридных антигенов с белком-носителем активирует Т-зависимый ответ и, как следствие, подобная вакцина приводит к стимулированию более высокого антительного ответа у детей раннего возраста, начиная с 2 мес. (см. рисунок, б) [10, 12]. Дополнительно происходит выработка В-лимфоцитов памяти при первом контакте с антигеном и формирование иммунологической памяти, что выражается в быстром повышении концентрации антител при повторном (бустерном) введении ПКВ [35]. Кроме того, ПКВ способствует формированию местного иммунитета слизистых оболочек (мукозального иммунитета), что способствует снижению назофарингеального носительства и, как результат, формированию коллективного иммунитета. Это подтверждено многочисленными исследованиями [36, 37], по результатам которых использование ПКВ у детей приводило не только к значимому снижению частоты ИПИ и госпитализаций по поводу пневмонии у детей в США, но и способствовало снижению частоты ИПИ у лиц пожилого возраста. Ограничением применения ПКВ является невозможность включения количества серотипов, больше определенного [38].
Широкое внедрение первой 7-валентной ПКВ (ПКВ7) для вакцинации детей в возрасте до 2 лет (с 2000 г. применяется в США, включена в национальные календари профилактических прививок более чем в 40 странах мира и разрешена к применению более чем в 90 странах) привело:
- к значимому (на 70%) снижению частоты ИПИ не только в целевой популяции (дети до 2 лет), в которой применялась вакцина, но и у пациентов в возрасте 65 лет и старше, чего удалось достичь благодаря созданию коллективного иммунитета [39, 40];
- к значимому снижению частоты развития инвазивных инфекций, вызванных резистентными штаммами S. pneumoniae [41];
- к значимому снижению частоты назофарингеального носительства S. pneumoniae (серотипов, входящих в вакцину, и штаммов с высоким уровнем резистентности к пенициллину) [42].
В то же время серотипы, не входящие в состав ПКВ7, стали вызывать бóльшее количество инфекций, чем было до вакцинации. Так, увеличилась частота инфекций, вызванных серотипом 19А, который обусловливает возникновение случаев заболеваний, резистентных к антибактериальной терапии.
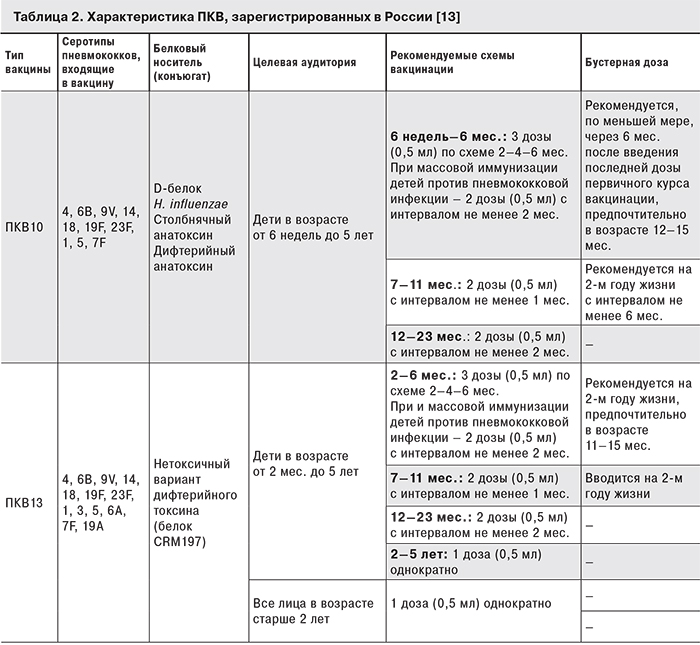
В настоящее время в России зарегистрированы ПКВ, содержащие 10 и 13 серотипов пневмококков. Характеристики ПКВ, целевые популяции пациентов и схемы введения представлены в табл. 2.
В 2010 и 2011 гг. FDA и EMEA одобрили применение в США и Европе ПКВ13, которая дополнительно к серотипам, имевшимся в ПКВ7, также содержит серотипы 1, 3, 5, 6A, 7F и 19A. С 2011 г. ПКВ13 разрешена для применения у детей в России.

Серотипы 1, 3 и 7F нечасто колонизируют у детей, поэтому можно предположить, что вакцинация детей ПКВ13 не сможет значимо снизить трансмиссию этих 3 серотипов в популяции в целом. В то же время описаны случаи некротизирующей пневмонии, вызванной серотипом 3 [43]. Серотип 19А является особенно вирулентным и более резистентным к антибиотикам, а вызванные им инфекции характеризуются более агрессивным течением [44].
Согласно результатам нескольких эпидемиологических исследований, проведенных у детей в России, превалирующими в нашей стране являются серотипы пневмококка 19F, 23F, 6B, 14 и 3. Реже обнаруживали серотипы 19А, 6А и 9V. Профиль серотипов существенно отличался в зависимости от нозологии, возраста детей и региона, в котором проводилось исследование. Оказалось, что ПКВ7 перекрывает от 41 до 77,5% серотипов выделенных в России штаммов S. pneumoniaе, ПКВ10 – от 41 до 78%, а ПКВ13 – от 66,2 до 90,4%. Различия между ПКВ10 и ПКВ13 в перекрытии выделяемых у детей серотипов пневмококков составляли от 7 до 26% (в среднем 18%) [45]. Следует также отметить, что большинство выделяемых в России нечувствительных к антибиотикам штаммов относятся к серотипам S. pneumoniae, входящим в состав ПКВ13 [5, 6, 9].
На основании этого можно предположить, что профилактика пневмококковой инфекции с использованием ПКВ13 в России будет эффективной в предотвращении ИПИ как у целевой категории вакцинируемых (дети до 2 лет), так и у уязвимых популяций пациентов других возрастных групп за счет создания коллективного иммунитета.
По данным, полученным в США, после внедрения ПКВ13 отмечалось снижение частоты ИПИ у детей
В конце 2011 г. Европейская комиссия и FDA [46] лицензировали применение ПКВ13 Европе и США у взрослых в возрасте 50 лет и старше для профилактики ИПИ и пневмококковой пневмонии [47].
В октябре 2012 г. Совещательный комитет по иммунизационной практике (Advisory Committee on Immunization Practices – ACIP) опубликовал рекомендации по использованию ПКВ13 у иммунокомпрометированных пациентов в ворасте 19 лет и старше. Эта категория пациентов, а также лица с анатомической или функциональной аспленией, ликворными шунтами или кохлеарными имплантами, которые не были ранее привиты ПКВ13 или ППВ23, должны быть вакцинированы первоначально однократно ПКВ13, а затем, не менее чем через 8 недель, – ППВ23. В случае если пациентам, относящимся к вышеуказанной категории риска по ИПИ, ранее уже вводили ППВ23, следует проводить вакцинацию ПКВ13 не ранее, чем через год после последней введенной дозы вакцины [48]. Ревакцинацию ППВ23 в дальнейшем проводят на основании обычных рекомендаций по использованию ППВ23 (см. табл. 1).
Начальные рекомендации по использованию ПКВ13 у взрослых были основаны на исследованиях иммуногенности (серотип-специфичной опсофагоцитирующей активности или функциональной активности вырабатываемых антител – ключевого отражения механизмов антипневмококковой защиты у взрослых) [12, 35]. В исследованиях иммуногенности было установлено:
- ПКВ13 по сравнению с ППВ23 вызывает более выраженный функциональный иммунный ответ в отношении большинства серотипов, перекрываемых ПКВ13, у ранее не вакцинированных против пневмококковой инфекции лиц в возрасте 60–64 лет [49];
- у лиц в возрасте 50–64 лет первоначальное введение ПКВ13 приводит к развитию иммунного состояния, которое в дальнейшем при введении ПКВ или ППВ23 способствует формированию более выраженного антительного ответа, в отличие от ситуации, когда первоначально вводится ППВ23. В этом случае последующее введение полисахаридной вакцины приводит к более низкому антительному ответу [50];
- у лиц в возрасте 60–64 лет первоначальная вакцинация ПКВ13 с последующим введении ППВ23 приводит к более выраженному иммунному ответу на многие серотипы, общие для обеих вакцин. Первоначальное введение ППВ23, наоборот, вызывает сниженный иммунный ответ на последующую вакцинацию ПКВ13 в отношении всех серотипов [51];
- у пациентов в возрасте 70 лет и старше, вакцинированных ранее ППВ23, последующее введение ПКВ13 оказывается более иммуногенным, чем ППВ23 для большинства серотипов с опсофагоцитирующей активностью, свидетельствующей о том, что предшествующая доза ППВ23 (но не ПКВ13) снижает последующий ответ на ПКВ13 [52].
В феврале 2013 г. ACIP рекомендовал рутинное использование ПКВ13 у детей в возрасте от 6 до 18 лет с иммунокомпрометированными состояниями, анатомической или функциональной аспленией, ликворными шунтами или кохлеарными имплантами, которые не были ранее привиты ПКВ13. 13-валентная вакцина данной категории пациентов должна вводиться независимо от предшествующей вакцинации ПКВ7 или ППВ23 [53]. Рекомендации по использованию ППВ23 у данной категории пациентов остались прежними.
В августе 2014 г. ACIP рекомендовал рутинное использование ПКВ13 у пациентов в возрасте 65 лет и старше [54]. Согласно новым рекомендациям, ПКВ13 должна вводиться первой, а лишь потом ППВ23.
Включение ПКВ13 в рекомендации ACIP было основано на результатах рандомизированного двойного слепого контролируемого исследования, в котором изучали эффективность применения ПКВ13 для профилактики внебольничной пневмонии у пациентов пожилого возраста без анамнестических данных о предшествующей вакцинации против Streptococcus pneumoniae (Community-Acquired Pneumonia Immunization Trial in Adults – CAPiTA) [55]. Исследование проводили в Нидерландах – стране, где пневмококковая вакцина не рекомендуется для рутинного использования у пациентов пожилого возраста, в связи с чем участникам исследования никогда не проводилась вакцинация против пневмококковой инфекции. CAPiTA является одним из крупнейших исследований в области вакцинопрофилактики, проведенном у взрослых пациентов [55].
В исследовании приняли участие 84 496 пациентов в возрасте старше 65 лет, которым вводили ПКВ13 (n = 42 240) или плацебо (n = 42 256). В проект не включали обитателей домов престарелых и учреждений длительного ухода; пациентов, которые ранее были вакцинированы с использованием пневмококковых вакцин; а также иммунокомпрометированных лиц. Первичной целью исследования CAPiTA была профилактика первого эпизода внебольничной пневмонии, вызванной входящим в состав вакцины серотипом пневмококка. Вторичные цели включали профилактику первого эпизода небактериемической/неинвазивной внебольничной пневмонии и других вариантов ИПИ, вызванных серотипами пневмококка, входящими в состав вакцины. Пневмококковая пневмония и ИПИ подтверждались в 58 стационарах-участниках исследования.
Для идентификации эпизодов внебольничной пневмонии, вызванных серотипами пневмококка, входящими в состав вакцины, использовали серотип-специфический тест на пневмококковую антигенурию в моче, разработанный компанией «Pfizer» специально для данного исследования. Это дало возможность врачам-исследователям определять вакцинные серотипы пневмококка с высокой степенью вероятности в моче пациентов, у которых развилась внебольничная пневмония.
Средний период последующего наблюдения составил 4 года в каждой группе. Эффективность ПКВ13 (анализ в соответствии с протоколом исследования) составила 45,6% для предотвращения первого эпизода внебольничной пневмонии, вызванной входящим в состав вакцины серотипом пневмококка, по сравнению с плацебо. Также 45% составила эффективность ПКВ13 в предотвращении первого эпизода небактериемической/неинвазивной внебольничной пневмонии и 75% – в профилактике других вариантов ИПИ, вызванных серотипами пневмококка, входящими в состав вакцины. При проведении модифицированного анализа в соответствии с назначенным вмешательством (ITT-анализ) эффективность вакцинации оказалась несколько ниже — 37,7, 41 и 75,7%, соответственно [55].
Кроме параметра эффективности вакцинации было установлено, что введение ПКВ13 взрослым пациентам более целесообразно с экономической точки зрения по сравнению с ранее рекомендованной вакциной [56–58].
Тактика вакцинации против пневмококковой инфекции пожилых пациентов в соответствии с рекомендациями ACIP следующая. Если пациенты в возрасте 65 лет и старше ранее не были вакцинированы против пневмококковой инфекции или же анамнестические данные неизвестны, им следует вводить 1 дозу ПКВ13, а затем через 6–12 мес. – ППВ23. 2 вакцины не должны назначаться одновременно, минимальный приемлемый интервал между введением ПКВ13 и ППВ23 должен составлять 8 недель [54]. В случае если пожилым пациентам ранее вводили ППВ23, необходимо проводить вакцинацию ПКВ13 не менее чем через 1 год после последней введенной дозы ППВ23. В случае если пациентам показано введение бустерной дозы ППВ23, ее следует вводить спустя 6–12 мес. после ПКВ13 и спустя 5 и более лет после последней дозы ППВ23 [54].
В РФ с 01.01.2014 вакцинация против пневмококковой инфекции с использованием ПКВ внесена в Национальный календарь профилактических прививок [59].
С целью специфической профилактики ИПИ, в том числе пневмококковой внебольничной пневмонии с бактериемией, у взрослых пациентов в РФ с 1999 г. используются ППВ23 и ПКВ13, применение которой с ноября 2012 г. разрешено для активной иммунизации взрослого населения в возрасте от 50 лет и старше (см. табл. 2). Вакцинация пневмококковой вакциной рекомендуется группам лиц с высоким риском развития ИПИ [3]. К ним относятся:
- пациенты в возрасте 65 лет и старше;
- лица с сопутствующими хроническими заболеваниями бронхолегочной (хроническая обструктивная болезнь легких, эмфизема, бронхиальная астма) и сердечно-сосудистой систем, сахарным диабетом, хроническими заболеваниями печени (включая цирроз), хронической почечной недостаточностью, нефротическим синдромом, алкоголизмом, кохлеарными имплантами, ликвореей, функциональной или органической аспленией (серповидно-клеточная анемия, спленэктомия);
- пациенты с иммунодефицитом (ВИЧ-инфекция, злокачественные новообразования, иммуносупрессивная терапия и др.);
- лица, проживающие в домах престарелых и других учреждениях закрытого типа;
- курильщики.
Иммунокомпрометированные пациенты старше 50 лет, в том числе лица с хронической почечной недостаточностью и нефротическим синдромом, анатомической или функциональной аспленией, ликворными шунтами, кохлеарными имплантами, должны быть первоначально однократно вакцинированы ПКВ13, а затем (не ранее чем через 8 недель) ППВ23. Если пациенты с указанными факторами риска ранее получали полисахаридную вакцину, им рекомендуется вводить конъюгированную вакцину (не ранее чем через 12 мес. с момента последней вакцинации) [3].
Если вакцинация ППВ23 проводилась до 65 лет, то в возрасте 65 лет (или не менее чем через 5 лет с момента введения первой дозы вакцины) пациентам с факторами риска ИПИ рекомендуется ревакцинация [3].
Объединенные данные по регистрации показаний к применению пневмококковых вакцин у разных категорий пациентов в России, США и странах ЕС представлены в табл. 4 [47, 48, 53, 54].
Единственный аспект, касающийся применения ПКВ13, который требует пристального внимания и мониторирования, – это возможность развития так называемого «эффекта замещения», то есть ситуации, когда вакцинные серотипы более не являются возбудителями заболеваний, а серотипы, не присутствующие в используемой вакцине, начинают вызывать случаи пневмококковой инфекции вскоре после массового внедрения конъюгированной вакцины (как, например, было продемонстрировано у детей) [60–63]. Появление возможностей эффективной специфической профилактики пневмококковой инфекции является одним из наиболее значимых достижений в области предупреждения инфекционных заболеваний на рубеже XX–XXI веков. Включение вакцинации против пневмококковой инфекции в Национальный календарь профилактических прививок в РФ, а также регистрация показаний к использованию вакцины у пациентов с факторами риска и у лиц пожилого возраста, несомненно, будут способствовать снижению заболеваемости и смертности от инвазивной и неинвазивной пневмококковой инфекции. Расширение показаний и внедрение программы массовой иммунизации детей потребует дальнейшего регулярного эпидемиологического мониторинга пневмококковой инфекции в России для непрерывной оценки эффективности проводимых мероприятий.


