Согласно современным представлениям о естественном течении хронической HBV-инфекции, ее пятая – HBsAg-негативная – фаза может соответствовать так называемой «оккультной» (скрытой) инфекции [1, 2]. Для «оккультной» HBV-инфекции (ОГВИ) характерно персистирование вирусного генома в ткани печени при определяемой (обычно менее 200 IU/ml) или неопределяемой ДНК HBV в сыворотке крови в отсутствие HBsAg [3]. С учетом лимфотропности HBV также предполагается возможность его внепеченочной репликации [4–6].
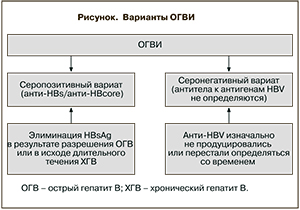
При ОГВИ выделяют 2 варианта серостатуса пациентов: первый, при котором выявляются антитела к HBsAg (анти-HBs) и/или к HBcoreAg (анти-HBc) [7], – так называемый серопозитивный вариант, и второй, при котором эти антитела отсутствуют, – серонегативный вариант [3, 7]. При серопозитивной ОГВИ HBsAg может исчезать либо быстро (в случае обратного развития острого гепатита), либо через годы или даже десятилетия течения хронического гепатита В. Так, ежегодная потеря HBsAg определяется у 0,5–2,26% лиц, наблюдающихся по поводу хронической HBV-инфекции [8, 9]. В случаях серонегативности потеря антител также возможна по ходу болезни, или подавление их продукции наблюдается уже с начала заболевания (см. рисунок).
У 35% пациентов с ОГВИ определяются анти-HBs, а у 42% – анти-HBcore. Серонегативный вариант обнаруживали в 22% случаев [7]. Наиболее высокий уровень виремии встречается при ОГВИ с «изолированными» анти-HBcore, низкий – в отсутствие вирусных маркеров и промежуточный – у больных с анти-HBs [10, 11]. Несмотря на существующие трудности в интерпретации результатов детекции анти-HBcore, выявление их «изолированного» варианта (в отсутствие других маркеров, в частности, HBsAg и анти-HBs) привлекает к себе огромный интерес [10]. Не участвуя в процессе гуморального ответа на HBV, то есть не будучи протективными, но являясь важным элементом участия клеточного звена иммунитета, именно «изолированные» анти-HBcore могут являться наиболее стойкими маркерами HBV-инфекции, в частности ОГВИ [12, 13]. Наглядной иллюстрацией этому являются результаты исследования R.C. Dickson и соавт. [14], которые обнаружили высокую (90%) частоту развития гепатита В у серонегативных реципиентов печеночного трансплантата, получивших трансплантат от анти-HBcore-позитивных доноров, по сравнению с такими же реципиентами с печенью, пересаженной от анти-HBcore-негативных доноров (0,5%). G. Raimondo и соавт. [15] сообщили о детекции ДНК HBV в печеночных биоптатах у 62% носителей анти-HBcore по сравнению с 7,3% у серонегативных лиц.
Интересные данные были опубликованы совсем недавно китайскими исследователями [16], обнаружившими редкий вариант ОГВИ. У двух HBsAg-негативных больных с выявляемой ДНК HBV в крови (у одного из них и в печени) был обнаружен HBeAg. При этом у них также определялись анти-HBs и анти-HBcore в отсутствие анти-HBe и анти-HBcore IgM. Уровень виремии был низкий: у первого колебался от 234 до 267 МЕ/мл, у второго– от 42 до 1130 МЕ/мл. В обоих случаях имел место С-генотип HСV и серотип adr. Углубленный анализ позволил отнести оба вируса к группе escape mutants, так так была обнаружена двойная мутация A1762T и G1764A.
При ОГВИ, как правило, отсутствуют черты активного заболевания печени, однако у некоторых больных могут выявляться гистологические изменения, свидетельствующие о сохраняющейся незначительной некровоспалительной активности [17], и признаки остаточного фиброза различной степени выраженности, вызванные предшествующим течением болезни [18]. Интерес к изучению этой проблемы за последние десятилетия неуклонно возрастает, поскольку, с одной стороны, она играет важную эпидемиологическую роль, а с другой – сохраняется неопределенность в отношении ее клинической значимости.
 Распространенность ОГВИ
Распространенность ОГВИ
Исследования о частоте встречаемости ОГВИ относительно немногочисленны и достаточно противоречивы. Это в значительной мере может быть обусловлено существенным различием в чувствительности тест-систем, так как для выявления ДНК HBV в концентрации ниже 102 МЕ/мл требуются специальные способы ее повышения. Представляется обоснованной точка зрения о возможной связи распространённости ОГВИ в разных регионах с интенсивностью эпидемического процесса. В частности, частота выявления ОГВИ среди доноров крови в Московской области, характеризующейся низкой интенсивностью циркуляции HBV, составила 0,28%, а в Республике Тыва, для которой характерна высокая интенсивность циркуляции вируса, – 9,4% [19].
Данные о распространенности ОГВИ в других регионах мира колеблются в широком диапазоне. Так, G. Minuk и соавт. [20] установили, что в группе исследованных HBsAg-негативных канадских эскимосов ДНК вируса определялась у 18% анти-HBcore-позитивных и только у 8% серонегативных индивидуумов. В публикациях из Кореи и Гонконга сообщалось о выявлении ОГВИ соответственно у 16% здоровых лиц и 15% доноров стволовых клеток [21, 22], а в одном из итальянских исследований [15] было показано, что частота обнаружения вирусной ДНК в печеночной ткани составила 16% среди 98 HBsAg-негативных больных, которым была выполнена резекция печени или интраоперационная биопсия (у большинства из них определялись антитела к антигенам HBV). Интересно, что в корейском исследовании «оккультная» инфекция определялась статистически значимо чаще у мужчин (23%) по сравнению с женщинами (8%).
В то же время среди 28 134 HBsAg-отрицательных доноров крови в Индии вирусная ДНК определялась лишь у 25 человек, что составило менее 0,1%. Почти 2/3 из них имели изолированные анти-HBcore, а чуть более 1/4 оказались серонегативными [23]. Среди доноров крови в Колумбии и Иране выявление ОГВИ также оказалось редким – 1,98 и 0,15–2,72% соответственно [24, 25]. С этим также согласуются последние данные о распространенности «оккультной» инфекции среди условно здорового населения Российской Федерации, частота которой составила 0,07%. Только в Республике Саха (Якутия) она оказалась несколько выше – 0,6 % [26].
Существует ограниченное количество данных, свидетельствующих о более высокой частоте выявления ОГВИ в популяциях с высоким риском парентерального инфицирования и среди больных с хроническими заболеваниями печени [7, 27]. Так, ОГВИ была выявлена у 45% лиц, использующих внутривенное введение наркотических препаратов в США [28], и у 5% больных гемофилией в Японии [29]. Данные о частоте ОГВИ у больных, получающих лечение программным гемодиализом, противоречивы и нуждаются в дальнейшем уточнении. Интересно отметить, что в последних публикациях 2014–2015 гг. из Японии и Кореи сообщается о низком уровне детекции ОГВИ в диализной популяции – от 0,11 до 1,3% [30–32]. В этом же регионе частота ОГВИ оказалась невысокой также у реципиентов почечного трансплантата (2,3%) [33], в отличие от российских данных, свидетельствующих о том, что среди больных после трансплантации почки частота оккультной инфекции достигала 13,2% [26].
Особое место занимает оценка частоты ОГВИ в условиях коинфекции с другими вирусами. Среди HBsAg-негативных носителей HCV-инфекции в Средиземноморье ДНК HBV встречалась почти у трети обследованных, а в азиатских странах Дальнего Востока – почти у половины [7, 34].
Среди американцев белой расы – кандидатов на трансплантацию печени в исходе цирроза HCV-этиологии ОГBИ наблюдалась также почти у 50% [35]. Эти результаты представляют особенный интерес в аспекте того, что распространенность HBV-инфекции среди белых американцев – наименьшая в мире. При определении вирусной ДНК в печеночной ткани ОГВИ была диагностирована у 41% пациентов с коинфекцией ВИЧ/HCV [36].
При хронических заболеваниях печени другой этиологии частота «оккультной» инфекции колебалась от 12 до 30% [7, 27, 37, 38]. Среди реципиентов печеночного трансплантата в Бразилии она была диагностирована у 4,4% [39].
Необходимо еще раз подчеркнуть, что результаты анализа частоты ОГВИ зависят от чувствительности используемых методов детекции, и это может объяснять значительную вариабельность полученных результатов.
Механизмы развития ОГВИ
В основе патогенеза ОГBИ лежит способность ДНК HBV интегрироваться в геном гепатоцита хозяина, не играя при этом важной роли в репликативном цикле. Интегрированный вирус может пожизненно существовать в печеночной клетке инфицированного организма даже в тех случаях, когда отсутствует продукция HBsAg. Однако наличие интегрированной ДНК вируса у HBsAg-негативного пациента не является в полном смысле «оккультной» инфекцией, поскольку для нее необходимо длительное внутрипеченочное присутствие генома в виде свободной эписомальной формы. Установлено, что молекулы ядерной ковалентно замкнутой кольцевой ДНК (сссDNA) гепаднавирусов организованы в стабильную хроматин-подобную структуру в виде вирусной минихромосомы, которая отображается при электронной микроскопии как типичная структура в виде «бусин на нитке», представляя собой нуклеосомную упаковку транскрипционно неактивного хроматина. В результате такое состояние молекулы сссДНК вируса теоретически позволяет ей существовать в клетке бесконечно долгое время [40].
Диагностическая неопределяемость HBsAg при наличии виремии может быть связана как с генетической изменчивостью S-гена, вызывающего продукцию модифицированного «австралийского» антигена (S-«ускользающий» мутант), не поддающегося детекции даже высокочувствительными тест-системами, так и (существенно реже) с инфицированием мутантными формами вируса с нарушенным синтезом S-белка. В частности, в настоящее время широко обсуждается роль мутаций в ключевых иммунодоминантных регионах поверхностного белка, делеции в pre-S1-регионе и структурных повреждений в геномных регуляторных регионах, которые приводят к существенному подавлению экспрессии HBsAg [3, 27, 41].
Интересные данные были недавно получены H. Kim и соавт. [42], которые обнаружили новые типы HBsAg у носителей «оккультной» инфекции при генотипе С2 HBV в Южной Корее. Оказалось, что большинство из этих вариантов «австралийского антигена» не поддавались детекции известными тест-системами, но при этом вирус обладал сопоставимой или даже более высокой способностью к секреции вирионов по сравнению с диким типом. Особенно важным представляется тот факт, что в этих случаях была обнаружена более высокая способность к развитию оксидативного стресса, и это, по мнению авторов, может объяснять значение ОГВИ в прогрессировании заболевания печени.
В то же время существует точка зрения, что возникающие мутации HBV не являются строго специфичными для ОГВИ, и в большинстве случаев развитие «оккультной» инфекции связано с заражением вирусами, обладающими такой же генетической гетерогенностью, как и вирусы, вызывающие «классическую» (HBsAg-позитивную) инфекцию [43, 44]. Поэтому в настоящее время считается, что возникновение ОГВИ происходит под влиянием ряда не только и даже не столько вирусологических, сколько иммунологических факторов, подавляющих HBV-репликацию и генную экспрессию [11, 18]. В частности, A. Zerbini и соавт. [45] показали существование HBV-специфического Т-клеточного ответа при ОГВИ даже у пациентов с полным отсутствием маркеров HBV в сыворотке. Возможно, что транзиторное развитие виремии при ОГВИ связано с ослаблением такого контроля.
Важная роль иммунологических факторов в развитии ОГВИ стала очевидна еще в 70-е годы ХХ века, когда появились многочисленные описания случаев ее реактивации в условиях иммуносупрессии, в частности, у онкологических больных, получающих химиотерапию, у пациентов после трансплантации органов и др. [7, 27, 46]. Это подтверждают данные, свидетельствующие о том, что долговременная память CD4- и CD8-клеток поддерживается антигенами вируса, сохраняющимися в течение нескольких лет после выздоровления от острого гепатита В. Следовательно, при ОГВИ допускается возможность синтеза минимального количества этих антигенов, неопределяемых доступными в настоящее время техническими возможностями, но достаточными для поддержания HBV-специфического Т-клеточного ответа [47]. Действительно, помимо молекул cccДНК HBV все вирусные транскрипты определялись в печени у лиц с ОГВИ, а с помощью количественной ПЦР в реальном времени удавалось обнаружить небольшое, но значимое количество внутрипеченочной м-РНК [48]. Поэтому клиническое выздоровление от HBV-инфекции не только не подразумевает полной элиминации вируса, но и определяется способностью иммунной системы обеспечивать контроль за вирусом в печени после клинического разрешения болезни [49].
Было показано, что при ОГВИ в зависимости от выявления анти-HBcore имеется различный профиль HBV-специфического Т-клеточного ответа, в частности, более высокий уровень продукции γ-интерферона у носителей этих атнтител [45]. Несмотря на то что эти циркулирующие клетки определялись с сопоставимой частотой как при анти-HBcore-негативном, так и при анти-HBcore-позитивном варианте ОГВИ, продукция ими γ-интерферона была существенно более слабой у серонегативных лиц по сравнению с серопозитивными.
В одном из недавно выполненных исследований [50] удалось установить, что у ВИЧ-инфицированных пациентов с ОГВИ величина виремии оказалась значимо связанной с более низким уровнем CD4-клеток. Следовательно, «неполноценность» клеточного звена иммунитета может приводить к ослаблению контроля за HBV и активации инфекции. Интересно, что у этих же больных при ОГВИ уровень IL-8, IL-10, IP-10, sFas и sFasL оказался ниже, чем при «классическом» варианте [51].
Подавление активности HBV-инфекции может быть связано с влиянием других инфекционных агентов в случае коинфекции с ними. Ранее было показано, что НСV, в частности его «core»-протеин, обладает сильным ингибирующим эффектом на репликацию НBV, определяющим возможность развития «оккультной» инфекции [7, 27, 52].
В то же время в сложных молекулярно-биологических исследованиях, выполненных in vitro с участием полноразмерных геномов HBV- и HCV-репликона (то есть в исследованиях, которые не ограничивались изучением роли одного белка), взаимодействия между двумя вирусами выявлено не было [53]. Это, по мнению G. Raimondo и соавт. [49], не позволяет в настоящее время с уверенностью подтвердить значимую роль HCV в развитии ОГВИ. Аналогичной точки зрения придерживаются эти исследователи и в отношении коинфекции HBV/ВИЧ.
Диагностика ОГВИ
В соответствии с положениями, выдвинутыми на встрече экспертов по ОГВИ в г. Таормина (Италия, 2008) [3], «золотым стандартом» диагностики является выявление ДНК HBV в экстракте печеночной ткани с помощью nested или real-time ПЦР. Однако в связи с ограниченными возможностями такого подхода применяется определение вируса в крови. Обязательным условием исследования является высочайшая чувствительность и специфичность применяющихся тест-систем с уровнем детекции менее 10 МЕ/мл для вирусной ДНК и менее 0,1 нг/мл для HBsAg [3, 54]. Применение современных тест-системы позволяет снизить порог определения ДНК HBV до уровня менее 5 МЕ/мл. Согласно рекомендациям экспертной группы в Таормине, праймеры должны быть специфичны для различных регионов вирусного генома и комплементарны к высококонсервативным нуклеотидным последовательностям. Поскольку уровень виремии при ОГВИ подвержен значительным колебаниям [55], желательны серийные исследования образцов сыворотки или плазмы в объеме не менее 1 мл [3].
Считается, что выявление ДНК HBV в крови коррелирует с наличием вируса в печени, однако наличие вирусной ДНК в печени не всегда сопровождается ее циркуляцией в крови [7].
Суррогатным, а по образному выражению S. Urbani и соавт. [10], «сигнальным» маркером потенциальной серопозитивной ОГВИ является обнаружение анти-HBcore [56]. При этом следует иметь в виду, что не у всех лиц с анти-HBcore определяется ДНК HBV, в частности в связи с тем, что существующие тесты на эти антитела недостаточно специфичны, и поэтому может быть получен ложноположительный результат [3, 10]. Тем не менее исследование этих антител сохраняет свою актуальность для диагностики ОГВИ, особенно в высокоэндемичных регионах, в случаях, когда детекция ДНК вируса в крови оказывается невозможной ввиду транзиторного характера виремии, свойственного «оккультной» инфекции.
Эпидемиологическое и клиническое значение ОГВИ
Интерес к ОГВИ в настоящее время определяется ее ролью в отношении четырех наиболее существенных аспектов:
- значение в распространении HBV-инфекции;
- возможность реактивации;
- вклад в прогрессирование фиброза при хроническом заболевании печени;
- риск онкогенеза.
Рассматриваются 2 наиболее часто встречающиеся пути заражения от лиц с ОГВИ – при гемотрансфузиях и при трансплантации органов. По мнению G. Raimondo и соавт. [49], возможны следующие варианты трансфузионной трансмиссии при ОГВИ:
- донор является носителем дикого типа вируса с подавленной репликативной активностью и генной экспрессией вируса («типичный» ОГВИ- носитель»);
- донор инфицирован так называемым «ускользающим» HBsAg-мутантным вирусом, обладающим репликативной активностью, но продуцирующим аномальный поверхностный белок, неузнаваемый доступными коммерческими тест-системами.
Проблематичность заражения при первом варианте связана с транзиторностью присутствия вируса в крови и его малым количеством в инфицирующем материале. Однако известно, что возможность развития острого гепатита после гемотрансфузий связана не только с величиной вирусной нагрузки, но и с объемом перелитой крови, иммунокомпетентностью реципиента, а также с HBV-серологическим статусом (наличие/отсутствие анти-HBcore и/или анти-HBs) как у реципиента, так и у донора. В частности, было показано, что ДНК-HBV-позитивные доноры с «изолированными» анти-HBcore (все остальные иммунологические маркеры не определяются) обладают большей способностью к заражению по сравнению с теми, в крови которых определяются только анти-HBs [57]. Таким образом, в некоторых странах, в которых скрининг донорской крови ограничивается только рутинным тестированием HBsAg, ОГВИ может являться основной причиной пострансфузионного распространения гепатита В [58, 59].
Второй вариант в нестоящее время представляется наиболее частой причиной посттрансфузионного инфицирования HBV. Для выявления доноров крови, инфицированных HBsAg-«ускользающим» мутантным вирусом, было рекомендовано использовать тест-системы с поливалентными анти-HBs-антителами для определения HBsAg [3]. Однако и такая стратегия не позволяет полностью исключить этот путь заражения, особенно в высокоэндемичных регионах, в которых вариабельность вирусного генома потенциально является наивысшей. Внедрение современных высокочувствительных тестов детекции вирусной ДНК позволяет выявлять ОГВИ при любом из вышеперечисленных вариантов.
В связи с низким уровнем виремии ОГВИ не представляет серьезной угрозы для инфицирования плода при беременности [60].
Хорошо известна возможность заражения de novo ранее не инфицированных реципиентов печеночного трансплантата от доноров с ОГВИ [27, 61]. Это связано с тем, что гепатоциты таких доноров являются резервуаром ссс-ДНК HBV. Существенно реже подобное заражение наблюдается у реципиентов сердечного и почечного трансплантатов, а также при трансплантации костного мозга [27, 62]. Частота инфицирования реципиентов от HBsAg-негативного/анти-HBcore-позитивного (соответствует ОГВИ) донора колеблется от 17 до 94% [14, 63, 64]. Таким образом, высокая частота развития HBV-инфекции в печеночном трансплантате, и напротив, низкий уровень заражения при трансплантации других солидных органов являются убедительным доказательством роли вирусной латенции в печеночных клетках в механизме инфицирования при ортотопической трансплантации печени [10]. В связи с вышеизложенным общепризнана необходимость профилактики у HBsAg-негативных реципиентов, получающих печень от анти-HBcore-позитивного донора с помощью введения специфического гепатит-В-иммуноглобулина, противовирусных препаратов или их комбинации. Следует иметь в виду, что ОГВИ может также встречаться у серонегативных доноров, и это обстоятельство представляет наибольшую трудность для ее диагностики и решения вопроса о необходимости профилактики.
Такой профилактический подход эффективен для предотвращения инфицирования реципиентов de novo, но не позволяет избежать реинфекции [61, 65]. Несколько недавних исследований наглядно продемонстрировали частое выявление OГВИ у реципиентов, уже имевших ее до трансплантации и/или инфицированных от донора с ОГВИ. При этом в пересаженной печени определяются геномные последовательности вируса, имевшегося у реципиента до трансплантации или полученного от донора. Наконец, возможны оба указанных варианта [66].
Многократно описаны случаи реактивации ОГВИ у пациентов с заболеваниями, связанными с патологией иммунной системы или иммунодефицитом ятрогенной природы [67, 68].
Однако совсем недавно, в 2014 г., были описаны случаи активации ОГВИ без отчетливой связи с иммуносупрессивным состоянием у двух пожилых японцев, перенесших хирургические вмешательства [69], хотя преклонный возраст больных, перенесенный стресс от хирургических операций, наличие сахарного диабета и поверхностного рака пищевода у одного из них (опухоль была легко удалена эндоскопически) могли косвенно отразиться на состоянии их иммунитета.
Считается, что реактивация у пациентов с ОГВИ происходит реже, чем у HBsAg-позитивных больных. Наибольшему риску активации подвержены пациенты с онкогематологическими заболеваниями, больные после трансплантации гемопоэтических стволовых клеток, а также лица, получающие лечение иммуносупрессивными препаратами, в частности моноклональными антителами к CD20 (ритуксимаб) и алкилирующими цитостатиками (темозоломид) [27, 70–72]. Риск реактивации оказался более высоким в случае применения ритуксимаба в сочетании с кортикостероидами [73], как и в случае добавления ритуксимаба к классической 4-компонентной схеме лечения В-клеточной лимфомы, включающей циклофосфамид, адриамицин, винкристин и преднизолон [71]. По мнению многих авторов [71, 74–76], реактивация ОГВИ в наибольшей степени присуща именно таким клиническим ситуациям, когда применение иммуносупрессивной терапии оказывается необходимым при заболеваниях, непосредственно связанных с вовлечением в патологический процесс собственной иммуннной системы [71, 74–76].
В исследовании E. Persico и соавт. [76] было показано, что частота обнаружения анти-HBcore среди больных с неходжскинской лимфомой достигала 35%, и они относились к группе высокого риска тяжелой реактивации HBV-инфекции в условиях применения химиотерапии.
Клиническая картина, свойственная острому гепатиту, развивается реже, чем ресероконверсия анти-HBs–HBsAg [77–79], поэтому реактивация ОГВИ может оставаться незамеченной. В то же время Е. Sagnelli и соавт. [80] приводят возможность иного варианта реактивации ОГВИ. Согласно их представлениям, усиление вирусной репликации в условиях иммуносупрессии ведет к распространению вируса в неинфицированные гепатоциты и дальнейшему увеличению выраженности виремии. После отмены иммуносупрессивных препаратов и восстановления функции цитотоксических Т-клеток возможно усиление некроза инфицированных гепатоцитов, что ведет к яркому клиническому обострению, порой по типу фульминантного гепатита с развитием печеночной недостаточности, и даже летальному исходу [81, 82].
В то время как профилактика обострений гепатита у HBsAg-позитивных больных с помощью нулеозидных аналогов является общепризнанной практикой, такой подход при ОГВИ в настоящее время все еще дискутируется [49, 83]. В соответствии с рекомендациями EАSL [2], выявление ДНК HBV при ОГВИ предполагает назначение лечения, аналогичного тому, что показано HBsAg-позитивным пациентам. В случае отсутствия виремии рекомендуется тщательное мониторирование уровней АЛТ и ДНК HBV, а при появлении вируса – начало терапии еще до повышения активности АЛТ. Это представляется особенно важным с учетом ее меньшей эффективности в условиях позднего начала [11, 81]. В литературе обсуждается вопрос об оптимальной продолжительности такой превентивной терапии. По-видимому, ее следует начинать за 1–2 недели до начала иммуносупрессии и продолжать, по крайней мере, в течение 6–12 месяцев после ее отмены [84, 85].
Существуют и иные подходы к мониторингу с целью определения оптимальных сроков начала профилактики активации ОГВИ. По мнению J.L. Lledó и соавт. [86], целесообразна регулярная (каждые 4 недели) детекция уровней виремии и HBsAg высокочувствительными методами. Нижний порог определения ДНК HBV при этом должен быть менее 10 МЕ/ мл, а «австралийского» антигена – менее 0,1 нг/ мл. Увеличение уровня вирусной ДНК свыше 30 МЕ/мл или обнаружение HBsAg должны считаться сигналом к назначению противовирусных препаратов.
Е. Sagnelli и соавт. [80], полагают, что решение вопроса о начале профилактики активации ОГВИ должно основываться на оценке серостатуса пациента, характера основной патологии и проводимого лечения. Так, у HBsAg-негативных/анти-HBcore-позитивных больных после трансплантации стволовых клеток или у пациентов с онкогематологическими заболеваниями, получавших высокие дозы кортикостероидов в сочетании с анти-CD20 или с анти-CD52, профилактику реактивации гепатита целесообразно проводить нуклеозидными аналогами. При этом предпочтительны препараты с более мощным противовирусным эффектом и более высоким барьером резистентности, такие как энтекавир или тенофовир. Начинать профилактику следует за 1–2 недели до начала иммуносупрессивной терапии, а завершать не ранее чем через 18 месяцев после ее окончания. Больным с онкогематологическими заболеваниями, не леченным высокими дозами кортикостероидов и монокланальными антителами к CD20 и CD52, рекомендован ежеквартальный мониторинг уровней АЛТ и HBsAg. Полагаясь на имеющиеся сведения о возможности активации ОГВИ у ревматологических больных, получавших биологическую терапию против фактора некроза опухоли (TNF-α) [87], эти же авторы рекомендуют использовать аналогичный подход к мониторингу после применения указанных препаратов.
Наиболее дискуссионной является возможность ОГВИ вносить значимый вклад в прогрессирование хронической болезни печени. В этом смысле важны данные, свидетельствующие о наличии легких некровоспалительных изменений в ткани печени через десятилетия после разрешения острого гепатита [17] в отсутствие клинических и биохимических признаков активности заболевания [15, 49].
По мнению G. Raimondo и соавт. [49, 88], сама по себе ОГВИ у иммунокомпетентных лиц, по-видимому, прогностически безобидна, однако она может усиливать печеночное повреждение при наличии сопутствующих неблагоприятных факторов, таких как HCV-инфекция, употребление алкоголя и др. В частности, имеются подтверждения более тяжелого течения хронической HCV-инфекции при сопутствующей ОГВИ [7, 27]. G. Squadrito и соавт. [34] установили, что продвинутые формы цирроза печени при хроническом гепатите С (ХГС) встречались статистически значимо чаще у больных с сопутствующей ОГВИ (8 из 24) по сравнению с теми, у которых «оккультная» инфекция отсутствовала (7 из 52). Ими также было показано, что в случаях сочетания ХГС с ОГВИ достоверно ухудшалась выживаемость пациентов.
В то же время недавно выполненный мета-анализ показал почти девятикратное увеличение риска хронического заболевания печени при ОГВИ вне зависимости от того, была ли это моно-(HBV)- или сочетанная с HCV инфекция [89]. Вероятно, ОГВИ, стимулируя развитие относительно легкой иммунной реакции, может ускорять печеночное повреждение у лиц с компрометированным иммунным ответом [83].
Характер влияния ОГВИ на прогрессирование хронического заболевания печени у больных с ВИЧ-инфекцией в настоящее время до конца не определен [50]. При этом анализ существенно осложняется нередким сопутствующим инфицированием HCV.
До конца не ясна прогностическая значимость ОГВИ после трансплантации печени, хотя и имеются данные, свидетельствующие о более быстром прогрессировании хронического заболевания печени у больных с сопутствующим ХГС [90, 91].
Также представляют интерес данные о возможном негативном влиянии ОГВИ на результаты интерферонотерапии при ХГС [7, 27].
Существуют доказательства того, что HBV, будучи одним из главных онкогенов (уступает лишь табакокурению [92]), может провоцировать развитие гепатоцеллюлярной карциномы (ГКЦ) даже при «оккультном» статусе данной инфекции у больных с хроническим заболеванием печени различной, в том числе невирусной, этиологии [37, 93]. C.W. Fwu и соавт. [94], наблюдавшие более 20 лет большую группу женщин на Тайване, установили не только значимо больший риск развития ГЦК у HBsAg-позитивных пациенток, но и достоверно более высокий риск рака печени у женщин с элиминированным HBsAg по сравнению с неинфицированными. Особая ценность этих выводов заключается в том, что исследование было выполнено у женщин, так как известно, что ГЦК у них развивается реже, чем у мужчин. G. Squadrito и соавт. [34] наблюдали развитие ГЦК у 13 из 37 больных с ХГС и ОГВИ и только у 5 из 57 больных с ХГС без сопутствующей ОГВИ (р < 0,01). Связь ОГВИ с развитием ГЦК у лиц как с сопутствующей HCV-инфекцией, так и без нее была подтверждена в целом ряде исследований [93, 95, 96].
Полагают, что при ОГВИ процессы онкогенеза развиваются аналогично тому, как это происходит при «классическом» варианте хронической HBV-инфекции. В настоящее время существует 2 объяснения участия HBV в онкогенезе. Считается, что первый – непрямой механизм – связан с персистирующими или рецидивирующими некровоспалительными изменениями в печени, приводящими к развитию цирроза как этапа возникновения опухоли. Второй – прямой механизм – определяется способностью вируса интегрироваться в человеческий геном и продуцировать белки с проонкогенной активностью, главным образом X-протеин и мутантные preS-S-протеины, напрямую индуцируя трансформацию гепатоцитов [92, 97].
Имеются указания на возможную связь ОГВИ с развитием не только ГЦК, но и внутрипеченочной холангиокарциномы и неходжкинской лимфомы [98, 99]. Несмотря на наличие достаточно серьезных аргументов, свидетельствующих о связи ОГВИ с онкогенезом, необходимо уточнить роль непосредственно HBV-инфекции в этом процессе, исключив воздействие других печеночных «канцерогенов», таких как HCV-инфекция , алкоголь, стеатоз и др.
Таким образом, ОГВИ представляет собой серьезную проблему как с эпидемиологической, так и с клинической точки зрения, многие аспекты которой нуждаются в дальнейшем изучении.


