Несмотря на успехи, достигнутые в области профилактики гепатита В (ГВ), данная патология по-прежнему сохраняет медицинскую и социально-экономическую значимость для Российской Федерации. Острота проблемы определяется широкой циркуляцией возбудителя среди населения, наличием множества клинических форм инфекции, включая бессимптомные и скрытые, а также частыми неблагоприятными исходами.
Динамика показателей заболеваемости острым ГВ (ОГВ) практически во всех федеральных округах (ФО) Российской Федерации имела схожие тенденции: резкий рост с середины 90-х годов и достижение пика показателей в 2000–2001 гг. Последующее снижение заболеваемости ОГВ во всех ФО было обусловлено проведением комплексных мер профилактики ГВ, в том числе последовательной реализацией программы массовой вакцинации населения. Так, к началу 2012 г. во всех ФО вакцинацией против ГВ было охвачено около 96% детей в возрасте от 0 до 17 лет, что в совокупности по России составило более 25 млн детей. Охват вакцинацией лиц в возрасте 18–55 лет к 2012 г. варьировал от 58,3% в Центральном ФО до 80,4% в Уральском ФО и составил в целом по стране более 52,6 млн человек. Таким образом, к настоящему времени охвачено вакцинацией против ГВ более половины населения Российской Федерации.
Наряду с благоприятной тенденцией к снижению показателей заболеваемости ОГВ в настоящее время сформировалась большая когорта больных хроническими формами инфекции, количество которых, по мнению специалистов, может превышать 3 млн человек [1]. Длительность течения хронических форм ГВ, которая исчисляется годами и десятилетиями, высокая репликативная активность вируса, способствуют накоплению мутантов, которые могут сосуществовать с диким типом вируса ГВ (ВГВ) в организме больного. Некоторые из этих мутантов могут получать селективное преимущество в условиях, когда иммунологические реакции направлены на уничтожение дикого типа [2, 3].
Мутантные формы вируса, несущие замены в а-детерминанте HBsAg и приводящие к конформационным изменениям основной иммунологической детерминанты поверхностного белка ВГВ, способны вызывать затруднения во взаимодействии антигенных эпитопов с нейтрализующими антителами, образующимися при вакцинации [4, 5]. Поэтому в организме лиц, вакцинированных против ГВ современными препаратами, в случае контакта с источником заражения HBsAg-мутантом создаются оптимальные условия для селекции HBsAg-мутантных вариантов, названных мутантами «вакцинального бегства» [6]. По мнению ученых [7–10], действие такого значимого селективного фактора, как массовая вакцинация, может привести к ускоренному распространению мутантных вариантов «вакцинального бегства».
Изменение свойств возбудителя, появление и распространение его мутантных вариантов, избегающих защитного действия вакцины, могут привести к изменениям динамики и тенденций проявления эпидемического процесса ГВ на территории Российской Федерации.
В Федеральном научно-исследовательском центре эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздрава России (далее – ФНИЦЭМ им. Н.Ф. Гамалеи) разработана эпидемиологическая модель, учитывающая распространение как дикого типа ВГВ, так и мутантных вариантов «вакцинального бегства» среди населения России [11, 12]. Применение адекватной математической модели позволяет установить численные закономерности процессов распространения ГВ на различных территориях и провести опережающие прогнозно-аналитические исследования, необходимые для научно-обоснованного планирования профилактических мероприятий.
Цель работы – определение практической адекватности модели и численных закономерностей распространения ГВ на территориях ФО Российской Федерации.
Материалы и методы
При создании эпидемиологической модели ГВ использованы материалы научной литературы о современных особенностях клиники и эпидемиологии ГВ [13, 14], данные о численности населения, а также результаты ретроспективного эпидемиологического анализа заболеваемости ГВ, путях передачи ВГВ, масштабах вакцинопрофилактики ГВ среди населения ФО Российской Федерации.
Материалом для проведения ретроспективного анализа заболеваемости ОГВ и хроническим ГВ, уровня носительства ВГВ послужили статистические данные Федерального центра гигиены и эпидемиологии Роспотребнадзора, представленные в ежегодных информационных сборниках «Инфекционная заболеваемость в субъектах Российской Федерации» за 1997–2012 гг. Анализ данных о заболеваемости ОГВ, путях передачи ВГВ и вакцинопрофилактике в разных возрастных группах за период 2009–2012 гг. проведен по материалам Референс-центра по мониторингу за вирусными гепатитами и аналитического сборника «Вирусные гепатиты в Российской Федерации» [15, 16]. Статистическая обработка материалов и результатов моделирования проведена с помощью программы MS Excel.
Эпидемиологическая модель ГВ разработана на основе теории математического моделирования эпидемий – эпиддинамики [17]. В связи с тем, что инфекционный процесс ГВ у детей имеет свои особенности, а доля детей в общей структуре заболеваемости ГВ (по результатами ретроспективного анализа официальных статистических данных о заболеваемости ГВ) оказалась незначительной, была разработана система уравнений математической модели, описывающая инфекционный процесс ГВ и отражающая проявления эпидемического процесса ГВ среди населения старше 14 лет.
Реализация математической модели распространения ГВ в виде компьютерной программы HBV-escapemut осуществлена с помощью технологии компьютерного моделирования EpidMod for Windows, разработанной в ФНИЦЭМ им. Н.Ф. Гамалеи [18].
Подробное описание эпидемиологической модели и результаты прогнозно-аналитических исследований для территории России изложены нами ранее [11].
Результаты и обсуждение
Динамика проявлений эпидемического процесса ГВ на различных территориях зависит от социальных, экономических, биологических, демографических факторов и поведенческих стереотипов населения. Их совокупность влияет на формирование и масштабы группы риска, на доминирование тех или иных путей передачи и их интенсивность.
Важным этапом установления практической адекватности (надежности) разработанной модели является проведение многочисленных испытаний (вычислительных экспериментов) на разных территориях.
Одной из основных задач моделирования при изучении эпидемического процесса ГВ является идентификация параметров модели, отражающих численные закономерности его развития на данной территории. В качестве идентифицируемых параметров модели были взяты:
- a – доля восприимчивых лиц из группы риска заражения ГВ;
- l1 – средняя частота передачи возбудителя, приводящая к заражению диким типом ВГВ от источников инфекции с учетом действующих путей и факторов передачи.
В процессе идентификации проводится поиск оптимального сочетания значений параметров модели, при котором достигается наилучшее соответствие модельных данных с фактическими. Степень соответствия (адекватность модели) оценивается на основе расчета среднеквадратичной процентной ошибки (Root Mean Square Percentage Error – RMSPE) [19].
В связи с тем, что регистрируются в основном желтушные формы ОГВ, которые составляют от 10 до 40% всех случаев заболевания, в качестве фактических данных были взяты «восстановленные» статистические данные о заболеваемости ОГВ (1991–2012 гг.). Подробное описание этапа «восстановления» статистических данных о заболеваемости ОГВ приведено в статье М.Н. Асатрян и соавт. [11] .
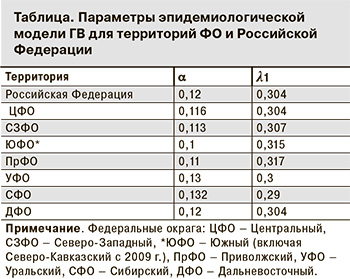
Проведены расчеты параметров модели для территорий 7 ФО и Российской Федерации в целом (см. таблицу).
Оптимальные значения параметров модели для территории Российской Федерации – l1 = 0,304 и a = 0,12. Среднеквадратичная процентная ошибка RMSPE составила 17%, что свидетельствует о достаточной адекватности разработанной модели [11].
Было установлено, что значения параметров модели для территорий ФО имеют незначительный разброс. Минимальное значение доли группы риска (a = 0,1) определено для ЮФО, максимальное (a = 0,132) – для СФО. Это означает, что доли групп риска заражения ГВ в разных ФО отличаются незначительно, составляя 10–13% от количества населения (старше 14 лет), проживающего на данной территории. Небольшим был разброс значений и для параметра λ1: минимальное (0,29) – в СФО, максимальное (0,317) – в ПФО. Эти результаты позволяют говорить о схожих характеристиках факторов и условий, влияющих на формирование и масштабы группы риска, а также на интенсивность путей передачи ВГВ на территориях всех ФО.
Примечательно, что сумма абсолютных значений величины группы риска по всем ФО, полученных в результате независимых расчетных исследований по модели для каждого ФО, практически соответствует аналогичному показателю, полученному с помощью модели для территории России:
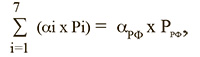
где ai – расчетная величина доли группы риска i-ой территории ФО;
Рi – количество населения (старше 14 лет) в i-ой территории ФО;
aРФ – расчетная величина доли группы риска для территории Российской Федерации;
РРФ – количество населения (старше 14 лет) Российской Федерации.
Очевидно, что показатель заболеваемости ОГВ (абсолютное значение) на территории страны представляет собой сумму показателей заболеваемости на территориях ФО. Такой же результат был получен при проведении независимых расчетных исследований с помощью модели: сумма годовых показателей заболеваемости ОГВ по всем ФО за расчетный период соответствует годовым показателям заболеваемости, полученным при моделировании для территории России в целом. Данный факт подтверждает правомерность выбора Российской Федерации в качестве территории моделирования для изучения распространения длительно протекающих инфекций.
 С помощью модели показано, что тактика вакцинации против ГВ, вызванного «диким» штаммом ВГВ, может оказывать влияние на скорость и интенсивность распространения мутантных вариантов «вакцинального бегства»: увеличение охвата населения вакцинацией против дикого штамма ВГВ при сохранении существующих тенденций – схожести факторов и условий, влияющих на распространение ВГВ, – может привести к ускорению распространения мутантных вариантов вируса «вакцинального бегства» [11] .
С помощью модели показано, что тактика вакцинации против ГВ, вызванного «диким» штаммом ВГВ, может оказывать влияние на скорость и интенсивность распространения мутантных вариантов «вакцинального бегства»: увеличение охвата населения вакцинацией против дикого штамма ВГВ при сохранении существующих тенденций – схожести факторов и условий, влияющих на распространение ВГВ, – может привести к ускорению распространения мутантных вариантов вируса «вакцинального бегства» [11] .
Вычислительные эксперименты в соответствии с базовым прогнозным сценарием при достигнутом к 2012 г. масштабе вакцинации населения и отсутствии мер противодействия распространению мутантных вариантов ВГВ показали, что в настоящий момент происходит «накопление потенциала» для распространения HBsAg-мутантных вариантов ВГВ: показатель заболеваемости ОГВ, вызванным мутантными вариантам, будет низким с незначительным ростом на протяжении десятка лет (40–50 лет), после чего возможен экспоненциальный рост заболеваемости ОГВ. Динамика заболеваемости ОГВ, обусловленным мутантными вариантами «вакцинального бегства», в ФО представлена на рисунке (см. на вклейке)
Также установлено, что суммарное число лиц с ОГВ, обусловленным HBsAg-мутантным вариантом, полученное в результате независимых экспериментов по всем ФО (89 000 человек к 2092 г.) имеет значение, близкое к аналогичному показателю по Российской Федерации (94 000 человек к 2092 г.). Базовый прогнозный сценарий рассчитан для территорий ФО при сохранении существующих тенденций – схожести факторов и условий, влияющих на распространение ВГВ на территориях всех ФО.
Таким образом, проведенные расчетные исследования для различных территорий показали, что разработанная эпидемиологическая модель ГВ является надежной и адекватно отражает проявления эпидемического процесса ГВ на территориях разных ФО и России в целом, что позволяет проводить прогнозирование с высокой степенью достоверности.
С помощью модели установлены численные закономерности процессов распространения ГВ на территориях ФО и России в целом. Выявлено, что значения идентифицируемых параметров для территорий 7 ФО имеют незначительный разброс: доля групп риска заражения ГВ в разных ФО составляет 10–13% от количества населения (старше 14 лет), проживающего на данной территории, а параметр l1 (средняя частота передачи возбудителя ГВ) определена в пределах 0,29–0,314. Полученные результаты идентификации параметров модели для территорий ФО, а также схожесть динамики заболеваемости ОГВ на этих территориях указывают на единство и одновременность воздействия факторов, которые обусловили распространение ГВ в однородных группах населения, наиболее подверженных риску заражения (группы риска).
Показано, что при достигнутом к настоящему времени масштабе вакцинации против ГВ и при сохранении существующих тенденций – схожести факторов и условий, влияющих на распространение ВГВ, – существует риск распространения мутантных вариантов «вакцинального бегства» ВГВ, который может привести к изменениям динамики и тенденций проявления эпидемического процесса ГВ на территории всей страны. Особую важность приобретают скрининг и мониторинг биологических свойств возбудителя с определением молекулярно-генетических характеристик выделенных вирусов и надзор за их распространением во всех регионах России. Коррекция параметров модели с учетом новых данных мониторинга о распространенности мутантных вариантов «вакцинального бегства» ВГВ на территориях ФО позволит с более высокой степенью достоверности прогнозировать динамику их распространения на среднесрочный период, что необходимо для научно обоснованного планирования мер противодействия.


