Проблема появления и распространения мутантных вариантов вируса гепатита В (ВГВ) становится все более значимой для практического здравоохранения. Большой интерес представляют HВsAg-мутантные варианты ВГВ, ускользающие от вакцинального контроля. Мутантные формы вируса, несущие замены в а-детерминанте HBsAg и приводящие к конформационным изменениям основной иммунологической детерминанты поверхностного белка ВГВ, способны вызывать затруднения во взаимодействии антигенных эпитопов с нейтрализующими антителами, образующимися при вакцинации [1, 2].
Впервые мутантные варианты «вакцинального бегства» были описаны в 1988 г., с тех пор исследования проводились весьма интенсивно. Опубликовано значительное количество научных работ, посвященных вариантам ВГВ по S-гену, наиболее значимыми из которых являются мутации G145R, K141E, T131I и инсерсия трех аминокислотных остатков в позиции 124 в связи с существенным нарушением антигенной структуры HВsAg [3–5].
Очевидно положительное влияние программы массовой вакцинопрофилактики гепатита В (ГВ) в России на заболеваемость острым ГВ (ОГВ). Однако проведенные отечественные исследования показали, что применяемые в настоящее время вакцины против ГВ практически не способствуют синтезу антител против ВГВ с наличием мутации G145R [6]. Как полагают ученые, широкое использование вакцин, не способных защитить от мутантов ВГВ, может постепенно привести к ускоренному распространению HBsAg-мутантных вариантов «вакцинального бегства» [7, 8].
Для оценки потенциальной эпидемиологической опасности мутантов, в том числе HBsAg-мутантных вариантов «вакцинального бегства», необходимы специальные долгосрочные исследования. Математическое моделирование эпидемического процесса ГВ, основанное на теории «эпиддинамики», позволяет провести опережающие прогнозно-аналитические исследования и установить численные закономерности процессов распространения ВГВ, в том числе HBsAg-мутантных вариантов «вакцинального бегства», что необходимо для поиска мер для предотвращения их распространения.
Целью работы явилось изучение процессов распространения мутантных вариантов «вакцинального бегства» ВГВ с помощью разработанной компьютерной модели.
Материалы и методы
Модель эпидемического процесса ГВ разработана на основе теории математического моделирования «эпиддинамики» Барояна–Рвачева [9, 10]. При создании модели эпидемического процесса ГВ использованы данные научной литературы о современных особенностях клиники и эпидемиологии ГВ, а также результаты ретроспективного эпидемиологического анализа заболеваемости ГВ, данные о масштабах вакцинопрофилактики ГВ среди населения Российской Федерации [11–14].
В связи с тем, что течение инфекционного процесса ГВ у детей имеет свои особенности, а также основываясь на данных ретроспективного анализа заболеваемости ГВ о незначительной доле детей в общей структуре заболеваемости ОГВ, хроническим ГВ (ХГВ) и носительства ВГВ, была определена задача разработки модели, описывающей проявления эпидемического процесса ГВ среди населения старше 14 лет, с последовательностью SEI3RF2, где S — состояние восприимчивости к ВГВ лиц из группы риска; E — стадия инкубации; I1 — стадия ОГВ; I11 — стадия ХГВ; I12 — стадия носительства ВГВ; R — стадия реконвалесценции; F11, F12 — финальная стадия хронических форм ГВ (развитие фиброза, прогрессирование ХГВ в цирроз и гепатоцеллюлярную карциному). Основываясь на данных литературы, в нашей модели были определены следующие временные интервалы для стадий-состояний инфекционного процесса ГВ у взрослых: инкубационный период — от 6 до 24 нед.; ОГВ — от 1 до 8 нед.; хронические формы ГВ — от 520 до 1600 нед.
Модель эпидемического процесса ГВ разрабатывается на основе распределенной модели развития инфекционного процесса ГВ с учетом действующих путей и факторов передачи возбудителя от источников инфекции к восприимчивым лицам. Математическая модель развития эпидемического процесса ГВ описывается сложной системой интегро-дифференциальных уравнений в частных производных с начальными и граничными условиями. С помощью технологии компьютерного моделирования EpidMod for Windows (Б. В. Боев), разработанной в НИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи Минздрава России (Москва), была реализована математическая модель эпидемического процесса ГВ в виде компьютерной программы HBV-escapemut (рис. 1, см. на вклейке).
Схематично модель эпидемического процесса ГВ [15] представлена двумя взаимосвязанными «контурами», описывающими единый процесс: 1) «верхний» — процесс распространения дикого штамма ВГВ; 2) «нижний» — процесс распространения HBsAg-мутантного варианта (см. рис. 1, на вклейке).
Схематично процесс распространения ВГВ среди населения территории описывается следующим образом: в результате первичного инфицирования множества лиц, восприимчивых к ВГВ (дикому и мутантному типу вируса) (Х1), после инкубационного периода (U1), развивается ОГВ (Y1). После перенесенного ОГВ большинство (90–95 %) лиц выздоравливают [ZR — лица в стадии реконвалесценции; ZR0 — лица с иммунитетом против ГВ (лица, переболевшие ГВ, вызванным диким типом, и не имеющие риска инфицирования HBsAg-мутантным вариантом ВГВ); ZR1 — лица, переболевшие ГВ, вызванным диким типом и имеющие риск инфицирования HBsAg-мутантным вариантом ВГВ]. У 1–10 % лиц, перенесших ОГВ, развивается стадия ХГВ (Y11) или носительства ВГВ (Y12). Исходами хронической ВГВ-инфекции, обозначенными в модели как финальные стадии (ZF11, ZF12), являются развитие фиброза, а у части больных — цирроза и первичного рака печени.
В «нижнем» контуре множество восприимчивых к HBsAg-мутантному варианту лиц (Х2) формируется из множества лиц, вакцинированных против ВГВ (дикого типа) (Х1 vac), а также из части лиц, переболевших ОГВ, вызванным диким типом ВГВ (ZR1), и имеющих риск инфицирования HBsAg-мутантным вариантом ВГВ, и некоторого количества лиц множества Х1. В настоящее время нет точных данных о влиянии HBsAg-мутантных вариантов на длительность стадий-состояний и исходы инфекционного процесса ГВ. Поэтому в нашей модели последовательность и длительность стадий-состояний инфекционного процесса с диким и мутантным штаммом приняты одинаковыми: U2, Y2, Y21, Y22, ZR2, ZF21, ZF22. При моделировании было сделано предположение о возможности заражения мутантным вариантом вируса лиц в стадии ZR1 в течение 1–10 лет. По данным литературы, HBsAg-мутантные варианты могут возникать естественным путем у хронических носителей, причем число и распространенность мутантов ВГВ в сыворотке больных изменяются как функция от времени, то есть длительность протекания инфекционного процесса способствует накоплению мутантов в организме больного. Носительство ВГВ часто сопровождается одновременным присутствием вируса дикого и мутантного типов. На основе данных предпосылок в модели была введена ν(t) — функция вероятности образования HBsAg-мутантных вариантов (у лиц с хроническими формами ГВ). Данные о распространенности HBsAg-мутантных вариантов на территории России пока ограничены. Для определения численных значений этой функции мы ориентировались на данные отечественных [16, 17] и зарубежных [18, 19] исследований.
Таким образом, для моделирования распространения HBsAg-мутантных вариантов «вакцинального бегства» были рассмотрены сценарии, учитывающие влияние различных величин вероятности образования мутантных вариантов «вакцинального бегства»: при ν(t) = 0,01 (или 1 %) и ν(t) = 0,1 (10 %). Горизонт моделирования и прогноза составил период с 1991 г. по 2092 г. В связи с этим был учтен коэффициент прироста населения, который был вычислен на основании статистических данных Госкомстата [20].
Адекватность разработанной модели определяется с помощью процедуры идентификации параметров модели из условий наилучшего совпадения расчетных (модельных) данных с фактическими данными. Проверка адекватности эпидемиологической модели ГВ проведена на основании «восстановленных» статистических данных о заболеваемости ОГВ (среди взрослых) в Российской Федерации за период 1991–2011 гг. с учетом рабочей гипотезы о 10 % манифестных форм ОГВ и 10 % формирования хронических форм ГВ. В качестве идентифицируемых параметров были взяты: λ1(t) — средняя частота передачи возбудителя, приводящая к заражению диким типом вируса ГВ от источников инфекции; α — начальная доля восприимчивых лиц из группы риска заражения ГВ среди населения; при заданных vacd(t) — функция вакцинации против ГВ (темп и объем вакцинации лиц с учетом иммунологической эффективности) и Ld(t) — функция, описывающая воздействие на механизм передачи возбудителя. Расчетные значения идентифицируемых параметров составили: λ1(t) = 0,304; α = 0,12. Среднеквадратичное отклонение расчетных данных от фактических по заболеваемости ОГВ лиц, старше 14 лет, за период 1991–2011 гг. составило 17 %, что свидетельствует о достаточной адекватности разработанной модели и позволяет проводить дальнейшие прогнозно-аналитические расчеты.
Результаты и обсуждение
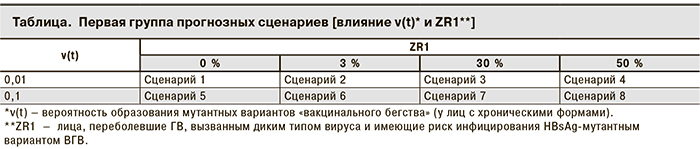
Первая группа прогнозных сценариев была составлена для проведения вычислительных экспериментов по изучению влияния на динамику распространения мутантных вариантов «вакцинального бегства» следующих параметров: ν(t) — вероятности образования мутантных вариантов «вакцинального бегства» (у лиц с хроническими формами ГВ) и ZR1 –количества лиц, переболевших ГВ, обусловленным диким типом и имеющих риск инфицирования HBsAg-мутантным вариантом ВГВ.
Были рассмотрены 8 сценариев, учитывающих вероятность образования HBsAg-мутантных вариантов (у лиц с хроническими формами ГВ) — ν(t), равную 0,01 или 0,1 при различном количестве лиц, переболевших ОГВ, вызванным диким типом и имеющих риск инфицирования HBsAg-мутантным вариантом ВГВ, и ZR1 = 0, 3, 30 и 50 % от всех переболевших после манифестных и бессимптомных форм ОГВ (см. таблицу).
Сценарии 1, 5 — изучение влияния изменения ν(t) на динамику распространения мутантных вариантов «вакцинального бегства» при ZR1 = 0 %.
Сценарии 2, 6 — изучение влияния изменения ν(t) на динамику распространения мутантных вариантов «вакцинального бегства» при ZR1 = 3 %.
Сценарии 3, 7 — изучение влияния изменения ν(t) на динамику распространения мутантных вариантов «вакцинального бегства» при ZR1 = 30 %.
Сценарии 4, 8 — изучение влияния изменения ν(t) на динамику распространения мутантных вариантов «вакцинального бегства» при ZR1 = 50 %.
На основе составленных сценариев были проведены расчеты по прогнозированию развития эпидемической ситуации по ГВ с учетом появления и распространения HBsAg-мутантных вариантов на долгосрочный (до 2092 г.) период среди взрослого населения России.
Как следует из рис. 2а (см. на вклейке), при ν(t) = 0,01, а ZR1 = 0 % (сценарий 1) и ZR1 = 3 % (сценарий 2) наблюдается медленный, но неуклонный рост числа случаев ОГВ, который достигнет к 2092 г. соответственно 72 000 и 95 000. При ZR1 = 30 % (сценарий 3) и ZR1 = 50 % (сценарий 4) происходит смещение влево пика заболеваемости ОГВ (что соответствует ускорению процесса распространения мутантных вариантов «вакцинального бегства») и увеличение значения пика заболеваемости. По сценарию 3 максимальное количество лиц с ОГВ отмечается к 2091 г. и составляет 365 000 человек, в то время как по сценарию 4 достижение пика заболеваемости смещается на более ранний срок (2079 г.) и его значение увеличивается до 464 000 человек.
На рис. 2б (см. на вклейке) представлены результаты прогнозирования по сценариям 5–8, соответствующие ν(t) = 0,1 и ZR1 = 0, ZR1 = 3 %, ZR1 = 30 % и ZR1 = 50 %.
Сравнение двух групп сценариев, представленных на рис. 2а (сценарии 1–4) и рис. 2б (сценарии 5–8), позволяет констатировать, что увеличение вероятности образования мутантов среди носителей и лиц с ХГВ в 10 раз [ν(t) = 0,1] приводит к значительному ускорению процесса распространения мутантных вариантов (смещение влево пика заболеваемости ОГВ). Так, при сравнении сценария 7 (пик в 2073 г.) со сценарием 3 (пик в 2091 г.) при ZR1 = 30 % отмечается более раннее (на 18 лет) достижение пика заболеваемости. Такой же эффект наблюдается при сравнении сценариев 4 и 8 (при ZR1 = 50 %): по сценарию 8 пик заболеваемости достигается на 16 лет ранее. При сравнении сценариев 6 и 2 (ZR1= 3 %) отмечается увеличение заболеваемости более чем в 2 раза в 2092 г., похожий результат наблюдается при сравнении сценариев 5 и 1 (ZR1= 0 %).
Для проведения дальнейших исследований в качестве базового был выбран сценарий 2, соответствующий значению вероятности образования мутантов ν(t) = 0,01 и ZR1= 3 %.
Следующая группа сценариев составлена для проведения вычислительных экспериментов по оценке влияния масштабов вакцинации против ГВ (дикого штамма) на скорость и интенсивность распространения мутантных вариантов ВГВ «вакцинального бегства»:
- сценарий vacd 0 — моделирование динамики заболеваемости ОГВ с HBsAg-мутантными вариантами без реализованной программы вакцинации против ГВ (дикого штамма);
- сценарий vacd real — моделирование динамики заболеваемости ОГВ с HBsAg-мутантными вариантами при достигнутом масштабе вакцинации против ГВ по данным на 2011 г. (с учетом иммунологической эффективности вакцинации);
- сценарий vacd high — моделирование динамики заболеваемости ОГВ с HBsAg-мутантными вариантами при дальнейшем увеличении охвата вакцинацией против ГВ.
Прогнозирование динамики распространения мутантов «вакцинального бегства» проведено при предположении о том, что современная вакцина (содержащая HBsAg дикого типа) не эффективна в отношении HBsAg-мутантов.
Результаты вычислительных экспериментов по обозначенным трем сценариям приведены на рис. 3 (см. на вклейке). Как видно на графике, по сценарию vacd 0 (без реализации программ вакцинации) наблюдается незначительное число случаев заболевания ОГВ, обусловленным HBsAg-мутантными вариантами, которые могут стать единичными к 2092 г. (голубая линия). По сценарию vacd-real (при достигнутом к 2011 г. масштабе вакцинации взрослого населения) заболеваемость ОГВ с мутантными вариантами будет иметь невысокие показатели вплоть до 2050-х гг., после чего наблюдается резкий (экспоненциальный) рост заболеваемости ОГВ (красная линия). По сценарию vacd high (дальнейшее увеличение масштаба вакцинации против ГВ) отмечается ускоренный рост количества случаев ОГВ, обусловленных HBsAg-мутантным вариантом, особенно заметный в поздние сроки исследуемого периода (зеленая линия).
Таким образом, предварительные результаты вычислительных экспериментов с моделью показали, что в настоящий момент происходит «накопление потенциала» для распространения HBsAg-мутантных вариантов ВГВ на территории России: показатель заболеваемости ОГВ, вызванным мутантными вариантами, будет находиться на низком уровне и иметь незначительный рост на протяжении 40–50 лет, после чего возможен выраженный подъем и пик заболеваемости ОГВ.
Проанализировано влияние параметров модели на динамику распространения мутантных вариантов «вакцинального бегства»: увеличение вероятности их образования у лиц с хроническими формами инфекции [ν(t)] и количества лиц, переболевших гепатитом, вызванным диким типом вируса и имеющих риск инфицирования HBsAg-мутантными вариантами (ZR1), приводит к интенсификации распространения мутантов. Исходя из полученных результатов, можно сделать вывод о важности проведения санитарно-просветительской работы среди целевой аудитории (лиц 15–40 лет) по вопросам профилактики против ГВ, особенно среди лиц с риском инфицирования HBsAg-мутантным вариантом ВГВ (потребители психотропных препаратов, лица с опасным половым поведением и др.).
С помощью моделирования показано, что тактика вакцинации против ГВ (дикого штамма ВГВ) может оказывать влияние на скорость и интенсивность распространения мутантных вариантов «вакцинального бегства»: увеличение охвата вакцинацией населения против дикого штамма ВГВ может привести к ускорению распространения мутантных вариантов вируса «вакцинального бегства». Результаты прогнозирования обосновывают необходимость разработки рекомбинантных вакцин нового поколения, обеспечивающих индукцию протективного иммунитета как против дикого типа ВГВ, так и против HBsAg-мутантных его вариантов для предупреждения их распространения.


