Острые респираторные инфекции являются наиболее распространенными заболеваниями человека и одной из основных причин госпитализаций (до 33% от всех госпитализаций детей), составляя при этом до 7% от всех причин смерти детей в стационарах. До 90% респираторных инфекций имеют вирусную природу. К этой группе заболеваний относят грипп, парагрипп, риновирусную, аденовирусную, респираторно-синцитиальную, реовирусную инфекции, среди которых наиболее тяжелой по клиническим проявлениям, частоте осложнений и неблагоприятным исходам болезни является грипп [1–4]. Высокая частота эпизодов острых респираторных вирусных инфекций (ОРВИ), доходящая порой до 10–15 раз в год у часто болеющих детей (ЧБД), играет важную роль в нарушении процессов социализации ребенка, является основополагающим моментом в срыве адаптации, ухудшает качество жизни и наносит большой экономический ущерб. Важную роль в формировании группы часто и длительно болеющих детей играют функциональные особенности иммунной системы детей раннего возраста: незрелость макрофагально-фагоцитарного звена, склонность к незавершенному фагоцитозу, сниженная продукция интерлейкинов, низкая цитотоксическая активность CD8+-лимфоцитов и естественных киллеров, ослабленные процессы активации системы комплемента, дефицит IgA, снижение продукции эндогенного интерферона-альфа (ИФН-α) [5, 6].
Перспективным направлением современной терапии и профилактики ОРВИ у ЧБД является использование иммунотропных препаратов, в частности индукторов эндогенного ИФН [7, 8].
Индукторы ИФН обладают универсально широким диапазоном антивирусной активности и выраженным иммуномодулирующим эффектом. На фоне их применения синтез эндогенного ИФН сбалансирован, контролируется организмом, что предотвращает ряд побочных эффектов, характерных для экзогенно вводимых ИФН [8]. Одним из индукторов эндогенных ИФН-α и -γ, широко используемых в комплексной терапии вирусно-бактериальных инфекций у детей, является отечественный препарат анаферон детский (АН).
АН содержит антитела к ИФН-γ, аффинно очищенные в релиз-активной форме. Релиз-активные антитела к ИФН-γ оказывают специфическое модифицирующее действие на антиген, к которому они выработаны, вызывая конформационные изменения в молекуле ИФН-γ, усиливают взаимодействие ИФН-γ с его рецептором и изменяют аффинность взаимодействия ИФН-γ с антителами к нему [9–11].
Целью работы явилось исследование клинических особенностей течения ОРВИ у ЧБД и определение эффективности профилактического лечения препаратом АН.
Материалы и методы
В ходе работы проводили оценку клинического течения острых респираторных инфекций в 2 группах больных в возрасте от 3 до 6 лет, госпитализированных в МУЗ «5-я детская инфекционная больница» (Саратов) в 2013 г.: основная группа – 20 ЧБД и группа сравнения – 20 редко болеющих детей (РБД). Мальчиков было 24 (60%), девочек – 16 (40%). Больные в группах были репрезентативны по возрасту, полу, и этиологии острых респираторных инфекций.
Этиологический диагноз расшифрован у 20 (50%) пациентов методами иммунохромотографии мазка из носоглотки, иммуноферментного анализа крови и полимеразной цепной реакции крови: грипп А диагностирован в 8 (20%) случаях (у 4 больных ЧБД и 4 больных РБД), грипп В – в 2 (5%), аденовирусная инфекция – в 2 (5%), парагрипп – в 6 (15%), респираторно-синтициальная инфекция – в 2 (5%), ОРВИ неустановленной этиологии – в 20 (50%).
Изучали общеклинические лабораторные показатели и показатели иммунного статуса c оценкой общего уровня IgG, IgM, IgE, IgA, ИФН-α и ИФН-γ. Исследования показателей гемограммы и иммунного статуса проводили в динамике – в 1-е сутки стационарного лечения и через 3 мес. после проведения курса профилактического лечения ЧБД препаратом АН внутрь по схеме: 1 таблетка 1 раз в день сублингвально в течение 3 мес.

Инфекционный индекс (ИИ) рассчитывали как отношение числа эпизодов ОРВИ за прошедший год к возрасту ребенка в годах.
Эффективность профилактического курса применения препарата АН оценивали по снижению частоты эпизодов ОРВИ (по сравнению с частотой эпизодов ОРВИ в течение одного предшествующего года). Отдельно рассчитывали коэффициент эпидемиологической эффективности в группе ЧБД к моменту окончания терапии по формуле: К = (В–А)/В × 100%, где В – показатель заболеваемости в группе до лечения, А – показатель заболеваемости в группе после лечения.
Статистическую обработку полученных результатов проводили на персональном компьютере при использовании пакета электронных таблиц Microsoft Excel 7.0 и графического редактора Microsoft Graf 5.0. Определяли M ± m, доверительный интервал и двухвыборочный t-тест Стьюдента.
Результаты и обсуждение
Все больные госпитализированы в стационар в первые трое суток заболевания. В основной группе часто и длительно болеющих детей средняя частота эпизодов ОРВИ у пациентов составляла 7,4 ± 0,71 раза в год (от 5 до 10 раз), ИИ – 2,03.
В группе РБД средняя частота эпизодов ОРВИ была в 2,4 раза меньше и составляла 3,1 ± 0,80 заболевания в год (от 2 до 4 раз), ИИ – 0,85.
80% пациентов в группе ЧБД имели фоновую патологию: анемию – 10 (50%) детей, гипотрофию – 2 (10%), ожирение – 2 (10%), отягощенный аллергологический анамнез – 6 (30%). Сопутствующие хронические заболевания в этой группе выявлены у 6 (30%) детей: хронический пиелонефрит – у 2 (10%), дисметаболическая нефропатия – у 2 (10%), бронхиальная астма – у 2 (10).
В группе РБД фоновая патология выявлена в 20% случаев (анемия у 4 больных), хронических заболеваний у детей не было.
В 70% случаев в группе ЧБД ОРВИ протекала в среднетяжелой форме, в 30% случаев зарегистрирована тяжелая форма.
В группе сравнения тяжелая форма ОРВИ встречалась в 3 раза реже – в 10% случаев. Все тяжелые формы респираторных инфекций у больных были обусловлены осложнением заболевания внебольничной пневмонией. В клинической картине у больных с тяжелой формой ОРВИ было характерно острое начало заболевания, фебрильная лихорадка, вялость и катаральные симптомы.
Катаральные симптомы поражения верхних дыхательных путей при поступлении были выражены у всех пациентов: ринофарингит в 90% случаев, фаринготонзиллит – в 10%.
У 90% больных основной группы выявлено поражение нижних дыхательных путей: острый бронхит – у 40%, обструктивный бронхит – у 20%, внебольничная полисегментарная пневмония – у 30%. В большинстве случаев поражение нижних дыхательных путей было диагностировано в первые трое суток заболевания.
В группе РБД поражение нижних дыхательных путей отмечено в 3 раза реже (в 30% случаев) в виде острого бронхита (в 20%) и внебольничной сегментарной пневмонии (в 10%).
Для больных группы ЧБД с острыми респираторными заболеваниями (ОРЗ) тяжелой формы, осложненными пневмонией, было характерно появление с первых дней заболевания кашля (продолжительностью до 8,50 ± 0,30 сут.), на 3–4-е сутки – локальных симптомов поражения нижних дыхательных путей и дыхательной недостаточности II степени со снижением сатурации кислорода, по данным пульсоксиметрии, менее 95%.
У ЧБД, в отличие от РБД, симптомы дыхательной недостаточности были в 3 раза дольше (до 4,50 ± 0,50 сут.; р < 0,01). Продолжительность лихорадки у ЧБД по сравнению с РБД была в 2,4 раза дольше (р < 0,01), симптомов интоксикации и кашля – в 1,5 раза дольше (р < 0,05). Продолжительность стационарного лечения ЧБД составила 8,3 ± 0,60 сут., что 2,5 сут. дольше, чем у РБД – 5,78 ± 0,75 сут.; р < 0,01 (табл. 1).
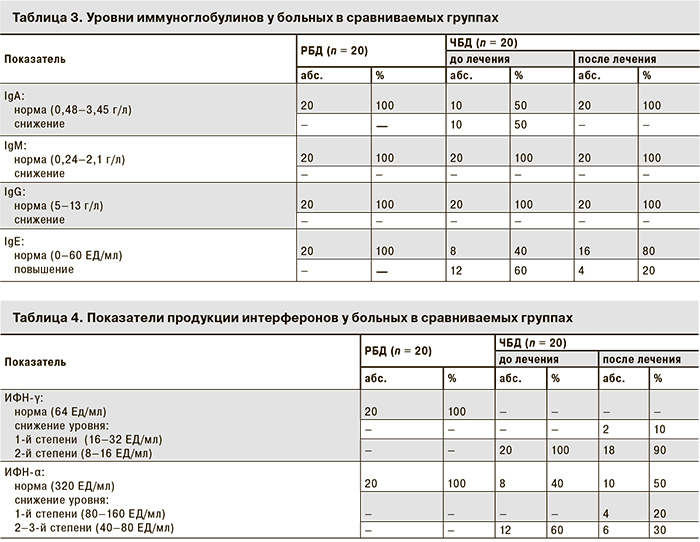
При поступлении в стационар у 50% ЧБД наблюдали снижение показателя IgA в 1,3 раза, у 60% больных – повышение уровня IgE в 3,3 раза, что указывало на снижение местного иммунитета и высокий уровень сенсибилизации в исследуемой группе. У больных в группе РБД показатели иммуноглобулинов были в пределах нормы (табл. 2).
У пациентов из группы ЧБД регистрировали недостаточность системы ИФН по продукции ИФН-γ 2-й степени и у 60% больных –недостаточность системы ИФН по продукции ИФН-α 2–3-й степени. В группе РБД у всех пациентов показатели продукции ИФН-α и ИФН-γ были в пределах нормы (табл. 3).
Таким образом, выявленные иммунные нарушения у ЧБД доказывали необходимость назначения иммунокоррегирующей терапии, направленной на профилактику повторных эпизодов ОРВИ у больных, страдающих рецидивирующими респираторными инфекциями.
Иммунокоррегирующую терапию ЧБД проводили препаратом АН внутрь по схеме: 1 таблетка 1 раз в день сублингвально в течение 3 мес. после выписки больных из стационара.
Через 3 мес. после проведения курса профилактического лечения у ЧБД частота эпизодов ОРВИ уменьшилась в 1,7 раза. Средняя частота заболеваний ОРВИ у ЧБД за прошедшие 3 мес. равнялась 1,1, что в пересчете на 12 мес. составляет 4,4 случая заболевания в год. За время лечения препаратом АН тяжелые формы респираторных инфекций зарегистрированы не были. ИИ у ЧБД снизился с 2,03 до 1,21 (см. табл. 2). Коэффициент эпидемиологической эффективности в группе ЧБД к моменту окончания терапии составил 50%.
Через 3 мес. после курса профилактического лечения препаратом АН у всех пациентов из группы ЧБД выявлены нормальные показатели IgA, IgG, IgM и снижение уровня IgE в крови на 40% по сравнению с исходным показателем, что указывает на снижение уровня сенсибилизации в исследуемой группе (см. табл. 3).
При повторном исследовании показателей системы ИФН у ЧБД было зарегистрировано уменьшение степени иммунных нарушений: нормальные показатели продукции ИФН-α в 50% случаев (против 40% до лечения), снижение недостаточности системы ИФН по продукции ИФН-α 1-й степени – в 20% случаев и 2-й степени – до 30% (против 60% до лечения) в сочетании с недостаточностью системы ИФН по продукции ИФН-γ 1-й степени – в 10% случаев и 2-й степени – до 90% (против 100% до лечения) (табл. 4), что подтвердило эффективность проведенного курса иммунокоррегирующей терапии препаратом АН.
Побочных и нежелательных эффектов за время лечения препаратом АН у пациентов не зарегистрировано.
Таким образом, ОРВИ у ЧБД имеют ряд клинических особенностей: в 90% случаев заболевания протекают с поражением нижних дыхательных путей, выраженными симптомами интоксикации, длительными катаральными симптомами. 80% больных с рецидивирующими респираторными инфекциями имеют фоновую патологию, 30% ЧБД имеют отягощенный аллергологический анамнез и сопутствующие хронические заболевания.
У всех пациентов из группы ЧБД выявлена недостаточность системы ИФН по продукции ИФН-γ и у половины больных – недостаточность системы ИФН по продукции ИФН-α 2–3-й степени и высокий уровень IgE, что указывает на значительные нарушения гуморального звена иммунитета и повышенный уровень сенсибилизации в исследуемой группе.
На фоне профилактического лечения препаратом АН у ЧБД в течение 3 мес. отмечена положительная динамика: уменьшение частоты эпизодов ОРВИ в 2 раза, снижение ИИ в 1,7 раза, отсутствие тяжелых форм заболевания, побочных и нежелательных эффектов, снижение уровня сенсибилизации и увеличение продукции ИФН-γ, что подтверждает эффективность и безопасность проведенного курса иммунокоррегирующей терапии препаратом АН.


