В структуре инфекционной патологии у детей ведущее место принадлежит острым респираторным инфекциям (ОРИ) [1, 2]. Среди больных выделяют особую группу – часто болеющие дети (ЧБД). На их долю приходится более 80% случаев заболеваний дыхательных путей у детей [3]. На сегодняшний день в медицинской литературе не существует общепринятого определения неоднородной группы пациентов с повторными заболеваниями ОРИ. Согласно оценкам западных исследователей [4], 25% детей первого года жизни и 18% детей в возрасте от 1 года до 4 лет болеют рекуррентными инфекциями дыхательных путей. Понятие «рецидивирующее заболевание» относят к одной нозоформе, например, рецидивирующий отит и др. [5]. В соответствии с официальными отечественными рекомендациями принятый термин «ЧБД» не является нозологической формой или диагнозом, он обозначает группу диспансерного учета, охватывающую пациентов с более высоким уровнем заболеваемости ОРИ в год по сравнению со сверстниками. У ЧБД под маской рекуррентных респираторных заболеваний нередко протекают патологии ЛОР-органов, дыхательных путей, желудочно-кишечного тракта, аллергические заболевания, врожденные аномалии развития [5]. В последнее время отмечена тенденция к возрастанию частоты ОРИ в раннем возрасте, обусловленной незрелостью иммунитета, увеличением контактов при поступлении в детские дошкольные учреждения, особенно в период подъема сезонной заболеваемости [6]. Число эпизодов ОРИ в течение года для включения ребенка в группу ЧБД обсуждается и по настоящее время, хотя большинство специалистов придерживается критериев, разработанных А.А. Барановым и В.Ю. Альбицким [7]: снижение частоты заболеваний с 6 на первом году жизни до 3–4 раз в год в старшей возрастной группе. Единодушно мнение исследователей о необходимости выявления причин, способствующих развитию повторной заболеваемости, и разработки предложений по оздоровлению детей, в том числе с использованием иммуномодулирующих средств [8–11].
Тем не менее недостаточно внимания уделяется реабилитации ЧБД разных возрастных групп в санаторных условиях, с применением средств, содержащих одновременно пробиотические штаммы и витаминно-минеральный комплекс, повышающих противоинфекционную резистентность организма.
Цель исследования – оценка эффективности реабилитации ЧБД в возрасте 7–10 лет в условиях санатория с использованием в комплексе оздоровительных мероприятий Бион®3 Кид.
Задачи исследования:
- охарактеризовать состояние ЧБД при поступлении в санаторий в межморбидный период (вне эпизодов ОРИ);
- проанализировать динамику клинико-лабораторных показателей в период пребывания детей в санатории;
- выявить влияние сопутствующей патологии на лабораторные показатели у ЧБД;
- оценить результаты лечения, проведенного в условиях детского санатория, а также включения в комплекс оздоровительных мероприятий Бион®3 Кид и его влияние на частоту возникновения и особенности течения ОРИ.
Материалы и методы
Проспективное открытое рандомизированное сравнительное исследование проводилось на базе подмосковного Центрального клинического санатория для детей с родителями «Малаховка» Федерального медико-биологического агентства России в период сезонного подъема заболеваемости 2012–2013 гг.
Под наблюдением находились 78 детей в возрасте 7–10 лет, состоявших на диспансерном учете в поликлинике как ЧБД в связи с более высоким, чем у сверстников, уровнем заболеваемости ОРИ (согласно критериям, разработанным А.А. Барановым и В.Ю. Альбицким, – 4 и более раз в год), в первичной документации которых отсутствовали сведения о стойких врожденных и наследственных заболеваниях. В анамнезе, наряду с повторными ОРИ, имелись указания на хронические заболевания ЛОР-органов (20%), желудочно-кишечного тракта (42,8%) и других систем. За 2 месяца до исследования у 15,3% детей отмечено обострение хронической соматической патологии. 29,4% пациентов перенесли ОРИ, половина из них получала антибактериальную терапию.
Исследование проведено в двух параллельных группах, рандомизированных методом конвертов: основная группа (n = 35) и группа сравнения (n = 43). Группы не имели достоверных отличий по возрасту, полу, данным анамнеза и частоте регистрации клинических показателей. Лабораторные исследования проводили дважды: на 2-й (в момент включения в исследование) и на 20-й день пребывания в санатории. Всем детям назначали базисные оздоровительные мероприятия: лечебное питание, массаж, физиопроцедуры, ЛФК, посещение галокамеры, бассейна, прием минеральной воды, кислородного коктейля. Пациентам основной группы дополнительно назначали Бион®3 Кид по 1 жевательной таблетке в день в течение 30 дней.
БАД Бион®3 Кид (свидетельство о государственной регистрации № RU.77.99.11.003.E.004614.12.10) содержит комбинацию подобранных пробиотических культур Tribion® Harmonis (Lactobacillus gasseri РА 16/8, Bifidobacterium bifidum MF 20/5, Bifidobacterium longum SP 07/3) и витаминно-минеральный комплекс (витамины А, С, D, Е, витамины группы В и минералы – Ca, Fe, Zn) в дозах, соответствующих возрастным потребностям.
Кроме ежедневного клинического осмотра всем детям двукратно проведено общеклиническое исследование крови и мочи; определение количественного и качественного состава микробиоты слизистых оболочек ротоглотки и кишечника, выполненное бактериологическим методом Р.В. Эпштейн-Литвак; определение содержания короткоцепочных жирных кислот (КЖК) методом газожидкостной хроматографии с использованием аппаратно-программного комплекса для медицинских исследований на базе хроматографа «Хроматек-Кристалл 5000».
Результаты исследования подвергались статистической обработке с использованием методов параметрической и непараметрической статистики (С. Гланц, 1999; А. Банержи, 2007) с применением программ Statistica 6.0, Microsoft Office Excel 2007. Достоверно значимыми считали различия при p < 0,05.

Результаты и обсуждение
При направлении в санаторий детей определяли как «практически здоровых». Целенаправленный опрос и осмотр детей выявил, что 75,6% из них имели какие-либо отклонения в состоянии здоровья: активные жалобы предъявляли 62,8% детей, а при осмотре были выявлены: хейлит (5,1%), запах изо рта (6,5%), нарушение носового дыхания (11,5%), сухость кожи (41%), обложенность языка (53,8%), гиперплазия миндалин (57,6%), полиаденопатия (41%). При этом гиперплазия небных миндалин, аденоидных вегетаций достоверно чаще (р = 0,05) наблюдалась у детей, перенесших накануне ОРИ и имевших сопутствующую ЛОР-патологию, а на абдоминальные боли и диспепсические расстройства (р = 0,05) жаловались ЧБД с хронической гастроэнтерологической патологией.
Показатели гемограммы и общего анализа мочи находились в пределах возрастной нормы, что указывало на отсутствие острого воспалительного процесса.
После проведения реабилитационной терапии у пациентов обеих групп число активных жалоб снизилось не менее чем в 3 раза. В группе сравнения реже стали регистрировать абдоминальный синдром, измененный характера стула, обложенность языка. У детей, получавших Бион®3 Кид перед выпиской из санатория, отмечено также улучшение состояния кожных покровов и отсутствие каких-либо субъективных жалоб на состояние здоровья.
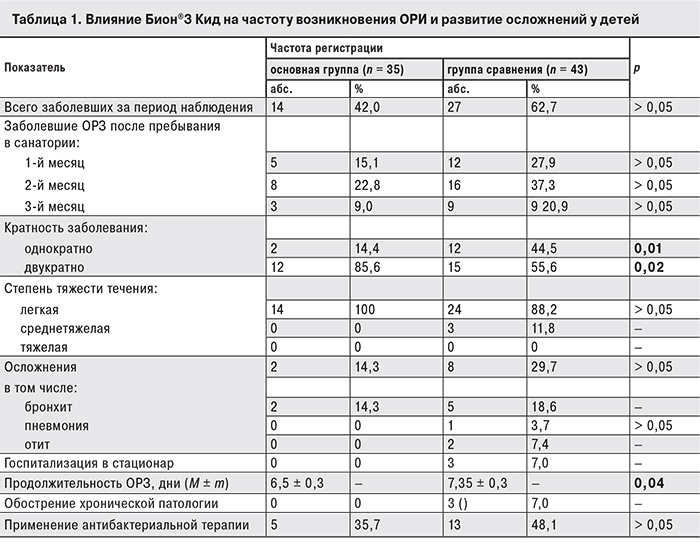
 Одним из важнейших факторов оценки оздоровления служит подверженность детей респираторным заболеваниям. При формировании детских коллективов, особенно в периоды сезонных подъемов респираторной заболеваемости, возрастает риск заражения воздушно-капельными инфекциям. Случаем ОРИ считали появление одного или нескольких симптомов поражения дыхательных путей: ринита, фарингита, кашля, повышения температуры, интоксикации. В период пребывания в санатории в основной группе зарегистрировано 4 (11,4%) случая ОРИ, протекавшей с катаральными проявлениями, но без повышения температуры тела и с редким кашлем. Средняя продолжительность ОРИ в основной группе составила 5,75 ± 0,2 дня, в группе сравнения – 7,0 ± 0,26 дня (р ≤ 0,05). При наблюдении в катамнезе (табл. 1) в группе сравнения эпизоды ОРИ возникали достоверно чаще (р = 0,02), у 11,4% детей температура тела повышалась до субфебрильных цифр, у 2,9% – до фебрильных цифр с проявлением интоксикации; у 10 (23,2%) детей был кашель.
Одним из важнейших факторов оценки оздоровления служит подверженность детей респираторным заболеваниям. При формировании детских коллективов, особенно в периоды сезонных подъемов респираторной заболеваемости, возрастает риск заражения воздушно-капельными инфекциям. Случаем ОРИ считали появление одного или нескольких симптомов поражения дыхательных путей: ринита, фарингита, кашля, повышения температуры, интоксикации. В период пребывания в санатории в основной группе зарегистрировано 4 (11,4%) случая ОРИ, протекавшей с катаральными проявлениями, но без повышения температуры тела и с редким кашлем. Средняя продолжительность ОРИ в основной группе составила 5,75 ± 0,2 дня, в группе сравнения – 7,0 ± 0,26 дня (р ≤ 0,05). При наблюдении в катамнезе (табл. 1) в группе сравнения эпизоды ОРИ возникали достоверно чаще (р = 0,02), у 11,4% детей температура тела повышалась до субфебрильных цифр, у 2,9% – до фебрильных цифр с проявлением интоксикации; у 10 (23,2%) детей был кашель.
Расчет критериев риска пользы–вреда свидетельствует, что назначение Бион®3 Кид снижает риск возникновения ОРИ на 24,3% (САР) или в 3 раза (ОР), а шансы у конкретного больного – в 4 раза (ОШ).
Представленные данные демонстрируют не только снижение частоты возникновения ОРИ, но и снижение тяжести течения, что позволило избежать назначения антибактериальной терапии, сократить объем симптоматической терапии и в целом, к выписке из санатория, иметь более позитивные клинические и микробиологические результаты реабилитации у детей основной группы.
При оценке состояния микробиоты слизистых оболочек ротовой полости у здоровых детей в соответствии с использованными нормативами, разработанными ФГУН Московский НИИ эпидемиологии и микробиологии им. Г.Н. Габричевского Роспотребнадзора, выделяют облигатные микроорганизмы: α- и γ-гемолитические стрептококки (105–107КОЕ/мл) в ассоциации с нейссериями (104–107 КОЕ/мл), лактобациллы и бифидобактерии (102–106 КОЕ/мл). В составе факультативной микрофлоры допустимо выделение в небольшом количестве (≤ 10⁴ КОЕ/мл) коагулазоотрицательных стафилококков, непатогенных типов гемофильной палочки и нетоксигенных видов коринобактерий в пределах 5–40%. В единичных случаях в количестве 102–103 КОЕ/мл могут обнаруживаться микроорганизмы транзиторной группы: энтеробактерии, псевдомонады, β-гемолитические стрептококки групп В и D, энтерококки и дрожжеподобные грибы. Выявление монокультур, обнаружение транзиторной микрофлоры в значительных количествах (≥ 104 КОЕ/мл), их ассоциаций, а также полное отсутствие роста микроорганизмов относят к глубоким дисбиотическим нарушениям в ротоглотке [12].
У обследованных нами детей в 89,7% случаев были обнаружены существенные изменения в микробиоте ротоглотки, обусловленные преимущественно уменьшением содержания облигатных микроорганизмов: отсутствие бифидобактерий и лактобацилл (82,1%); снижение количества и изменение видового состава стрептококков (88,4%) с появлением Streptococcus группы В (3,84%), Streptococcus pneumoniae (1,2%), Streptococcus группы D (Enterococcus fecalis – 24,4%, Enterococcus fecium – 11,5%); уменьшение количества и смена видов сапрофитных нейссерий (65,3%). В добавочной микрофлоре вырос уровень стафилококков (60,2%), преимущественно за счет увеличения количества Staphylococcus aureus вырос до 10⁴–10⁵ КОЕ/мл (56,4%). В 57,1% случаев были обнаружены микроорганизмы транзиторной группы, в том числе в ассоциациях (11,1%) и монокультуре (9,5%). Отсутствие бактериального роста выявлено в 1,3% наблюдений. Очевидно, значительный рост микроорганизмов, несвойственных биотопу ротоглотки, обусловлен угнетением защитной роли основных представителей облигатной микрофлоры.
В показателях микробиоты ротоглотки перед выпиской из санатория у пациентов основной группы обнаружена положительная динамика: частота выделения бактерий транзиторной группы снизилась с 65,7 до 22,8% (р = 0,012); в группе сравнения изменения отсутствовали (р = 0,838). У детей основной группы реже (в 2,9% случаев вместо17,9%; р = 0,044) определялись ассоциации представителей транзиторной группы на фоне заметного роста облигатных бактерий (стрептококков, нейссерий, лактобацилл), что соответствовало большей нормализации показателей состояния микрофлоры ротоглотки в основной группе (табл. 2).
 У 94,9% ЧБД выявлены изменения качественно-количественного состава кишечной микрофлоры: снижение количества бифидобактерий на 1–3 порядка (75,6%), снижение роста лактобацилл (53,6%) и полноценной кишечной палочки (92,3%), увеличение лактозонегативных (28,2%) и гемолизирующих (30,8%) эшерихий. Грибы Candida albicans обнаружены у 23,1% пациентов, а лактозонегативные энтеробактерии – у 20,5%. Отмечены различия в микробиоте в зависимости от отягощающих сопутствующих факторов. Так, у пациентов, недавно перенесших ОРИ, достоверно чаще наблюдались повышение содержания кишечной палочки с гемолизирующими свойствами (44,4% против 19,6%; р = 0,040) и наибольший дефицит бифидобактерий (41,6% против 20,1%, р = 0,05). В фекальной микрофлоре ЧБД с сопутствующей хронической гастроэнтерологической патологией (ХГЭП) в 33% случаев присутствовали дрожжеподобные грибы Candida albicans с высокой степенью колонизации (10⁵ КОЕ/г), а также высевались неферментирующие бактерии Acinetobacter (6,6%). У детей с аллергической патологией в 58,4% случаев регистрировались бифидобактерии в низких концентрациях (≤ 106 КОЕ/г) и снижение роста лактобацилл на 1–3 порядка. Таким образом, нарушение микробного равновесия фекальной микробиоты, по-видимому, также связано с угнетением защитной функции облигатных микроорганизмов, не препятствующих росту условно-патогенной микрофлоры.
У 94,9% ЧБД выявлены изменения качественно-количественного состава кишечной микрофлоры: снижение количества бифидобактерий на 1–3 порядка (75,6%), снижение роста лактобацилл (53,6%) и полноценной кишечной палочки (92,3%), увеличение лактозонегативных (28,2%) и гемолизирующих (30,8%) эшерихий. Грибы Candida albicans обнаружены у 23,1% пациентов, а лактозонегативные энтеробактерии – у 20,5%. Отмечены различия в микробиоте в зависимости от отягощающих сопутствующих факторов. Так, у пациентов, недавно перенесших ОРИ, достоверно чаще наблюдались повышение содержания кишечной палочки с гемолизирующими свойствами (44,4% против 19,6%; р = 0,040) и наибольший дефицит бифидобактерий (41,6% против 20,1%, р = 0,05). В фекальной микрофлоре ЧБД с сопутствующей хронической гастроэнтерологической патологией (ХГЭП) в 33% случаев присутствовали дрожжеподобные грибы Candida albicans с высокой степенью колонизации (10⁵ КОЕ/г), а также высевались неферментирующие бактерии Acinetobacter (6,6%). У детей с аллергической патологией в 58,4% случаев регистрировались бифидобактерии в низких концентрациях (≤ 106 КОЕ/г) и снижение роста лактобацилл на 1–3 порядка. Таким образом, нарушение микробного равновесия фекальной микробиоты, по-видимому, также связано с угнетением защитной функции облигатных микроорганизмов, не препятствующих росту условно-патогенной микрофлоры.
По окончании оздоровительного лечения в фекальной микрофлоре также отмечена тенденция к восстановлению (рис. 1). В основной группе с 84,8 до 93,9% выросло число детей с высоким (≥ 10⁸ КОЕ/г) уровнем бифидобактерий, отмечен более частый прирост количества лактобацилл (33,3% против 11,1% в группе сравнения; р = 0,024). Перед выпиской из санатория их дефицит в основной группе встречался достоверно реже (42,4% против 66,7% соответственно; р = 0,029). В группе сравнения, напротив, число детей с уровнем бифидобактерий 10⁸ КОЕ/г снизилось на 11,1% на фоне прироста транзиторных микроорганизмов и организмов, не свойственных биотопу. У детей основной группы частота высева грибов Candida albicans снизилась с 36,4 до 9,1% (р = 0,039); в группе сравнения статистической динамики не выявлено (22,2% против 11,1%, р = 0,505).
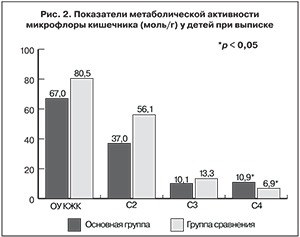
Результаты изучения метаболической активности микрофлоры кишечника методом газожидкостной хроматографии позволили оценить совокупную функциональную активность кишечных бактерий и характер структурного дисбиоза путем определения продуктов ферментации (КЖК), производимых собственными анаэробами толстой кишки. Уровень КЖК и их соотношение отражают полноценность функционирования микробиоты. КЖК содержат 2–4 атома углерода и обозначаются как кислоты: уксусная – С2, пропионовая – С3, масляная – С4. В профиле КЖК принято рассчитывать относительные доли С2, С3 и С4, характеризующие сбалансированность микрофлоры. В норме процентное соотношение этих кислот в структуре микрофлоры кишечника составляет 60:25:15. При увеличении доли С2 говорят о сдвиге в структуре микрофлоры в сторону аэробных бактерий, в том числе патогенных и условно-патогенных (уксуснокислый тип брожения). Увеличение доли С3 свидетельствует о преобладании бактерий с пропионокислым типом брожения, С4 – с маслянокислым.
Общий уровень (ОУ) кислот, продуцируемый совокупностью кишечных бактерий, отражает интегральную активность микрофлоры и абсолютные концентрации С2, С3, С4, iC4, С5, iC5, C6, iC6. В качестве расчетных использовались следующие показатели: анаэробный индекс (АИ) – показатель популяционного соотношения строгих анаэробов к факультативно-анаэробным популяциям и индекс изокислот (ИИ) – соотношение нормальных кислот и изо-форм [13].
Как видно из рис. 2, у всех без исключения ЧДБ выявлены нарушения метаболической активности микрофлоры – количественные или структурные. ОУ КЖК был снижен преимущественно за счет уменьшения концентраций основных кислот (C2, С3, С4). Так, у 38,5% детей были обнаружены низкие (< 70% от нормы), а у 30% – высокие (> 130% от нормы) концентрации КЖК. Преобладание аэробных бактерий в структуре микрофлоры (низкий АИ) встречалось редко (6,4%). Значительно чаще (35,9%) обнаруживалась активация строгих анаэробов. В целом отмечен значительный разброс всех показателей – от 10 до 2000% от нормы. Существенной особенностью у 79,5% пациентов была активация бактериальных протеолитических реакций (высокие значения ИИ). Прежде всего это касалось активации продуцентов изомасляной кислоты с высокими значениями отношения iC4/С4 (максимум – 1000% от нормы). Основными продуцентами изомасляной кислоты являются бактерии родов Bacteroides, Рrevotella, ферментирующие муцин из тонкой кишки [14, 15]. Относительное или абсолютное увеличение количества iС4 в фекалиях может быть признаком нарушения переваривания и всасывания белков, подтверждающим глубину расстройств обменных процессов у ЧБД.
Особенностью детей, недавно болевших ОРИ, явилась наибольшая дисперсия ОУ КЖК, причем как дефицит (ниже 70,0% от нормы), так и гиперпродукция (130,0% и более от нормы) КЖК встречались часто (в 33,4 и 58,3% случаев соответственно), то есть, как правило, обнаруживались те или иные нарушения при отсутствии однонаправленных сдвигов. Снижение ОУ КЖК было обусловлено преимущественно дефицитом образования уксусной и пропионовой кислот с преобладанием функциональной активности строгих анаэробов в половине случаев (АИ > 130,0% от нормы регистрировался у 58,0% пациентов). В этих случаях преобладали продуценты масляной кислоты (50,0%). ЧБД с ХГЭП характеризовалась стабильными и менее разнонаправленными нарушениями, причем в 52% случаев концентрации уксусной, пропионовой и масляной кислот находились в пределах нормы, а высокий АИ отмечен в 36% случаев. Вместе с тем у большинства пациентов этой группы обнаружена активация протеолитических анаэробов – продуцентов изокислот, о чем свидетельствовал высокий (выше 130,0% от нормы) ИИ в 69,0% наблюдений. У детей с аллергической патологией в подавляющем большинстве выявлены угнетение метаболической активности (81,3%) и структурные изменения микрофлоры кишечника (93,8%).
В процессе лечения отмечено снижение концентраций метаболитов кишечных бактерий в обеих группах, что свидетельствовало о подавлении численности и функциональной активности микрофлоры. Причина таких изменений в данном исследовании не установлена.
Вместе с тем у детей основной группы угнетение продукции масляной кислоты было выражено меньше, что способствовало более гармоничному балансу микрофлоры, хотя и на уровне ее угнетения (суждение на основании показателей, характеризующих структуру микрофлоры: АИ, относительного содержания масляной и уксусной кислот).
Результаты трехмесячного катамнестического наблюдения показали, что у детей основной группы достоверно реже регистрировались ОРИ (42% против 62,7% в группе сравнения; р = 0,05) и наблюдалось развитие осложнений (14,3 и 29,7% соответственно). Не менее важно, что повторяемость ОРИ достоверно чаще возникала в группе сравнения (44,5% против 14,4% в основной группе; р = 0,01). Кроме того, в основной группе продолжительность основных проявлений ОРИ была достоверно короче: лихорадка – 2,05 ± 0,15 дня против 2,95 ± 0,17 дня (р = 0,05), катаральные симптомы – 5,3 ± 0,2 дня против 5,91 ± 0,22 дня (р = 0,03), продуктивный кашель – 6,15 ± 0,3 дня против 8,0 ± 0,2 дня (р = 0,05). Вследствие более легкого течения ОРИ пациенты основной группы реже нуждались в антибактериальной терапии (35,7% против 48,1%).
Таким образом, результаты проспективного клинико-микробиологического исследования свидетельствовали о значительных сдвигах в состоянии здоровья ЧБД даже в межморбидный период и подтвердили необходимость проведения санаторного оздоровления, особенно с использованием средств, содержащих пробиотики и витаминно-минеральные комплексы.
Выводы
- ЧБД в возрасте 7–10 лет, помимо рекуррентных респираторных инфекций, одновременно имеют гастроэнтерологические заболевания (42,8%), ЛОР-патологию (20%), много реже – сопутствующие поражения других систем.
- В межморбидный период у ЧБД выявлены отклонения в состоянии здоровья: активные жалобы на периодические головные боли, боли в животе, нарушения характера стула, слабость (68%); различные клинические проявления с преимущественным поражением пищеварительного тракта и ЛОР-органов, сопровождавшиеся дисбиозом ротоглотки (89,7%) и кишечника (94,9%). Нарушенная микробиота характеризовалась снижением облигатных и ростом несвойственных биотопам микроорганизмов с расстройством метаболической активности (100%), обусловленной дефицитом сахаролитической и относительным преобладанием протеолитической микрофлоры.
- На характер нарушений микрофлоры ротоглотки и кишечника, а также метаболической активности у ЧБД оказывали влияние такие сопутствующие факторы, как перенесенные накануне ОРИ и наличие хронической гастроэнтерологической патологии.
- Проведение комплекса оздоровительных санаторных мероприятий у ЧБД способствовало сокращению числа детей, имевших жалобы и различные клинические проявления, сопровождавшиеся приростом уровня облигатных и снижением уровня несвойственных микроорганизмов. Однако эти позитивные эффекты были отмечены преимущественно в группе детей, получавших одновременно Бион®3 Кид.
- Включение в систему оздоровительных мероприятий Бион®3 Кид, содержащего пробиотические штаммы и витаминно-минеральный комплекс, обусловливает достоверное снижение частоты возникновения ОРИ, сокращает их повторность и продолжительность, облегчает течение болези.


