Пневмококковые заболевания (инфекционные заболевания, вызываемые S. pneumoniae, или пневмококком) являются одной из самых распространенных причин смертности от инфекционных болезней, которые могут быть предотвращены с помощью вакцинопрофилактики [1]. Пневмококковые инфекции вызывают как инвазивные (менингит, сепсис, бактериемическая пневмония), так и неинвазивные (пневмония, отит, синусит) заболевания.
Иммунизация против пневмококковой инфекции 7-валенной конъюгированной вакциной (ПКВ7) началась в США 12 лет назад. Вакцина прошла успешную проверку в ряде развивающихся стран, существенно снизив заболеваемость и смертность детей. Это позволило ВОЗ рекомендовать повсеместное включение в национальные календари профилактических прививок конъюгированных пневмококковых вакцин [2].
В Российской Федерации с 2009 г. для вакцинации детей успешно применялась ПКВ7. С момента введения в национальные календари профилактических прививок вакцинации ПКВ7 структура патогенных серотипов претерпела значительные изменения: на первый план вышли серотип 19А, который вызывает до 40% всех инвазивных пневмококковых инфекций (ИПИ) и составляет до 60% всех пневмококков, устойчивых к антибактериальным препаратам [3], серотипы 1, 5, 3. Согласно российским эпидемиологическим исследованиям [3–7], серотипы 3, 19А, 6А Streptococcus pneumoniae вызывают до 24,1–29,2% острых средних (гнойных) отитов и до 16,6% рентген-подтвержденных пневмоний у детей первых 5 лет жизни.
В 2011 г. в России на смену ПКВ7 пришла пневмококковая полисахаридная конъюгированная 13-валентная вакцина (ПКВ13). Тем самым открылась перспектива защитить детей и взрослых от новой, очень опасной группы пневмококков, играющих существенную роль в развитии патологии. В 2012 г. в РФ также была зарегистрирована 10-валентная пневмококковая конъюгированная вакцина (ПКВ10).
При появлении новых вакцин, особенно поливалентных, всегда встает вопрос об их эффективности, а также реактогенности и безопасности. Несмотря на положительный опыт применения вакцины в других странах, важно убедиться в этом на собственном опыте, тем более что реакция на совместное введение ПКВ с отечественными вакцинами (прежде всего, с цельноклеточной АКДС) может быть оценена только в нашей стране.
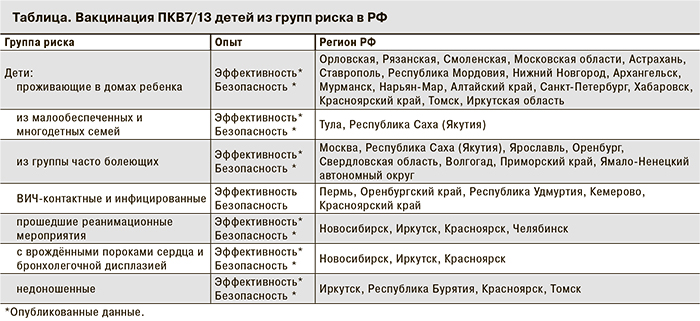
Нами проведён анализ публикаций, посвященных вакцинации детей младшего возраста против пневмококковой инфекции в Российской Федерации (см. таблицу).
За 3 года применения ПКВ7/13 в РФ подтверждена безопасность и эффективность вакцины. К настоящему времени в нашей стране ПКВ7/13 привито около 50 000 детей, введено более 90 000 доз в 49 регионах РФ.
С середины 2013 г. в ряде регионов началась иммунизация детей ПКВ10. К сожалению, пока нет доступных данных о результатах вакцинации ПКВ10 в России.
Вакцинацию ПКВ7/13 проводили в 49 регионах за счёт региональных программ вакцинопрофилактики. Местные органы власти принимали решение в пользу вакцинации в первую очередь детей из групп риска (см. таблицу).
Одно из первых российских исследований было проведено в Москве на базе отделения иммунопатологии детей ГНЦ «Институт иммунологии» ФМБА и Городского консультативно-диагностического центра по специфической иммунопрофилактике [8]. Исследование являлось проспективным, рандомизированным, открытым, сравнительным на параллельных группах детей, привитых ПКВ7 и обычной полисахаридной 23-валентной вакциной (ППВ23).
В течение 2009–2011 гг. в исследование были включены 285 детей в возрасте от 6 мес. до 5 лет (средний возраст 1,7 года) с различными отклонениями в состоянии здоровья и факторами риска, предрасполагающими к развитию инвазивных пневмококковых заболеваний.
Через 6 мес. после завершения вакцинального курса в группе привитых ПКВ7 установлена достоверно более высокая иммуногенность: нарастание титра антител в 3 раза в группе вакцинированных ПКВ7 и в 1,6 раз – в группе вакцинированных ППВ23.
У 85,3% детей, привитых ПКВ7, и у 90,3% детей, привитых ППВ23, поствакцинальный период протекал бессимптомно. Среди детей, привитых ПКВ 7, нежелательные явления регистрировались достоверно чаще (14,6%) по сравнению с группой привитых ППВ23 (5,6%; р < 0,05) [8].
В свою очередь данные по эффективности ПКВ7 превзошли ожидания исследователей. В группе пациентов, вакцинированных ПКВ7, в первый год мониторинга количество внебольничных пневмоний снизилось в 6,8 раз, острых средних отитов – в 3,6 раза, ОРЗ – в 1,3 раза [9].
Носительство S. pneumoniae наиболее распространено в закрытых детских коллективах (дома ребенка, детские сады, стационары длительного пребывания, интернаты) [9, 10]. Важно отметить, что именно носительство пневмококков является предрасполагающим фактором для развития тяжелых форм пневмококковой инфекции и антибиотикорезистентных форм [1].
Учитывая высокую заболеваемость и тяжёлое течение пневмококковой инфекции в детских закрытых коллективах, в большинстве регионов России проводили вакцинацию детей, находящихся в домах ребёнка и интернатах (см. таблицу).
Так, в 2012 г. был представлен опыт использования ПКВ7 у воспитанников специализированного Дома ребенка для детей с органическим поражением центральной нервной системы в Республике Мордовия [11].
Было использовано 120 доз ПКВ7 и привито 48 детей. Местные и общие нетяжелые реакции зарегистрированы в 8,3% случаев. Болезни органов дыхания среди привитых детей встречались в 5,4 раза реже, чем среди непривитых. Было показано, что спустя 1 год после вакцинации инфекционная заболеваемость снизилась в 6 раз среди получивших вакцину и в 1,7 раза – среди непривитых [11].
В Астрахани выполнен сравнительный анализ помесячной инцидентности острых средних отитов у детей первых 4 лет жизни за 18 мес. у ранее не привитых детей и за первое полугодие после туровой иммунизации ПКВ7 или ППВ23 (n = 114) [12].
Наблюдения за детьми первых двух лет жизни, получившими ПКВ7, продемонстрировали низкую частоту общих и местных реакций на препарат. Общая реакция в форме повышения температуры тела до 38 °С в течение 24 ч после второго или третьего введения ПКВ7 отмечена менее чем у 3% детей, купировалась самостоятельно и не требовала дальнейших лечебных мероприятий [12].
Иммунизации пневмококковой вакциной детей из домов ребенка в Астрахани способствовала сокращению затрат на оказание госпитальной помощи по поводу острых отитов более чем на 20% [12].
В Ярославле продемонстрировали собственный опыт применения ПКВ7 у 196 детей в возрасте от 1 года до 5 лет c различными отклонениями в состоянии здоровья [13].
18 детей (из 196) в возрасте от 1 до 2 лет получили сочетанную иммунизацию: ПКВ7 вводили одновременно с вакциной ОПВ 5 детям, с вакциной Хиберикс – 8, с вакциной Бубо-кокк – 2, с вакциной против гепатита В – 2, с коревой и паротитной вакциной – 1 ребенку.
У большинства (81%) привитых детей вакцинальный период протекал бессимптомно. Общие поствакцинальные реакции слабой и средней степени (повышение температуры тела до 37,5–38,5 °С у 10 детей, у 8 из них – только в 1-е сутки после вакцинации; легкая раздражительность, сонливость и небольшое снижение аппетита у 5 детей в течение первых двух суток после прививки) наблюдались только в группе детей с хроническими заболеваниями (III группа здоровья) и не требовали каких-либо терапевтических действий. Сильных вакцинальных реакций и поствакцинальных осложнений не зарегистрировано. Нормальные (допустимые) поствакцинальные местные реакции – покраснение в месте инъекции до 5 см (у 9,8%), припухлость (у 8%), легкая болезненность в месте инъекции (у 3,3%) – купировались у абсолютного большинства детей в течение 3 суток после вакцинации [13].
Вместе с тем, в Ярославле определена эффективность проводимой иммунизации детей против пневмококковой инфекции. Авторы исследования отмечают, что среди детей, вакцинированных ПКВ7, средняя длительность заболевания снизилась с 8,09 до 7,05 дня, а в группе невакцинированных детей (контрольная группа) этот показатель вырос с 5,8 до 10 дней. В группе вакцинированных детей наблюдалось снижение коэффициента бактериальной нагрузки в 1,7 раз, в то время как в контрольной группе этот показатель вырос в 2,7 раз. Среди вакцинированных детей число заболеваний пневмоний сократилось в 9 раз, острыми средними отитами – в 2,7 раза, аналогичные показатели в контрольной группе выросли в 2,5 раз.
В 2009 г. одними из первых регионов в РФ, где было принято решение о вакцинации детей младшего возраста ПКВ7, стали Красноярский край и Республика Саха (Якутия).
Для оценки эффективности и безопасности этой вакцины в Республике Саха (Якутия) было проведено исследование, в которое включили 596 часто и длительно болеющих детей в возрасте от 2 мес. до 5 лет. Выявлена низкая реактогенность вакцины ПКВ7. Местные реакции на ее введение отмечены в 9,8% случаев и в основном были слабо выражены. Наиболее частыми проявлениями были: уплотнение в месте инъекции (16,9%), гиперемия (14,3%), отек (7,2%). Общие реакции в виде повышения температуры до 38 оС, недомогание отмечались лишь в 1,8% случая. Через 6 мес. после вакцинации у детей отмечено снижение частоты ОРИ в 3 раза, снизилась также заболеваемость пневмониями, синуситами, отитами и бронхитами, что привело к сокращению антибактериальной терапии [14].
За счёт средств бюджета Красноярска ежегодно для детей из групп риска закупалась вакцина ПКВ7/13. Администрация города поставила задачу снизить уровень заболеваний органов дыхания, пневмоний, отитов за счёт увеличения охвата детей вакцинацией против пневмококковой инфекции. Так, к середине 2012 г. среди детей в возрасте до 5 лет он составил 9,6%. Это дало свои результаты: согласно данным статистической формы № 12 по Красноярску, среди детского населения города количество острых средних отитов сократилось на 5%, хронических отитов – на 25%. С начала 2012 г. Россия перешла на новые критерии регистрации новорожденных, рекомендованные ВОЗ, которые предполагают регистрацию детей весом более 500 г. Это привело к увеличению числа глубоко недоношенных детей. У детей, рожденных на сроках беременности менее 32 нед., в 25% случаев отмечается бронхолегочная дисплазия (БЛД), которая является одним из факторов риска тяжелого течения пневмонии [15].
Выхаживание и лечение недоношенных детей крайне затратно. К примеру, средняя стоимость выхаживания одного такого ребенка составляет не менее 300 тыс. руб. и может доходить до 1 млн руб. Именно поэтому чрезвычайно важно сохранение здоровья каждого ребенка, чтобы усилия педиатров, неонатологов и большие материальные вложения не были растрачены впустую. В связи с этим ряд территорий перешел на вакцинацию недоношенных детей, детей с БЛД, врожденными пороками сердца (ВПС) и детей, прошедших реанимационные мероприятия.
Безопасность и эффективность вакцинации ПКВ7 детей с БЛД и ВПС доказали результаты исследования, проведенного в Новосибирске [16].
По данным авторов, вакцинация 116 детей в возрасте от 6 мес. до 5 лет с ВПС и БЛД подтвердила высокий профиль безопасности ПКВ7: у 1,8% привитых наблюдались общие реакции средней степени тяжести, у 0,9% – местные реакции. Также продемонстрирована хорошая совместимость ПКВ7 с другими вакцинами.
Через 6 мес. динамического наблюдения в группе привитых детей случаев заболевания ИПИ не отмечено. У 87,5% детей снизилась заболеваемость острыми респираторными инфекциями. Через 12 мес. наблюдения в группе вакцинированных детей зафиксирован 1 случай внебольничной пневмонии, которая характеризовалась на рентгенограмме наличием двусторонних негомогенных инфильтратов и протекала мягко. В клиническом анализе крови отсутствовал нейтрофильный лейкоцитоз, повышение СОЭ, что позволило трактовать этиологию данного процесса как вирусную. Годовое динамическое наблюдение дало возможность констатировать значимое снижение заболеваемости внебольничными инфекциями в группах риска с 14 до 1% (p = 0,006) [16].
Опубликованы данные проведенного в Иркутске исследования эффективности, безопасности и совместимости с другими вакцинами ПКВ7 и ПКВ13 у недоношенных, детей с ВПС, БЛД, а также детей, которые после рождения нуждались в реанимационных мероприятиях [17].
Наблюдение проводили за 193 привитыми детьми в течение 1,5 лет. В возрасте 2–6 мес. были привиты ПКВ7/ПКВ13 30% недоношенных и 46% детей с ВПС, в возрасте 7–11 мес. – 52 и 40% соответственно.
Среди педиатров в России бытует мнение о сложности совмещения вакцины Превенар с другими вакцинами у детей в возрасте до 6 мес. В Иркутске в 65% случаев вакцину ПКВ7/ПКВ13 вводили совместно с другими вакцинами национального календаря профилактических прививок: с вакциной Пентаксим, с вакциной против гепатита В, с полиомиелитными вакцинами (пероральной и инактивированной) и вакциной против гемофильной инфекции. При этом отсутствовали значительные различия по числу неблагоприятных явлений после вакцинации ПКВ7 и ПВК13 при введении ее изолированно или в комбинации с другими вакцинами детям группы риска. Частота общих поствакцинальных реакций (повышение температуры тела от 37,6 до 38,0 °С) составила 4%, местных реакций зарегистрировано не было. Также не выявлено статистически значимых различий по числу нежелательных реакций между недоношенными детьми, привитыми в возрасте до 6 мес. и от 6 мес. до 1 года [17].
За период наблюдения у вакцинированных недоношенных детей в Иркутске не было зарегистрировано ни одного случая пневмонии, менингита, острого среднего отита или бронхообструктивного синдрома [17].
Не менее интересные данные о безопасности и эффективности вакцинации против пневмококковой инфекции получены в Екатеринбурге. Там провели динамическое наблюдение за 230 детьми, вакцинированными ПКВ7. В группу наблюдения вошли дети недоношенные – 48(21%), перенесшие критические состояния в периоде новорожденности – 65(28%), ВИЧ-инфицированные – 25(11%) и дети с хроническими болезнями органов дыхания – 92(40%) [18].
В исследовании показано, что сочетанная вакцинация ПКВ7 с другими календарными прививками (против гемофильной инфекции, ветряной оспы, клещевого энцефалита, кори, паротита, краснухи, коклюша, дифтерии, столбняка, полиомиелита, гриппа) допустима и не увеличивает частоты нежелательных реакций.
Поствакцинальный период у 191 (83%) ребенка протекал бессимптомно; у 23 (10%) детей наблюдались слабо выраженные общие реакции в виде транзиторного повышения температуры тела, не превышающего 38 °С; у 9 (4%) – реакции средней степени тяжести (повышение температуры тела до 38,5 °С); у 7 (3%) – местная реакция в виде небольшого инфильтрата [18].
За год наблюдения среди детей, привитых ПКВ7, не зарегистрировано случаев пневмонии, по сравнению с аналогичным периодом предыдущего года в 2 раза реже регистрировались случаи ОРЗ и острые средние отиты.
Безусловно, подобная точечная вакцинация групп риска не может повлиять на популяционные показатели заболеваемости пневмониями на территории Российской Федерации. Между тем, опыт зарубежных стран свидетельствует об эффективности плановой универсальной вакцинации детей, в результате которой существенно снижается заболеваемость ИПИ и пневмониями не только у детей, но и у взрослых и лиц пожилого возраста.
Исходя из опыта вакцинации в России детей из групп риска против пневмококковой инфекции, полученных данных об эффективности, реактогенности и безопасности ПКВ7 и ПКВ13, можно рекомендовать проведение вакцинации ПКВ детям (в том числе недоношенным) с 2-месячного возраста, используя при необходимости одновременное введение с другими вакцинами по календарю прививок.


