Стрептококки серогруппы В (СГВ), известные как возбудители зоонозных инфекций, впервые были выделены при хронических маститах у коров более 100 лет назад и получили название Streptococcus agalactiae. Важное значение стрептококки этой группы имеют в ветеринарии, поскольку вызывают хронические маститы у крупного и мелкого рогатого скота, нанося тем самым большой экономический ущерб. При этом многие домашние животные, не только коровы, но и кошки, собаки, лошади, свиньи могут быть бессимптомными носителями СГВ, что обуславливает наличие обширных источников инфекции [1].
До 60-х годов этот вид как патоген человека выделялся изредка при самых разных нозологических формах: эндокардите, пиелонефрите, менингите, пневмонии, абсцессе, перитоните, родовом сепсисе, сепсисе новорожденных, фарингите и др. СГВ способны поражать кожу, центральную нервную систему, сердце, легкие, реже – другие органы и ткани [2]. К началу 60-х годов в зарубежной литературе все чаще стали описывать случаи септических инфекций, вызываемых этими микроорганизмами, у людей [3, 4]. В 1970–1980-е годы СГВ становится одним из частых возбудителей гнойно-септических инфекций у новорожденных и их матерей в США и Западной Европе. Публикации в нашей стране также подтверждают роль СГВ в патологии беременности и при гнойно-воспалительных заболеваниях новорожденных [5–7], описана частота носительства штаммов СГВ в родильных домах различного типа среди рожениц и новорожденных [8]. По данным зарубежных исследователей, этот микроб является одним из ведущих патогенов человека у беременных женщин и новорожденных [9–13]. На долю СГВ приходится половина всех возбудителей, выделяемых из крови в течение первых дней жизни у новорожденных с сепсисом [14].
Таксономия
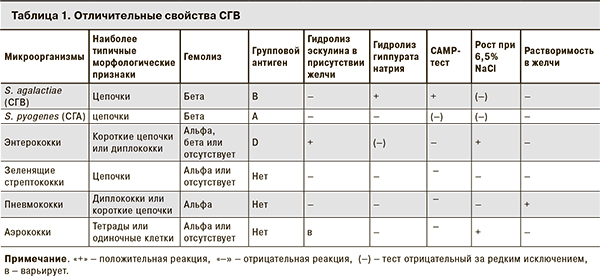
Стрептококки этого вида, согласно современной номенклатуре в «Определителе бактерий» Берджи, изданном в 1997 г., принадлежат к роду Streptococcus семейства Streptococcaeae, вид S. agalactiae. В основе их классификации лежит деление на серологические группы по классификации Р. Ленсфильд, в соответствии с наличием в глубоких слоях клеточной стенки группоспецифического антигена полисахаридной природы (С-субстанций). S. agalactiae отнесены к серогруппе В и являются единственными ее представителями. Различают 9 серотипов СГВ: Ia, Ib , II, III, IV, V, VI, VII, VIII. Также идентифицирован подтип Ic, родственный подтипам Ia и Ib по наличию полисахарида I и отличный по белку. Помимо полисахаридных антигенов в капсуле ряда штаммов присутствуют белки С, R, X. Эти белки встречаются в разных сочетаниях с серотиповыми полисахаридами, а иногда присутствуют в штаммах, утративших типоспецифический полисахарид, что позволяет идентифицировать их по белковому антигену. В природе очень часто встречаются штаммы СГВ с сочетанием различных серотипов – серологические комбинации. Так, например, исследования, проведенные в двух московских родильных домах, позволили выявить 17 серотипов и их комбинаций, среди которых преобладали Ia/c, Ib/c, IIc. Вместе с тем, выявлен целый ряд не типируемых штаммов [8].
Морфологические и физиологические свойства
 СГВ обладают многими особенностями, присущими всему роду Streptococcus. Они факультативные анаэробы. В аэробных условиях лучше растут при повышенной концентрации СО2 в атмосфере. Температурный оптимум 37 °С, рН 7,2–7,8. Клетки сферической формы 0,6–1,2 мкм в диаметре, при окраске по Граму – грамположительные. В мазках, приготовленных из бульонных культур, располагаются в виде цепочек, при росте на плотной среде, наряду с цепочками, могут выявляться диплококки и небольшие скопления кокков. При выращивании в бульоне пленку на поверхности не образуют, рост может быть придонным, пристеночным крупинчатым или в виде рыхлого осадка с сохранением полной прозрачности или помутнением бульона. Бензидиновый и каталазный тесты отрицательные.
СГВ обладают многими особенностями, присущими всему роду Streptococcus. Они факультативные анаэробы. В аэробных условиях лучше растут при повышенной концентрации СО2 в атмосфере. Температурный оптимум 37 °С, рН 7,2–7,8. Клетки сферической формы 0,6–1,2 мкм в диаметре, при окраске по Граму – грамположительные. В мазках, приготовленных из бульонных культур, располагаются в виде цепочек, при росте на плотной среде, наряду с цепочками, могут выявляться диплококки и небольшие скопления кокков. При выращивании в бульоне пленку на поверхности не образуют, рост может быть придонным, пристеночным крупинчатым или в виде рыхлого осадка с сохранением полной прозрачности или помутнением бульона. Бензидиновый и каталазный тесты отрицательные.
Как и большинство представителей своего рода, СГВ плохо растут на обычных питательных средах, не обогащенных нативной кровью, сывороткой или глюкозой. Стрептококки этой группы на плотных средах, содержащих 5% бараньей крови, растут в виде сероватых мукоидных колоний 0,5–1,0 мм в диаметре и в большинстве случаев вызывают просветление среды – бета-гемолиз вследствие лизиса эритроцитов. Зона гемолиза у СГВ значительно уже и менее прозрачная, чем у стрептококков группы А. Некоторые штаммы СГВ не гемолизируют эритроциты барана, другие образуют зону позеленения (Р. Ленсфильд) вокруг колонии при росте на кровяном агаре. По целому ряду свойств СГВ аналогичны стрептококкам других видов. Они не растут при температуре 10 и 45 С, при рН 9,6, погибают при 60 °С с экспозицией в течение 30 мин, не редуцируют молоко с метиленовым синим, не расщепляют желатин, не ферментируют аргинин и некоторые углеводы. Для СГВ характерен ряд и других специфических свойств: пигментообразование, способность гидролизовать гиппурат натрия, гемолиз в форме дуги при выращивании на кровяном агаре совместно со стафилококком, образующим бета-токсин – так называемая CAMP-реакция (табл. 1).
Основными факторами патогенности СГВ являются поверхностные клеточные белки и, в меньшей степени, типоспецифические полисахариды, ответственные за устойчивость к фагоцитозу и действию комплемента. Начальный этап инфекции – колонизацию – обеспечивают поверхностные адгезины и пили – тонкие волоски с липкими концами, отходящие от клеточной оболочки [15].
При длительном культивировании бактерия формирует биопленку. Биопленки образуются и на поверхности колонизированных слизистых оболочек. Они защищают стрептококков от действия неблагоприятных факторов, в том числе антибиотиков и антител. В этом процессе ключевую роль играют пили. При исследовании 289 клинических изолятов возбудителя идентифицировали 3 типа пилей: 1, 2a и 2b, кодируемые тремя участками генома – пилюсными островками. Число пилюсных островков в геноме исследованных штаммов варьировало от 1 до 2. Большая часть штаммов, образующих биопленку, имели пили типа 2a. Обработка изолятов антисыворотками к компонентам пилей ингибировала свойство бактерий прикрепляться к твердым поверхностям. Данный феномен теоретически можно использовать для предотвращения колонизации S. agalactiae эпителиальных клеток человека [16].
Чувствительность к антибиотикам и фагам
СГВ по устойчивости к факторам внешней среды близки к стрептококкам прочих серогрупп. Наряду со стрептококками серогруппы А (СГА) СГВ сохраняют свою чувствительность к пенициллину, хотя изредка выделяются штаммы с повышенной устойчивостъю к этому препарату. Так, группой японских исследователей [17] были выделены из клинического материала 14 штаммов этого вида стрептококков, устойчивых к пенициллину, оксациллину, ампициллину, цефазолину, цефепиму и цефотаксиму. Помимо пенициллина, у стрептококков выявлена высокая чувствительность к ампициллину, оксациллину, эритромицину, клиндамицину, линкомицину, меропенему. Первые 3 поколения цефалоспоринов, за исключением цефокситина и моксалактама, обладают более широким спектром активности по сравнению с пенициллином в отношении СГВ. Отмечена также высокая чувствительность СГВ к ряду сравнительно новых препаратов с широким спектром активности: тиенамицину, мезлоциллину, азлоциллину и пиперациллину. У штаммов СГВ часто выявляется устойчивость к аминогликозидам, налидиксовой кислоте, тетрациклину, хлорамфениколу, бацитрацину, триметоприму и метронидазолу. Тем не менее, при сочетанном применении аминогликозидов с пенициллином или ампициллином в экспериментальных исследованиях на лабораторных животных выявлен синергетический эффект таких комбинаций. При изучении небольшого числа штаммов СГВ, выделенных в родильных домах Москвы, установлена высокая чувствительность к бета-лактамным антибиотикам, эритромицину, хлорамфениколу и линкомицину и низкая чувствительность к тетрациклину, стрептомицину и гентамицину [8].
Фаги, активные против СГВ, впервые были изолированы F.F. Russell и соавт. в 1969 г. из штаммов, выделенных от коров. Позже их начали выделять из культур человеческого происхождения. Были проведены работы по разработке систем для фаготипирования СГВ [18]. Однако пока применение фагов не получило широкого распространения. Фаговых препаратов для лечения СГВ-инфекций на данный момент не существует.
Экология СГВ и эпидемиологические особенности инфекций, вызываемых этим микроорганизмом
СГВ могут вызывать у людей тяжелые заболевания. Наиболее чувствительны к ним новорожденные дети, беременные женщины, больные диабетом, лица, страдающие хроническими заболеваниями, дети с дистрофией, пожилые люди, лица с пониженным иммунитетом. У беременных женщин S. agalactiae вызывает выкидыши на поздних сроках беременности, хориоамниотиты, пиелонефриты, инфекции мочеполовых путей, эндокардит, сепсис, а также осложнения после кесарева сечения, менингиты, маститы и эндометриты у родильниц [19–26]. СГВ могут инфицировать матку до и после родов. Инфекция, вызванная СГВ, может увеличивать риск разрыва околоплодных оболочек (до 37 нед. беременности) и быть причиной преждевременных родов.
СГВ – микроорганизмы-комменсалы. Установлено, что основными биотопами СГВ в человеческом организме являются кишечник и слизистая оболочка влагалища. Колонизация этих органов происходит безсимптомно. Она сопровождается развитием типоспецифического иммунитета с нарастанием его активности по мере увеличения возраста женщины. Это отчасти объясняет более частое выделение стрептококков у женщин молодого возраста по сравнению с лицами старшего возраста. Наиболее высок уровень колонизации у женщин моложе 20 лет, ведущих активную половую жизнь и использующих в качестве средства контрацепции внутриматочную спираль [27]. На частоту носительства также оказывают влияние расовые особенности (у темнокожих женщин СГВ обнаруживается чаще, чем у белых [28]), а также число беременностей и фаза менструального цикла [29, 30]. Колонизация влагалища во время беременности возрастает с 10–15 до 25% [31], что повышает риск возникновения СГВ-инфекциии у новорожденных детей [14]. Носительство S. agalactiae может быть хроническим, транзиторным и перемежающимся.
Установлено, что СГВ присутствуют во влагалищной флоре у 1/3 здоровых женщин. В разных возрастных группах населения СГВ обнаруживают в половом и желудочно-кишечном тракте. Носительство у здоровых женщин составляет 15–45% [32], носительство у мужчин – партнеров женщин-носительниц – в уретре составляет 45–63% [33]. Показатели носительства у беременных женщин в разных странах мира имеют некоторые различия. В США носительство СГВ у них составляет 10–30% [32], в Южной Америке – 14,6% [34] , в Западной Европе – 11–25,6% [35, 36], в Восточной Европе – 19,7—29,3% [35], в Корее – 8,0% [37], в Китае – 6,2% [38], в скандинавских странах – 24,3–36,0% [35]. Примерно у 10–36% беременных женщин выделяются СГВ, что приводит к постоянному заражению детей, которое происходит в основном при рождении [18]. В результате носительства СГВ у женщин появляется ряд клинических симптомов: покраснение наружных половых органов, ороговение эпителия слизистой оболочки влагалища, гнойное влагалищное отделяемое и повышение рН влагалища выше 5,0.
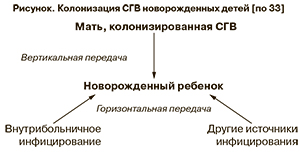
Заражение ребенка от матери в 60–70% случаев происходит либо внутриутробно, либо при прохождении через родовые пути, а также после родов (см. рисунок). Риск инфицирования новорожденных при колонизации СГВ матери составляет 50%, при отсутствии стрептококка у матери – 8% [39]. Считается, что у детей, инфицированных СГВ, бактерия попадает внутрь организма при заглатывании вагинальной жидкости во время родов, либо если была повреждена целостность околоплодной оболочки. Также установлено, что у 30–70% здоровых детей, рожденных матерями-носительницами стрептококков, СГВ обнаруживают на коже [11, 13].
По данным зарубежных исследователей [18, 40], у лиц обоего пола старшей возрастной группы, страдающих сахарным диабетом и заболеваниями периферических кровеносных сосудов, печени и злокачественными новообразованиями, нередко выделяют СГВ из разных органов. Среди этих пациентов заболеваемость у лиц в возрасте от 15 до 64 лет в 1999 г. в США составляла 3,4 на 100 тыс. и увеличилась до 5,0 к 2005 г., а заболеваемость в возрастной группе от 65 лет и старше возросла с 21,5 до 26,0%, летальность в этой группе составляла 20%.
Определенный интерес представляет также информация о возможности выделения СГВ из грудного молока. Так, V. Kubin и соавт. [39] при исследовании 1132 проб грудного молока в 3,35% случаев выделили культуры СГВ, исключив при этом вероятность внутрибольничного заражения.
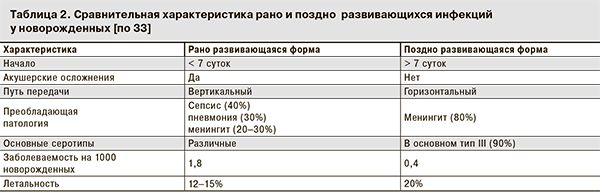
Установлено, что колонизация новорожденных происходит до, во время и после родов. Различают 2 формы заболеваний – рано и поздно развивающиеся. По определению зарубежных авторов, это «горизонтальные» и «вертикальные» пути передачи (см. рисунок).
При первой форме (табл. 2), на которую приходится 80% СГВ-инфекций, дети чаще всего заболевают сепсисом и пневмонией. Начальные симптомы обычно проявляются в первые 12 ч после рождения и включают нарушение дыхания, апноэ, понижение артериального давления и диссеминированное внутрисосудистое свертывание крови. В отдельных случаях заболевание может развиваться к концу 1-й недели жизни. СГВ-менингит у новорожденных и детей первых месяцев жизни начинается с выраженного беспокойства, обычно с резким подъемом температуры и нарастающей вялостью ребенка. Нередко это сопровождается нарушением микроциркуляции, проявляющимся мраморностью кожи и цианозом носогубного треугольника с акроцианозом. Геморрагическая сыпь встречается редко и обычно не превышает 11,8% случаев. Менингеальные симптомы в начале заболевания могут отсутствовать почти у половины пациентов, что затрудняет диагностику менингита и расширяет показания для диагностической люмбальной пункции [41]. Летальные исходы обычно наблюдаются в первые 12–24 ч после рождения. Их частота может достигать 50–60%. Заражение при этой форме инфекции происходит во время родов или внутриутробно [42]. Также есть сообщения о рано развивающихся заболеваниях при кесаревом сечении, что подтверждает возможность внутриутробного заражения [43].
Поздно развивающаяся форма заболевания (чаще всего менингит), на долю которой приходится до 20% случаев, проявляется через неделю, иногда в течение 3 мес. после рождения ребенка, в отдельных случаях – до 8 мес. Хотя инфекция протекает не так тяжело, как при первой форме, летальность еще высока и колеблется от 5 до 20 % [32, 42]. Среди основных симптомов – повышение температуры, летаргия, рвота, выбухание родничков. У 50% детей, перенесших эту форму, в дальнейшем наблюдаются неврологические осложнения. Выявлены факты, подтверждающие вероятность внутрибольничного заражения СГВ новорожденных от медицинского персонала. По данным отдельных авторов, стрептококки могут циркулировать в акушерских стационарах от 2–6 нед. до 15–18 мес. [18].
Следует отметить, что из числа инфицированных детей заболевают от 1 до 20%. Здесь играют роль факторы, связанные с особенностями организма новорожденного и возбудителя. Отсутствие транспланцентарной передачи серотип-специфических антител матери является решающим предусловием возникновения манифестной инфекции у новорожденного. Значительный перенос иммуноглобулинов через плаценту отмечается только в III триместре беременности, так что недоношенные дети транспланцентарно получают весьма незначительное количество специфических антител. Кроме того, определено, что не у всех беременных вырабатывается достаточное количество специфических антител против капсульных антигенов возбудителя, несмотря на имеющееся массивное ректально-вагинальное заселение [23].
S. agalactiae наиболее часто вызывает заболевание и смерть новорожденных от менингита, сепсиса и пневмонии в развитых странах. В США ежегодно заболевают тяжелой стрептококковой инфекцией группы В 8000 новорожденных. Летальность составляет 9–47% [32]. В Великобритании частота ранних неонатальных инфекций, вызванных СГВ, составляет 3,6 случая на 1000 новорожденных [10]. В Южной и Восточной Европе, а также в скандинавских странах заболеваемость колеблется от 0,5 до 2,0 на 1000 новорожденных [44]. Регистрация и профилактика СГВ-инфекции у беременных и новорожденных проводится во многих странах: США, Канаде, Австралии, Бельгии, Франции и др., что позволило радикально снизить частоту заболеваемости и летальность от данной инфекции у новорожденных. С введением в развитых странах антибиотикопрофилактики СГВ-инфекции в родах частота развития менингита у детей в период с 1993 по 2008 г. сократилась на 80% [45]. В России мероприятия по регистрации и профилактике инфекций, вызванных СГВ, не проводятся.
Профилактика заболеваемости новорожденных
Важную роль в предупреждении инфекций у новорожденных играют своевременные профилактические мероприятия. До настоящего времени в России отсутствует централизованная система скрининга беременных на носительство СГВ. Соответственно отсутствует и адекватная антибиотикопрофилактика.
Американской коллегией акушеров и гинекологов и Американской коллегией педиатров в 1992 г. были разработаны рекомендации по профилактике СГВ-инфекций у новорожденных с помощью антибиотиков. В 1996 г. Центром по борьбе и профилактике инфекционных заболеваний (CDC, США) был обобщен опыт названных ассоциаций и разработаны указания по предотвращению развития ранних форм СГВ-инфекций у новорожденных детей [46]. Указания представляли 2 альтернативные схемы. Согласно 1-й схеме, роженицы в родах получают антибиотики, когда имеют место один или несколько из нижеперечисленных признаков:
- рождение предыдущего ребенка с СГВ-инфекцией;
- стрептококковая бактериурия при беременности;
- угроза преждевременных родов на сроках до 35–37 нед.;
- массивный рост СГВ в урогенитальном тракте;
- длительный (> 18 ч) безводный период;
- повышение температуры тела после родов выше 38 °С.
Во 2-й схеме тактика основана на результатах микробиологического анализа – выделения бактериальной культуры из ректально-вагинального посева, взятого в промежутке между 35-й и 37-й неделей беременности. При положительном результате проводится антибиотикопрофилактика.
В результате внедрения разработанных схем профилактики заболеваемость СГВ-инфекцией снизилась с 1,7 на 1000 живых новорожденных в 1993 г. до 0,4 – в 1999 г., а среди беременных женщин – на 21% [12]. Летальность у детей составляла около 5%, у взрослых – 16% [18]. В 2002 г. Американской коллегией акушеров и гинекологов совместно с Американской коллегией педиатров была продолжена разработка новых рекомендаций по антибтотикопрофилактике. Многие рекомендации совпадали с уже существующими, которые были даны в 1996 г., но включали некоторые ключевые изменения:
- обследование всех женщин на 35–37-й неделе беременности на ректально-вагинальное носительство СГВ;
- индивидуальные режимы профилактики для женщин с аллергией на пенициллин;
- неукоснительное следование в лабораторной практике специально разработанным инструкциям, касающимся способов взятия и исследования клинического материала на СГВ, включая определение антибиотикочувствительности;
- женщинам, у которых проводилось кесарево сечение с целой околоплодной оболочкой, атибиотикопрофилактику проводить не рекомендуется;
- рекомендован специальный алгоритм профилактики СГВ-инфекций для новорожденных при угрозе преждевременных родов;
- предложен способ антибиотикопрофилактики СГВ-инфекций для новорожденных в интранатальный период [47].
Переход в США на такую схему позволил снизить частоту перинатального заражения в период с 2002 по 2006 г. по сравнению с 2000–2001 гг. на 33% [48]. Профилактика СГВ-инфекции, основанная на положительных результатах бактериологического обследования беременных женщин, оказалась более эффективной, чем профилактика, базирующаяся на факторах риска.
Однако несмотря на хорошую систему профилактики, в США данная инфекция остается основной причиной сепсиса новорожденных. Алгоритмы ее профилактики регулярно корректируются и обобщаются в специальных руководствах Центра контроля и профилактики болезней (CDC). В 2010 г. было разработано новое руководство. В него были внесены следующие изменения:
- лабораторные методы диагностики инфекции рекомендованы как основа для принятия решения о проведении профилактических мероприятий (ранее ориентировались преимущественно на оценку принадлежности пациента к определенной группе риска);
- необходимость оценки титра возбудителя в моче беременных женщин как маркера интенсивности колонизации бактерией половых органов;
- усовершенствованы алгоритмы скрининга инфекций и ее химиопрофилактики у женщин с разрывом плаценты и при преждевременных родах;
- изменена дозировка пенициллина в связи с распространением штаммов возбудителя, проявляющих пониженную чувствительность к этому антибиотику;
- скорректирована система профилактики инфекции у женщин с аллергией к пенициллину;
- введен новый алгоритм мониторинга новорожденных детей, относящихся к группе повышенного риска заражения СГВ;
- намечены перспективы дальнейшей борьбы с инфекцией, в том числе разработка вакцин, применение экспресс-методов диагностики и т. д. [45].
Указания по проведению антибитикопрофилактики, разработанные СDC, представлены в табл. 3.
Антибиотикопрофилактику женщине во время родов проводят путем внутривенного введения пенициллина: первая доза 5 млн МЕ, затем по 2,5 млн МЕ каждые 4 ч до рождения ребенка. Можно применять ампициллин: стартовая доза 2 млн МЕ, затем по 1 млн МЕ каждые 4 ч до рождения ребенка. При аллергии на пенициллин применяют клиндамицин по 900 мг внутривенно каждые 8 ч до рождения или эритромицин 500 мг внутривенно каждые 6 ч до рождения [27].
Антибактериальная профилактика не влияет на частоту поздних форм заболевания, мертворожденности и преждевременных родов [45, 49], поэтому успех в дальнейшем снижении заболеваемости связывают с проведением вакцинопрофилактики [50–52].
Применение пенициллина во время родов может приводить в дальнейшем к развитию аллергических реакций у новорожденных. Предполагается, что вакцинация женщин перед родами может защитить новорожденных в перинатальный период их развития благодаря транспланцентарной передаче материнских IgG-антител. Это позволило бы исключить необходимость профилактики антибиотиками и проведение предварительных исследований на носительство СГВ у беременных женщин. Установлено, что в естественных условиях у женщин с антителами к капсульному антигену СГВ отмечается хорошая защита от инфицирования такими стрептококками. В опытах на небеременных женщинах, привитых капсулярным полисахаридным антигеном штамма СГВ, изолированного от больных, показана высокая иммуногенность и хорошая переносимость вакцины. Получены также обнадеживающие результаты при использовании для вакцинации женщин капсульного полисахарида, конъюгированного с белковым компонентом – столбнячным анатоксином, что приводило к продукции высокого уровня специфических антител, а в опыте на мышах защищало последних от летальной СГВ-инфекции. В настоящее время также ставится вопрос о необходимости вакцинации девочек, достигших пубертатного возраста, женщин репродуктивного возраста и маленьких детей. Вакцинация также позволит снизить риск развития инвазивных СГВ-инфекций среди пожилых лиц с хроническими заболеваниями различных органов и систем [18].
По данным ряда зарубежных специалистов, в основном из скандинавских стран, среди профилактических мероприятий наиболее перспективной с точки зрения эффективности, простоты применения и низкой стоимости оказалась санация хлоргексидином. Показано, что местное применение препарата подавляет носительство СГВ во влагалище и уретре у женщин, в 3–5 раз снижает риск возникновения инфекций, обусловленных СГВ. Тем не менее выявлен выраженный отрицательный побочный эффект, который проявляется в подавлении нормальной симбиотической микрофлоры влагалища, участвующей в обеспечении колонизационной резистентности его слизистой оболочки. Из этого сделано заключение, что использование хлоргексидина для санации женщин перед родами следует ограничить случаями, когда потенциальная опасность присутствия патогена превышает риск последствий подавления колонизационной резистентности влагалища, например, при гонококковом или кандидозном кольпите у рожениц [8].
Лечение
На современном этапе S. agalactiae сохраняют относительно высокую чувствительность к антибиотикам. Лечение СГВ-инфекции у новорожденных проводится пенициллином или ампициллином в комбинации с аминогликозидами (гентамицин, нетилмицин, амикацин). При менингите пенициллин следует назначать в дозе 500 000 МЕ/кг в сутки, ампициллин — 300 МЕ/кг в сутки. Рекомендуемая длительность терапии сепсиса составляет 7–10 дней. При неинвазивных СГВ-инфекциях продолжительность монотерапии составляет не менее 10 суток, при СГВ-неосложненных менингитах – не менее 14 суток, при СГВ-артритах и остеомиелитах – 3–4 нед., при СГВ-эндокартите и СГВ-вентрикулите – не менее 4 нед. Лечение менингита должно продолжаться еще в течение 14 дней после санации ликвора в связи с возможностью рецидивов [45, 47]. Детям, рожденным инфицированными матерями, необходимо проводить бактериологическое исследование мазков со слизистой зева, пупочной культи, наружного слухового аппарата, паховых складок. Профилактически антибактериальные препараты назначают только тем детям, у которых был получен положительный результат бактериологического исследования [53, 54].
В заключение следует подчеркнуть, что до сих пор в России нет учета заболеваний, вызываемых СГВ, нет централизованного скрининга беременных женщин, что в свою очередь не дает возможности установить достоверную частоту этой инфекции, а также частоту колонизации возбудителем беременных женщин. Нет данных о носительстве S. agalactiae среди лиц пожилого возраста. Необходимы также разработка и внедрение в практику программ по регистрации и профилактике, а в дальнейшем – и по вакцинации женщин против СГВ-инфекций.