Антиретровирусная терапия (АРВТ) направлена на прекращение размножения вируса иммунодефицита человека, являющегося возбудителем ВИЧ-инфекции, т. е. она является этиотропной терапией этого заболевания. Современная АРВТ не позволят полностью излечить ВИЧ-инфекцию, но она способна эффективно тормозить развитие болезни и даже добиваться ремиссии вторичных заболеваний и восстановления трудоспособности [1, 2].
Обычно схема АРВТ включает в себя «нуклеозидную основу» (два препарата класса нуклеозидных/нуклеотидных ингибиторов обратной транскриптазы ВИЧ – НИОТ) и третий препарат, которым может быть ненуклеозидный ингибитор обратной транскриптазы (ННИОТ), ингибитор протеазы (ИП), ингибитор интегразы (ИИ) или ингибитор хемокинового рецептора CCR5 [3, 4].
Основой успеха АРВТ является подбор такой комбинации препаратов, которая бы эффективно подавляла размножение вируса и хорошо переносилась, причем, поскольку АРВТ проводится пожизненно, т. е. препараты назначают на многие годы и даже десятилетия, важна именно хорошая долговременная их переносимость [3, 5]. Возникновение в процессе лечения побочных эффектов принимаемых препаратов может быть причиной прерывания терапии и повышения смертности [6].
В настоящее время в России в качестве нуклеозидной основы схемы АРВТ в основном используется сочетание зидовудина с ламивудином (ZDV/3TC). Однако ZDV из-за свойственных ему побочных эффектов (миелотоксичность в краткосрочном плане, липоатрофия в долгосрочном) наиболее авторитетными зарубежными руководствами рекомендуется лишь в качестве альтернативного препарата [7, 8], а в качестве приоритетного рекомендуется тенофовир (TDF) [5, 9–12]. Возможность применения TDF в качестве приоритетного препарата при составлении схем АРВТ предусмотрена и Клиническим протоколом диспансерного наблюдения и лечения больных ВИЧ-инфекцией Национального научного общества инфекционистов России [4].
В России TDF был зарегистрирован лишь весной 2010 г., не вошел в список важнейших и жизненно необходимых препаратов, не закупается в рамках приоритетного национального проекта «Здоровье» и опыт его применения в популяции российских пациентов практически отсутствует, что обуславливает актуальность проблемы. Кроме того, за рубежом TDF применяется в основном в сочетании с эмтрицитабином (FTC) в виде комбинированного препарата TDF/FTC, который в России в настоящее время не доступен. Поэтому изучение эффективности и безопасности сочетания TDF с 3ТС также представляет интерес.
Материалы и методы
Проведен анализ результатов лечения в течение 24 нед 45 взрослых больных ВИЧ-инфекцией, находившихся под наблюдением в Федеральном научно-методическом центре по профилактике и борьбе со СПИДом (специализированный отдел эпидемиологии и профилактики СПИДа Центрального НИИ эпидемиологии Роспотребнадзора), начавших получать схему АРВТ, включающую TDF. Лечение такими схемами АРВТ предлагалось всем пациентам, которые в период с 01.12.10 начинали получать АРВТ или которым требовалась ее коррекция. Обязательным условием было информированное согласие пациента, отсутствие противопоказаний к назначению TDF (указанных в инструкции по его применению), доступность для наблюдения в течение как минимум 1 года. Для женщин – отрицательный тест на беременность и отсутствие планов беременности в течение как минимум 1 года.
1-ю группу (19 человек) составили пациенты, ранее не получавшие АРВТ и имеющие показания к ее назначению. 2-ю (26 человек) – пациенты, уже находящиеся на АРВТ, которая требовала коррекции.
Из 45 пациентов мужчин было 24 (53%), женщин – 21 (47%). Возраст пациентов – от 25 до 49 лет, средний возраст составлял 32 года (медиана – 31 год).
TDF [дженерик, производимый компанией «Хетеро Драгс Лимитед» (Индия), выпускаемый под торговым названием «тенофовир»] разрешен к применению в Российской Федерации в апреле 2010 г. Препарат назначался в стандартной суточной дозе 0,3 г (по 1 таблетке 1 раз в сутки). Вторым препаратом, составляющим нуклеозидную основу схемы АРВТ, у всех пациентов был 3ТС.
Перед назначением схемы, включающей TDF, проводили клиническую оценку состояния больного (определение стадии и фазы болезни, вторичных и сопутствующих заболеваний), определение в крови количества CD4-лимфоцитов, концентрации РНК ВИЧ (вирусной нагрузки), общий анализ крови (с определением гемоглобина, эритроцитов, тромбоцитов, лейкоцитов, лейкоцитарной формулы), биохимическое исследование крови (АЛТ, АСТ, ЛДГ, билирубин, креатинин, мочевина, глюкоза, холестерин), общий анализ мочи. В процессе лечения обследование повторялось после 4-й, 12-й и 24-й недели.
Для оценки эффективности терапии использовались клинические (появление и течение вторичных заболеваний, изменение стадии болезни, смерть) и лабораторные критерии (изменение вирусной нагрузки и уровня CD4-лимфоцитов в крови, определение доли пациентов, достигших неопределяемого уровня РНК ВИЧ и уровня менее 1000 копий/мл через 12 и 24 нед лечения, оценка в те же сроки доли пациентов с уровнем CD4-лимфоцитов менее 50, 200 и 350 клеток/мкл. Кроме того, при оценке динамики уровня CD4-лимфоцитов проводили сравнение полученных показателей с ожидаемым их уровнем при естественном течении болезни, который рассчитывали, исходя из того, что при отсутствии АРВТ уровень CD4-лимфоцитов снижается в среднем на 70 клеток в год.
Для оценки переносимости терапии проводили регистрацию клинических и лабораторных нежелательных явлений, возникающих в период лечения, и оценку их связи с проводимой терапией, оценку динамики в процессе лечения уровня гемоглобина крови, сегментоядерных нейтрофилов, тромбоцитов, частоту и выраженность отклонения от нормы этих показателей, а также показателей биохимического анализа крови.
Учитывая малую численность наблюдаемых групп, статистический анализ полученных результатов осуществлялся с помощью следующих непараметрических критериев: критерия знаков, критерия Вилкоксона для сопряженных совокупностей и формулы Фишера.
Оценивались следующие гипотезы.
Для пациентов 1-й группы:
1. Схема терапии, включающая TDF + 3TC, замедляет прогрессирование ВИЧ-инфекции (уровень РНК ВИЧ снижается, уровень СD4-лимфоцитов повышается или не снижается).
2. Схема терапии, включающая TDF + 3TV, не замедляет прогрессирования ВИЧ-инфекции (уровень РНК ВИЧ повышается или не снижается, уровень СD4-лимфоцитов снижается).
Для пациентов 2-й группы:
1. Переход на схему терапии, включающей TDF + 3TC, замедляет прогрессирование ВИЧ-инфекции или не ухудшает ее течения (уровень РНК ВИЧ снижается или остается на неопределяемом уровне, уровень СD4-лимфоцитов повышается или не снижается).
2. Переход на схему терапии, включающей TDF + 3TC, приводит к прогрессированию ВИЧ-инфекции (уровень РНК ВИЧ становится определяемым, уровень СD4-лимфоцитов снижается).
Результаты и обсуждение
Из 19 пациентов 1-й группы («наивных») было 10 (53%) мужчин и 9 (47%) женщин. Медиана возраста пациентов составила 31 год (25–49 лет), 95% пациентов были в возрасте от 25 до 39 лет. Антитела к вирусу гепатита С были обнаружены у 5 (26%) пациентов, HBsAg не был обнаружен ни в одном случае. Наиболее вероятным путем заражения у 5 (25%) пациентов было внутривенное употребление психоактивных веществ, у остальных заражение, вероятно, произошло половым путем.
Схему TDF + 3TC + эфавиренз (EFV) получали 17 пациентов. 2 пациентам из-за наличия ограничений для применения EFV (ночной режим работы) были назначены ИП: атазановир + ритонавир (ATV/r) одному и лопинавир/ритонавир (LPV/r) – другому. В процессе лечения 4 (21%) пациентам EFV был заменен на LPV/r. Причиной замены у 3 (16%) пациентов была плохая клиническая переносимость EFV, у 1 (5%) – повышение АЛТ. Замены нуклеозидной основы в этих случаях не проводилось, терапия не прерывалась. 1 пациентка выбыла из-под наблюдения после 12-й недели лечения в связи с изменением места жительства.
У 13 (68%) пациентов ВИЧ-инфекция находилась в субклинической стадии (стадия 3), у 4 (21%) – в стадии 4А, у 2 (11%) – в стадии 4Б. Клинического прогрессирования ВИЧ-инфекции (перехода в более позднюю стадию или в фазу прогрессирования) в процессе лечения не было отмечено ни в одном случае.
Медиана уровня РНК ВИЧ (вирусной нагрузки) перед началом терапии составила 33 227 копий/мл (от 8504 до 1 634 467 копий/мл), после 4 нед лечения – 741 (30 005 – менее 50 копий/мл), после 12 нед – менее 50 (54 469 – менее 50 копий/мл), после 24 нед – менее 50 (624 – менее 50 копий/ мл). Снижение вирусной нагрузки в сравнении с уровнем перед началом терапии стало достоверно, начиная с 4-й недели (р < 0,01).
Данные об изменении в процессе лечения доли пациентов с неопределяемым (менее 50 копий/мл) уровнем РНК ВИЧ и уровнем РНК ВИЧ менее 1000 копий/мл у пациентов 1-й группы представлены на рис. 1.
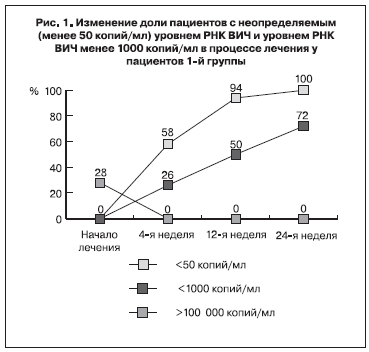
Обращает на себя внимание, что неопределяемый уровень РНК ВИЧ (менее 50 копий/мл) перед началом терапии не был отмечен ни у одного пациента, однако в процессе лечения доля таких пациентов нарастала. Это нарастание стало статистически достоверно уже с 4-й недели лечения, достигнув к 24-й неделе 69%. Одновременно уже с 4-й недели стала снижаться доля пациентов с высоким уровнем вирусной нагрузки. Начиная с 4-й недели лечения вирусная нагрузка более 100 000 копий/мл не регистрировалась. К 24-й неделе лечения уровень РНК ВИЧ в крови не превышал 1000 копий/мл ни у одного пациента. Индивидуальный анализ показал, что пятизначные цифры уровня РНК ВИЧ, отмечавшиеся на 4-й и 12-й неделе лечения, принадлежали одному пациенту. К 24-й неделе этот уровень снизился у него до 624 копий/мл. Вероятная причина – недостаточная приверженность к терапии.
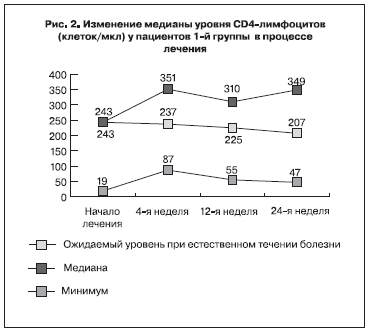
Данные о динамике уровня CD4-лимфоцитов в крови у пациентов 1-й группы представлены на рис. 2. Видно, что на фоне проводившейся терапии отмечалось повышение уровня CD4-лимфоцитов. Оно стало статистически достоверно, начиная с 4-й недели лечения. Обращает на себя внимание также тенденция к повышению минимального уровня CD4-лимфоцитов (с 19 клеток/мкл при начале терапии до 47 на 24-й неделе). К 24-й неделе лечения медиана уровня CD4-лимфоцитов на 106 клеток/мкл превышала исходный уровень и на 142 клетки/мкл – уровень, ожидаемый при естественном течении болезни.
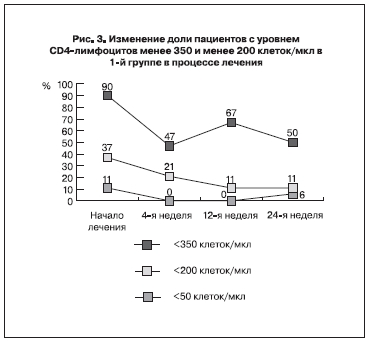
Пациенты с уровнем CD4-лимфоцитов менее 350 клеток/мкл (иммунологическое показание для назначения АРВТ) перед началом лечения составляли в 1-й группе 90% (17 человек), к 4-й неделе их доля снизилась до 47% (9 человек), на 12-й составила 67% (12 человек), на 24-й – 50% (9 человек).
Изменение в процессе лечения доли пациентов с уровнем CD4-лимфоцитов менее 350 клеток/мкл (иммунологическое показание к назначению АРВТ) и менее 200 клеток/мкл (высокий риск развития оппортунистических заболеваний и показание к химиопрофилактике пневмоцистной пневмонии) представлены на рис. 3. Видна тенденция к снижению доли пациентов с низким иммунным статусом в процессе лечения, однако эта тенденция была статистически достоверна только для пациентов с уровнем CD4-лимфоцитов менее 350 клеток/мкл на 4-й и 24-й неделе лечения.
У 3 (16%) пациентов 1-й группы в процессе лечения появились жалобы на головокружение, плохой сон. Это было расценено как побочный эффект EFV (наиболее частые проявления при лечении этим препаратом), который был заменен на LPV/r, после чего данные симптомы исчезли.
Изменений в анализе мочи в процессе лечения обнаружено не было.
Поскольку при использовании наиболее широко применяемого в России НИОТ ZDV, альтернативой которому и становится TDF, самым тяжелым из ранних побочных эффектов является угнетение кроветворения (анемия, гранулоцитопения, тромбоцитопения), была проанализирована динамика таких показателей, как уровень гемоглобина, гранулоцитов и тромбоцитов в крови.
Уровень гемоглобина (по медиане) перед началом лечения составил 137 г/л (минимум – 85 г/л, максимум – 163), после 4 нед лечения – 136 г/л (86–167 г/л), после 12 – 134 г/л (79–161 г/л), после 24 – 135 г/л (93–165 г/л), т. е. изменения этого показателя в процессе лечения не отмечалось. Также не отмечено изменений доли пациентов с пониженным уровнем гемоглобина в процессе лечения. У 3 пациентов перед началом терапии он был ниже нормы, у 1 из них он достигал второго уровня токсичности. В процессе лечения прогрессирования анемии у них не отмечалось.
Медиана уровня нейтрофилов в процессе лечения не изменилась. Перед его началом она составляла 2,81 млрд/л (минимум – 1,06 млрд/л, максимум – 4,6), после 4 нед лечения – 3,02 млрд/л (1,76–4,76 млрд/л), после 12 – 2,81 млрд/л (1,0–4,54 млрд/л), после 24 – 2,82 млрд/л (1,65–4,8 млрд/л).
У 2 пациентов с исходно умеренно сниженным (первая степень токсичности) уровнем нейтрофилов на фоне терапии произошло его восстановление. У 1 пациента на 12-й неделе отмечено транзиторное снижение этого показателя, не требовавшее лечения или коррекции терапии.
Данные о динамике уровня тромбоцитов в крови пациентов 1-й группы представлены на рис. 4.
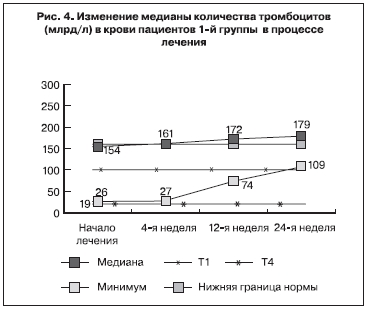
В процессе лечения количество тромбоцитов в крови пациентов 1-й группы (начавших АРВТ) нарастало и после 12 нед лечения стало статистически достоверно. Обращает на себя внимание тенденция к повышению минимального уровня тромбоцитов, отмечаемая в этой группе пациентов.
Также отмечена тенденция к уменьшению в процессе лечения количества пациентов с тромбоцитопенией. Перед началом лечения их доля составляла 48%, после 4-й недели – 37%, после 12-й – 16% (p < 0,05), после 24-й – 28%. При этом на 24-й неделе лечения ни у одного пациента тромбоцитопения не достигала даже первого уровня токсичности. Это относится и к 3 пациентам, имевшим перед началом терапии тромбоцитопению третьего уровня токсичности.
Достоверных изменений доли пациентов с повышенным уровнем АЛТ в процессе лечения не отмечено (21% до начала лечения, 21% после 4-й недели, 26% – после 12-й и 22% – после 24-й). У 1 пациента, имеющего в качестве сопутствующего заболевания гепатит С, после 12-й недели лечения было отмечено повышение АЛТ до уровня, соответствующего третьей степени токсичности. В связи с этим была произведена замена EFV на менее гепатотоксичный LPV/r, при этом прием остальных препаратов, входящих в схему лечения (TDF + 3TC), был продолжен. К 24-й неделе терапии АЛТ снизилась у этого пациента до уровня, соответствующего второй степени токсичности.
Уровень креатинина у всех пациентов был в пределах нормы как до начала лечения, так и при его проведении.
Уровень билирубина перед началом лечения был повышен у 1 пациента 1-й группы (до первой степени токсичности за счет прямой фракции). Впоследствии уровень билирубина у этого пациента нормализовался. У 1 пациента, получавшего схему АРВТ, включающую ATV/r, начиная с 12-й недели лечения было отмечено повышение билирубина (за счет непрямой фракции) до второй-третьей степени токсичности. Поскольку гипербилирубинемия является типичным осложнением лечения с применением ATV и не угрожает здоровью, назначенная терапия данному пациенту была продолжена.
Во 2-ю группу пациентов (ранее получавших АРВТ), вошли 14 (54%) мужчин и 12 (46%) женщин.
Медиана возраста пациентов 2-й группы составила 31 год (минимум – 24 года, максимум – 43), большинство пациентов входили в возрастные группы 30–39 лет (60%) и до 30 лет (32%).
Потребители инъекционных наркотиков составляли 19%. Среди мужчин их было 29%, среди женщин – 8%.
Антитела к вирусу гепатита С были обнаружены у 9 (35%) пациентов, HBsAg – у 3 (12%).
Во 2-й группе в субклинической стадии ВИЧ-инфекции (стадия 3) находились 14 пациентов, у остальных уже развилась стадия вторичных заболеваний (у 9 – 4А, у 1 – 4Б, у 2 – 4В).
Причинами смены схемы АРВТ на новую, включающую в качестве нуклеозидной основы сочетание TDF с 3ТС, были:
• замена ранее получаемой трувады (TDF + FTC) – у 8 пациентов;
• оптимизация терапии (замена препаратов с более высокой митохондриальной токсичностью) – у 6 пациентов;
• непереносимость ранее проводимой терапии – у 11 пациентов;
• неэффективность ранее проводимой терапии – у 1 пациента.
В качестве третьего препарата использовали EFV у 8 пациентов, ралтегравир (RAL) – у 8, LPV/r – у 5, невирапин (NVP) – у 2, ATV/r – у 2. В процессе лечения у 2 пациентов была произведена замена третьего препарата. В 2 случаях EFV из-за непереносимости был заменен на LPV/r (после 4-й и 12-й недели лечения), в 1 случае RAL был заменен на LPV/r (после 12-й недели лечения). При этом замена нуклеозидной основы не проводилась, терапия не прерывалась.
Из наблюдения выбыли 2 пациента после 4-й и 12-й недели лечения из-за перемены места жительства. Нежелательных явлений за время применения TDF у этих пациентов не было. У 1 пациента после 2 нед лечения появилась сыпь, вероятно, связанная с приемом EFV. Однако пациент отказался от замены только этого препарата и, в соответствии с собственными пожеланиями, был переведен на ранее получаемую терапию (LPV/r + ddI + 3TC), на фоне которой нежелательные проявления не возникали.
Клинического прогрессирования ВИЧ-инфекции (перехода в ее более позднюю стадию или из фазы ремиссии в фазу прогрессирования) в процессе лечения не отмечено ни в одном случае.
Медиана уровня РНК ВИЧ (вирусной нагрузки) перед началом терапии у пациентов 2-й группы была менее 50 копий/мл (неопределяемый уровень) и оставалась таковой на протяжении всех 24 нед лечения. Максимальный уровень вирусной нагрузки перед началом лечения составлял 93 439 копий/ мл, после 4 нед лечения – 15 793 копий/мл, после 12 нед – 628 копий/мл, после 24 нед – 70 копий/мл.
Данные об изменении распределения пациентов 2-й группы в зависимости от уровня РНК ВИЧ представлены на рис. 5.
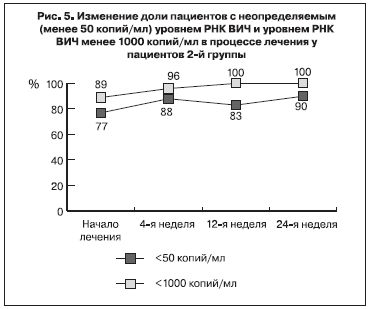
Как и можно было ожидать, неопределяемый уровень РНК ВИЧ (менее 50 копий/мл) отмечался у большинства (77%) пациентов 2-й группы уже перед началом терапии. Наметившаяся тенденция к нарастанию доли таких пациентов в процессе дальнейшего лечения была статистически не достоверна. Также не имела статистического подтверждения и тенденция к снижению доли пациентов с уровнем вирусной нагрузки более 1000 копий/ мл (на 12-й и 24-й неделе лечения такие показатели не отмечены ни у одного пациента).
Индивидуальный анализ изменения вирусной нагрузки показал, что у всех 3 пациентов, имевших перед переходом на схему АРВТ, содержащую в качестве нуклеозидной основы TDF + 3TC, уровень РНК ВИЧ более 1000 копий/мл, к 24-й неделе лечения произошло его снижение до неопределяемого. У 1 пациента неопределяемый уровень вирусной нагрузки был достигнут после 4-й, у 1 – после 12-й и у 1 – после 24-й недели лечения.
У 1 пациента, перешедшего на схему EFV + TDF + 3TC с ранее получаемой схемы LPV/r + ddI + 3TC и имевшего неопределяемый уровень вирусной нагрузки, на 2-й неделе лечения появилась сыпь, приведшая к прекращению пациентом приема препаратов и подъему к 4-й неделе вирусной нагрузки до 15 793 копий/мл. Появление сыпи было расценено как побочный эффект применения EFV (характерный для данного препарата), и пациенту было предложено продолжить лечение, заменив EFV. Однако он предпочел вернуться к ранее принимаемой схеме, несмотря на предоставленную ему информацию о ее худшей долговременной безопасности.
Еще у 2 пациентов, имевших при переходе на схему лечения, включающую TDF + 3ТС, неопределяемую вирусную нагрузку, после 12-й недели отмечалось транзиторное (однократное) ее повышение до уровня, не превышающего 1000 копий/мл.
Данные о динамике уровня CD4-лимфоцитов в крови пациентов 2-й группы в процессе лечения представлены на рис. 6.
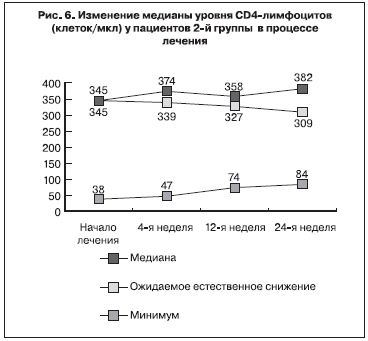
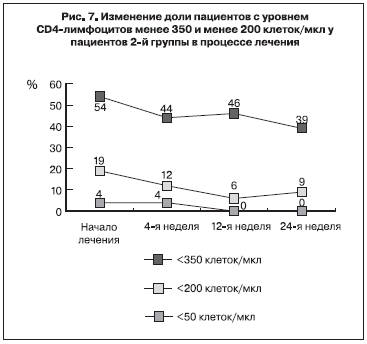
К 24-й неделе лечения медиана уровня CD4-лимфоцитов превышала уровень, отмеченный перед его началом, на 37 клеток/мкл и была на 73 клетки/мкл выше уровня, ожидаемого при естественном течении болезни. Минимальный уровень CD4-лимфоцитов, отмеченный в группе, увеличился на 46 клеток/мкл. Несмотря на это повышение уровня CD4-лимфоцитов во 2-й группе было статистически не достоверно. Также статистически не достоверно было снижение доли пациентов с низким (менее 350 и менее 200 клеток/мкл) количеством CD4-лимфоцитов (рис. 7).
В отличие от абсолютного числа CD-лимфоцитов повышение их процентного показателя к 24-й неделе лечения было статистически достоверно (p < 0,05). Медиана этого показателя перед началом лечения составляла 25% (5–41%), после 4-й недели – 25% (5–40%), после 12-й – 28% (5–40%), после 24-й – 32% (8–39%).
Нежелательные явления, приведшие к изменению проводимой терапии, отмечались у 3 (12%) пациентов 2-й группы. Во всех случаях они были связаны с приемом EFV и разрешились после замены этого препарата. Клинических нежелательных явлений, связанных с другими препаратами, выявлено не было.
Изменений в анализе мочи в процессе лечения обнаружено не было.
При клиническом анализе крови пациентов 2-й группы достоверных изменений медианы уровня гемоглобина, гранулоцитов и тромбоцитов в процессе лечения не было отмечено. Отмечавшееся на разных этапах лечения у 20–29% пациентов снижение уровня гемоглобина не превышало первой степени токсичности. У единичных пациентов на разных сроках лечения отмечалось снижение уровня нейтрофилов, не превышающее первой степени токсичности. Уровень тромбоцитов был в пределах нормы у подавляющего большинства (83–84%) пациентов, у 12–17% на разных сроках лечения отмечалось снижение, не превышающее первой степени токсичности. У 1 пациента при начале приема схемы, включающей TDF + 3TC, отмечался уровень тромбоцитов 70 млрд/л (вторая степень токсичности). К 4-й неделе лечения этот уровень повысился до 101 млрд/л, т. е. не достигал и первой степени токсичности.
Достоверных изменений доли пациентов с повышенным уровнем АЛТ в процессе лечения не было отмечено. У подавляющего большинства (84–91%) пациентов уровень АЛТ был в пределах нормы или незначительно повышен, не достигая первой степени токсичности. У 2 пациентов, имевших перед переходом на лечение схемой, содержащей TDF, уровень АЛТ, соответствующий второй степени токсичности, на фоне новый схемы лечения произошло снижение уровня этого фермента в одном случае до нормы, в другом – до первой степени токсичности. У 1 пациента, имевшего изначально нормальный уровень АЛТ, после 24-й недели лечения отмечено его повышение до второй степени токсичности; вероятной причиной этого является применение EFV.
Уровень креатинина у всех пациентов 2-й группы в ходе лечения был в пределах нормы.
Достоверных изменений доли пациентов с повышенным уровнем билирубина в процессе лечения не отмечено. У подавляющего числа (82–92%) пациентов уровень билирубина был в пределах нормы. Индивидуальный анализ пациентов, имеющих повышенный уровень билирубина, показал, что во всех случаях это повышение отмечалось у пациентов, получавших ATV. Поскольку гипербилирубинемия является типичным осложнением лечения с применением ATV и не угрожает здоровью пациента, назначенная терапия данным пациентам была продолжена.
Таким образом, анализ результатов первых 24 нед применения схем АРВТ, включавшей в свою нуклеозидную основу TDF производства компании «Хетеро Драгс Лимитед» (Индия) и 3ТС при использовании в качестве третьего препарата ННИОТ, ИП или ИИ, у больных ВИЧ-инфекцией, не получавших АРВТ и получавших ранее другие схемы лечения, показал вирусологическую и иммунологическую эффективность, хорошую переносимость и безопасность.
В группе пациентов, ранее не получавших АРВТ, отмечено снижение к 24-й неделе лечения вирусной нагрузки до неопределяемого (менее 50 копий/мл) уровня у 72% пациентов и до уровня менее 1000 копий/мл у всех пациентов. К этому же сроку произошло повышение медианы уровня CD4-лимфоцитов на 104 клетки/мкл в сравнении с исходным уровнем.
В группе пациентов, ранее получавших АРВТ и перешедших на схему, содержащую TDF, к 24-й неделе лечения по новой схеме повышения вирусной нагрузки не отмечалось (она оставалась на неопределяемом уровне), а уровень CD4-лимфоцитов, по крайней мере, не снижался (его повышение было статистически не достоверным).
Клинического прогрессирования ВИЧ-инфекции или развития нежелательных явлений, связанных с приемом TDF, у пациентов обеих групп не было отмечено.
АРВТ, включающая в качестве нуклеозидной основы TDF с 3ТС, может применяться как при начале терапии, так и для замены ранее применявшихся НИОТ, в том числе при их непереносимости.


