Современные эпидемиологические данные свидетельствуют об увеличении внутри- и внебольничной заболеваемости антибиотикоассоциированными диареями (ААД), ростом более тяжелых форм заболевания, склонностью к рецидивированию, ростом летальности [1]. Этиологическим фактором развития такой диареи являются Clostridium difficile, Clostridium perfringens, Staphylococcus aureus, Salmonella spp., Klebsiella oxytoca, Candida spp. ААД относятся к госпитальным инфекциям, однако в последнее время они все чаще развиваются в амбулаторных условиях. По данным многоцентрового исследования, проведенного в США [1], в структуре возбудителей внутрибольничных инфекций Cl. difficile занимает первое место (12,1%), опережая S. aureus (10,7%), K. pneumoniae (9,7%) и E. coli (9,3%) [1]. В разных странах частота заболеваний составляет 0,7–28,7 на 10 000 койко-дней [1, 2].
Clostridium difficile – грамположительная спорообразующая облигатно-анаэробная бактерия, входящая в состав кишечной микробиоты у 3–15% здоровых взрослых [1, 3–5]. Споры способны выживать как в неблагоприятных условиях окружающей среды, так и под действием распространенных дезинфектантов, в связи с этим инфекция склонна к рецидивированию, которое происходит примерно в 20% случаев [1–6].
Cl. difficile-ассоциированную инфекцию вызывают только токсигенные штаммы [7]. Ключевую роль в патогенезе играют 2 токсина: энтеротоксин А (TcdA) и токсин В (TcdB), обладающий цитотоксическим эффектом. Оба токсина тропны к различным видам клеток в организме человека [8]. Около 10% штаммов C. difficile являются гипервирулентными и относятся к риботипу NAP1/027. Эти штаммы синтезируют бинарный токсин, усиливающий адгезию и колонизацию бактерии, образующий комплекс на мембране энтероцитов, способный нарушать структуру цитоскелета и вызывать апоптоз энтероцитов. Таким образом, у инфицированных штаммом NAP1/BI/027 пациентов чаще отмечаются тяжелое и осложненное течение заболевания, рецидивирование с летальным исходом [8, 9].
В настоящее время проблема полипрагмазии очень актуальна. К факторам риска, приводящим к нарушению состава микробиоты с формированием «ниши» для колонизации Cl. difficile, относятся: возраст старше 65 лет [10]; частый, неконтролируемый прием антибактериальных, иммуносупрессивных и противоопухолевых препаратов [11]; хирургические вмешательства на органах ЖКТ [12]; снижение кислотности желудочного сока при приеме ингибиторов протонной помпы [13].
В клинике инфекции, вызванной Cl. difficile, выделяют легкое, среднетяжелое и тяжелое течение. Легкие и умеренные формы характеризуются наличием диареи (неоформленный стул 3 раза в сутки и чаще) в сочетании с умеренной болью в животе и субфебрильной лихорадкой. При тяжелом течении заболевания в стуле обнаруживают примеси слизи и крови, отмечается подъем температуры тела до фебрильных цифр, болезненность при пальпации живота. В лабораторных анализах характерны также гипоальбуминемия (менее 30 г/л), лейкоцитоз (более 15 х 109/л), электролитные расстройства.
К осложнениям клостридиальной инфекции относят токсическую дилатацию толстой кишки, перфорацию толстой кишки, кишечную непроходимость, полиорганную недостаточность [2, 6].
Обследование пациентов на Cl. difficile-инфекцию следует проводить при наличии жидкого стула и факторов риска в анамнезе [6]. Диагностика заболевания включает определение токсинов А и В методом ИФА, культуральное исследование, определение глутаматдегидрогеназы (ГДГ) методом ИФА, исследование в культуре клеток и реакцию нейтрализации токсина, ПЦР-диагностику для определения генов, кодирующих образование токсинов. Каждый метод имеет свои достоинства и недостатки, поэтому рекомендуется использовать нескольких тестов одновременно [6, 14, 15].
Из инструментальных методов исследования важным является колоноскопия, при которой часто это заболевание сопровождается картиной псевдомембранозного колита: выявляются диффузная гиперемия и отечность слизистой оболочки с утолщением стенки кишки; фибринозные бляшки желтовато-белого цвета (псевдомембраны), имеющие тенденцию к слиянию; слизистая оболочка под наложениями подвергается некрозу и изъязвляется [16].
Клостридиальный колит следует дифференцировать с бактериальными кишечными инфекциями (сальмонеллезом, острым шигеллезом и т. д.), хроническими воспалительными заболеваниями кишечника (болезнью Крона, язвенным колитом), раком толстой кишки. Дифференциальная диагностика представлена в табл. 1 [17–19].
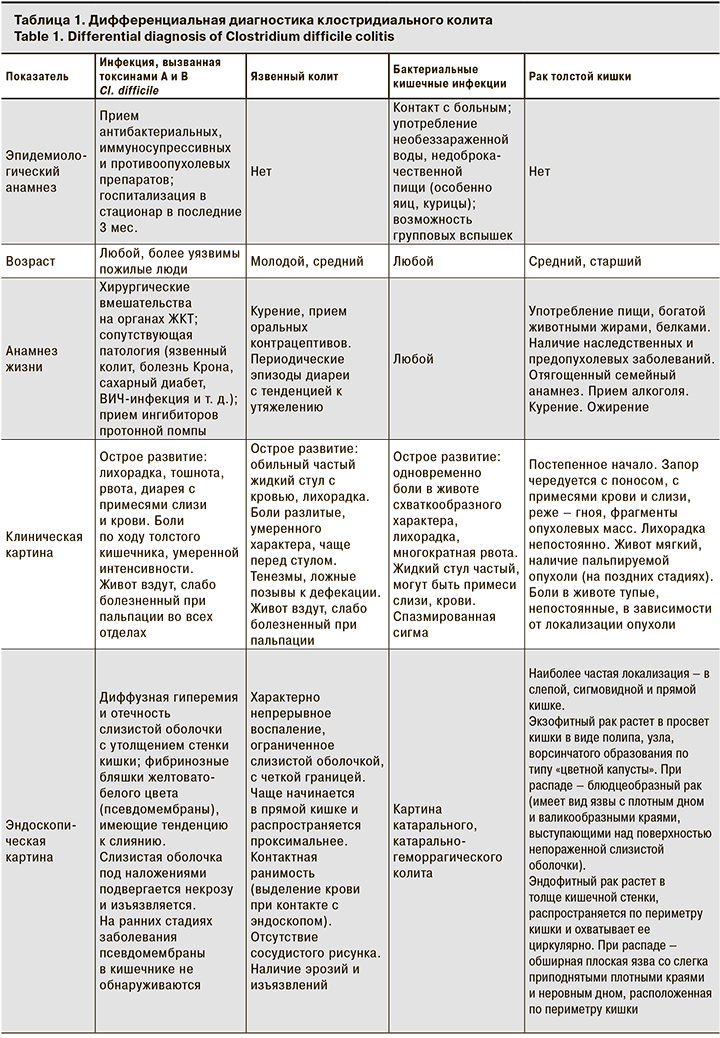
Наиболее часто больных клостридиальной инфекцией госпитализируют в стационар с подозрением на кишечную инфекцию. Именно поэтому при осмотре следует уделить внимание тщательному сбору анамнеза и выявлению неблагоприятных факторов, таких как прием антибактериальных препаратов, хирургические вмешательства на органах ЖКТ, госпитализация в последние 3 мес., длительная диарея с примесями слизи и крови в стуле – все это может указывать на Cl. difficile-инфекцию.
Приводим клиническое наблюдение.
Больная Б., 66 лет, поступила в отделение кишечных инфекций ГБУЗ «Инфекционная клиническая больница № 2» Департамента здравоохранения города Москвы 01.10.2018 с жалобами на слабость, жидкий стул.
Из анамнеза известно, что пациентка заболела 27.09.2018, когда появились выраженная слабость, тошнота, дискомфорт в животе, жидкий стул до 15 раз без патологических примесей, озноб, судороги конечностей, повышение температуры тела до 38,7 оС.
Из эпидемиологического анамнеза известно, что больная накануне ела красную икру. Контакты с больными отрицает и за последние 2 мес. за пределы Москвы не выезжала. Резекция прямой кишки по поводу рака прямой кишки была проведена 01.03.2018, 07.09.2018 – закрытие илеостомы. С профилактической целью назначен курс цефотаксима (4 г в сутки).
При поступлении объективно: состояние средней тяжести. Температура тела 37,6 °C. Масса тела 53 кг, рост 163 см. Сознание ясное, контактна, ориентирована, адекватна. Менингеальных, очаговых неврологических знаков нет. Кожные покровы бледноваты, сыпи нет. Склеры и слизистая оболочка ротоглотки обычной окраски. Периферические лимфатические узлы не увеличены. При перкуссии легких – ясный легочный звук над всеми полями легких. Аускультативно дыхание везикулярное, хрипов нет, ЧДД – 18 в 1 минуту. Границы сердца в норме. Аускультативно тоны сердца ясные, ритмичные. ЧСС – 78 ударов в минуту. АД –110/70 мм рт. ст. Язык влажный, обложен белым налетом на корне. Живот мягкий, обычной формы, при пальпации болезненный по ходу толстого кишечника. Перистальтика выслушивается, газы отходят. Печень не увеличена. Селезенка не пальпируется. Симптом поколачивания отрицательный с обеих сторон. В первый день госпитализации стула не было Мочеиспускание не нарушено, моча желтого цвета.
Общий анализ крови от 01.10.2018: Hb – 108 г/л, эритроциты – 3,63 х 1012/л, лейкоциты – 8 х 109/л, тромбоциты – 380 х 109/л, СОЭ – 5 мм/ч.
Биохимический анализ крови от 01.10.2018: общий белок – 62 г/л, мочевина – 12,7 ммоль/л, креатинин – 106 мкмоль/л, билирубин общий – 10,4 мкмоль/л, холестерин – 5,79 ммоль/л, АлАТ – 328,6 Ед/л, АсАТ – 299,3 Ед/л, ЩФ – 79 Ед/л, глюкоза – 4,9 ммоль/л, амилаза – 31 Ед/л.
Общий анализ мочи от 02.10.2018: отн. плотность – 1024, рН – 6,0, белок – 0,46 г/л, лейкоциты – 3–5 в п/зр., эритроциты – 1–3 в п/зр.
Анализы кала на кишечную группу, на яйца глист и простейшие, на вирусы –отрицательные.
По данным обзорной рентгенографии органов брюшной полости от 6.10.2018, патологических изменений в брюшной полости не выявлено.
По данным УЗИ органов брюшной полости от 6.10.2018, обнаружены умеренные диффузные изменения в паренхиме печени, поджелудочной железы; 3 полостных образования паренхимы печени (УЗ-признаки, наиболее типичные для кист, нельзя исключить mts).
Учитывая данные анамнеза, эпидемиологического анамнеза, прием антибактериальных препаратов и клиническую картину, был заподозрен антибиотикоассоциированный энтероколит. Для исключения клостридиальной инфекции больной 2.10.2018 проведен анализ кала на токсины А и В к Cl. difficile. Оба результата положительные.
Назначена терапия в соответствии с клиническими рекомендациями лечения: оральная регидратация регидроном, внутривенная регидратационная и дезинтоксикационная терапия (ацесоль), метронидазол 500 мг 3 раза в день перорально курсом 5 дней, смектит диоктаэдрический 1 пакетик 3 раза в день, дротаверин 40 мг х 3 раза в день, панкреатин 10 000 ЕД 3 раза в день, бифидумбактерин 1 пакетик 3 раза в день в течение 10 дней.
На фоне проводимой терапии на 3-й день состояние пациентки ухудшилось: нарастала астения, сохранялись отсутствие аппетита, стойкая лихорадка до 38,7 оС, появилась многократная рвота. ЧСС – 82 в минуту. АД – 100/70 мм рт.ст. Язык сухой, обложен белым налетом у корня. Живот мягкий, обычной формы, при пальпации болезненный по ходу кишечника. Перистальтика выслушивается, газы отходят. Стул в течение 3 дней отсутствовал.
Учитывая неэффективность проводимой терапии, на 5-е сутки произведен вираж метронидазола на ванкомицин 1,0 г в сутки перорально курсом 10 дней. В связи с непрекращающейся рвотой и отсутствием аппетита больная была переведена на парентеральное питание (фрузебин).
На фоне коррекции терапии на 5-е сутки была достигнута положительная динамика: регресс лихорадки и диспепсического синдрома, появился аппетит, больная стала более активной. Пациентка была переведена на энтеральное питание (щадящая диета).
На 10-й день приема ванкомицина состояние удовлетворительное. Не лихорадит. Сознание ясное, пациентка контактна, ориентирована, адекватна. Менингеальных, очаговых неврологических знаков нет. Кожные покровы и слизистые оболочки обычной окраски, чистые. Периферические лимфатические узлы не увеличены. Аускультативно дыхание везикулярное, хрипов нет. ЧДД – 18 в 1 минуту. Границы сердца в норме. Тоны сердца ясные, ритмичные. ЧСС – 72 в минуту. АД – 115/70 мм рт. ст. Язык влажный, чистый. Живот мягкий, обычной формы, при пальпации безболезненный. Перистальтика выслушивается, газы отходят. Стул оформленный. Мочеиспускание не нарушено.
Больная выписана в удовлетворительном состоянии с выздоровлением.
Основной диагноз: энтероколит, вызванный токсинами А и В Cl. difficile, тяжелое течение.
Осложнения: эксикоз II степени.
Сопутствующий диагноз: состояние после резекции прямой кишки. Хроническая анемия легкой степени тяжести.
Нуждается в наблюдении гастроэнтеролога, инфекциониста, онколога в поликлинике по месту жительства в течение 3 мес. Рекомендованы соблюдение щадящей диеты в течение 2 нед.; контроль клинического анализа крови, биохимического анализа крови; УЗИ органов брюшной полости в динамике в поликлинике по месту жительства.
Заключение
Таким образом, наличие инфекции Clostridium difficile является одной из актуальных проблем медицины, риск развития которой увеличивается у больных пожилого возраста и пациентов с сопутствующей патологией. ААД характеризуется часто типичной клинической картиной кишечной инфекции. Очень важны тщательно собранный анамнез, эпидемиологический анамнез, анализ результатов линико-лабораторных и эндоскопических методов исследования. Своевременная диагностика и правильная тактика лечения способствуют быстрому выздоровлению и восстановлению пациента с ААД, а рациональное применение и оптимальный курс антибактериальных препаратов являются условиями снижения риска развития Cl. difficile-ассоциированной инфекции.


