Несколько лет назад специалистами Центрального НИИ эпидемиологии Роспотребнадзора было открыто новое инфекционное заболевание человека – иксодовый клещевой боррелиоз (ИКБ), вызываемый спирохетами Borrelia miyamotoi [1–3]. Как выяснилось, заболевание имеет достаточно широкое распространение не только в России, но и в других странах Евразии и Северной Америки [4–7]. Ранее оно ошибочно диагностировалось как «болезнь Лайма (БЛ) в безэритемной форме», однако БЛ – это ИКБ, вызываемый иными боррелиями, входящими в группу B. burgdorferi sensu lato [8, 9]. B. miyamotoi генетически ближе к боррелиям из группы возбудителей клещевых возвратных лихорадок (КВЛ) [10, 11], например, B. persica (распространена в Средней Азии), B. hispanica (встречается на юге Европы), B. hermsii (вызывает заболевания в горных районах на западе США и Канады), B. duttonii или B. crocidurae (возбудители наиболее массовых трансмиссивных бактериальных инфекций в Африке) [12–15]. Основное отличие B. miyamotoi от возбудителей КВЛ заключается в том, что она переносится «твердыми» клещами рода Ixodes [3, 16], а не «мягкими» клещами рода Ornithodoros. Поэтому ИКБ, вызываемый Borrelia miyamotoi, (ИКБ-БМ) обнаруживается преимущественно в регионах с умеренным климатом, а КВЛ распространены в зонах теплого и жаркого климата [4, 5, 12–15]. В настоящее время эпидемиологические особенности и клинические проявления ИКБ-БМ активно изучаются [17–19]. В целом клиническая картина ИКБ-БМ напоминает клинику КВЛ и характеризуется высокой лихорадкой, слабостью, головной болью, тошнотой и другими признаками интоксикации [17–19], а также отсутствием типичной для БЛ мигрирующей эритемы. Приблизительно у половины больных ИКБ-БМ протекает в «гриппоподобной» лихорадочной форме, у остальных лихорадочная форма отягощается признаками умеренных и преходящих дисфункций различных органов и систем (печени, почек, сердца, легких и др.) [20–24]. Без антибиотикотерапии возможно несколько рецидивов ИКБ-БМ, что наблюдается и при КВЛ [1, 4, 5, 25]. Адекватная антибиотикотерапия (доксициклин или цефтриаксон) приводит к выздоровлению всех больных, и насколько можно судить по предварительным данным диспансерного наблюдения переболевших ИКБ-БМ в 2009–2015 гг. – без развития каких-либо серьезных последствий или хронической инфекции. Однако озабоченность вызывает сам факт родства B. miyamotoi и возбудителей КВЛ, поскольку КВЛ у беременных часто сопровождается патологией беременности и родов [12–14]. Не исключено, что ИКБ-БМ также может вызывать патологию беременности, то есть представлять дополнительную угрозу здоровью населения России. На ближайшие годы нами запланировано проспективное, с применением современных лабораторных методов, исследование этой проблемы, поэтому возникла необходимость систематизировать существующую информацию о КВЛ при беременности, поскольку последние, заведомо неполные обзоры были опубликованы в начале 80-х годов прошлого века [26–27].
Структура обзора такова: вначале будут кратко рассмотрены спектр и причины патологии беременности и родов при различных инфекционных заболеваниях, с которыми необходимо дифференцировать патологические состояния, вызываемые возбудителями КВЛ или B. miyamotoi, затем мы максимально полно рассмотрим имеющиеся свидетельства о патологии беременности и родов при КВЛ.
Кроме собственно гибели плода на разных сроках беременности (спонтанных выкидышах, замершей беременности, мертворождении), младенческой и материнской смертности, к патологии беременности относятся острые и хронические внутриутробные инфекции и вызываемые ими пороки развития. Далее будут рассмотрены в основном инфекционные причины мертворождения, поскольку это не только одно из наиболее тяжело переносимых событий, но и явление, однозначно регистрируемое и достаточно широко изучаемое. На 1000 беременностей приходится от 3–5 рождений мертвого плода в наиболее благополучных странах до 20–100 мертворождений в странах с низким уровнем медицинского обслуживания и плохими социально-экономическими условиями в целом [28–30]. Эта частота сравнима с соответствующими величинами неонатальной (до 28 дней) и младенческой (до года) смертности. Почти 80% мертворождений приходятся на преждевременные роды. По современным оценкам, инфекции ответственны за 10–25% мертворождений в развитых странах и за 50% и более – в странах с низким или средним доходом на душу населения. Эти величины зависят и от формального определения мертворожденности, принятого в различных странах или конкретных исследованиях. Границы гестационного возраста для понятия «мертворождение» варьируют от 20 до 28 недель, вес при рождении – от 350 до 1000 г. Поскольку влияние инфекций сильнее проявляется именно с 20-й по 28-ю неделю беременности и, соответственно, при малом весе плода, при минимальных границах в 20 недель/350 г оценки вклада инфекций в мертворождение будут выше. Вклад инфекций может быть недооценен, поскольку выявление инфицированности и доказательство причинной связи мертворождения с инфекцией зачастую требует применения высокотехнологичных лабораторных методик, которые обычно используются только в исследовательских целях [28–30].
Механизмы влияния инфекций на патологию беременности разнообразны. Заболевание матери, сопровождающееся высокой лихорадкой, нарушениями дыхания или кровообращения, другими системными реакциями, может непосредственно привести к мертворождению (или, на ранних сроках, к выкидышу) или преждевременным родам. При клинически нормальной беременности воспалительные реакции матери подавлены вплоть до начала родов, когда выброс простагландинов и воспалительных цитокинов способствует созреванию шейки матки, разрыву плодных оболочек и сокращениям миометрия. Выделение аналогичных медиаторов воспаления при инфекции может послужить сигналом к началу схваток. Может быть нарушено трансплацентарное снабжение плода кислородом и питательными веществами в результате инфицирования плаценты (что имеет место при малярии) или без такового. Внутриутробная инфекция плода может вызывать немедленное повреждение его жизненно важных органов, пренатальные и постнатальные пороки развития, а также, продолжаясь после родов, выражаться в тяжелом, нередко летальном, заболевании младенца. Наконец, инфицирование родовых путей может приводить к инфицированию новорожденных, травмам, гнойно-септическим осложнениям после родов. Кроме того, ряд инфекций тяжелее переносится беременными, что является одной из причин материнской смертности [29, 30].
Известны сотни инфекционных или паразитарных заболеваний, которые могут чаще или реже приводить к патологии беременности и родов [29, 30]. Из паразитарных заболеваний следует упомянуть гельминтозы и кандидозы. Из протозойных инфекций наиболее велик ущерб от малярии, трипаносомозов (в эндемичных регионах), токсоплазмоза. Патология беременности может быть обусловлена множеством вирусных заболеваний, от самых распространенных, таких как грипп, краснуха, ветряная оспа, лихорадка денге и т. п., до экзотических, например, коронавирусной инфекции ТОРС-SARS. В случаях внутриутробной гибели плода, которые не удается объяснить иными инфекционными или неинфекционными причинами, в тканях плода и плаценты часто (в 25–45% случаев) выявляются вирусы герпес-группы (обычно цитомегаловирус, реже – HSV, HHV-7, HHV6 [31]) или вирус Коксаки [32]. Ряд вирусов, например, вирус Коксаки, сильнее ассоциированы с патологией беременности и плода, чем с заболеваниями детей и взрослых. Парвовирус В19 в постнатальном периоде вызывает обычно легкие или бессимптомные инфекции, но, по разным оценкам, в развитых странах от 1 до 15% мертворождений обусловлены этой вирусной инфекцией, приводящей к тяжелой анемии и неиммунной водянке плода. Недавно открытый зоонозный пикорнавирус Люнган (Ljungan), хозяевами которого являются широко распространенные рыжие полевки и другие мелкие грызуны, в Швеции был выявлен в тканях 40% (4 из 10) мертворожденных плодов, а также в половине случаев внутриутробной гидроцефалии и анэнцефалии, но не обнаруживается при нормальной беременности [33, 34].
Переходя к бактериальным инфекциям, упомянем о важной роли восходящих по генитальному тракту инфекций (стрептококки группы В, клебсиеллы, уреаплазма, микоплазма и др.), вызывающих хориоамнионит и, как следствие, ответственных за десятки процентов мертворождений, и рассмотрим трансплацентарные бактериальные инфекции. На первом месте, вероятно, стоит спирохета Treponema pallidum, ежегодно вызывающая в мире миллионы случаев гибели плода и врожденного сифилиса. Большинство других трансплацентарных внутриутробных инфекций вызываются возбудителями зоонозных и природно-очаговых заболеваний – лептоспироза, листериоза, бруцеллеза, лихорадки Ку, туляремии, сибирской язвы [29, 30].
Роль наиболее часто встречающейся в России трансмиссивной бактериальной инфекции – БЛ – исследуется с момента ее открытия в 1983–1984 гг., однако достаточно убедительных свидетельств влияния B. burgdorferi sensu lato на протекание беременности не получено [35, 36]. Описаны десятки случаев трансплацентарной инфекции плода, вызванной B. burgdorferi sensu lato; от 10 до 25% подобных беременностей оканчивается неблагополучно: выкидышами, мертворождением, пороками развития или смертью новорожденного. Однако причинно-следственная связь подобных неблагополучных исходов непосредственно с инфекцией считается недоказанной [9, 37]. Проведенные проспективные исследования новорожденных и их матерей, проживающих в эндемичных по БЛ регионах, не выявили различий в частоте патологий беременности и плода у матерей, которые, судя по клиническим и/или серологическим данным, перенесли БЛ во время беременности, и в контрольной группе беременных без БЛ в анамнезе. Возможно, различия и существуют, но они настолько невелики, что не могут быть статистически значимо подтверждены даже на нескольких тысячах пар мать–ребенок [38, 39]. В результате интерес к данной проблематике был утерян, и исследования свернуты. Современные методические документы не рекомендуют какого-либо особого наблюдения, профилактических мер или изменения терапии в случае БЛ у беременных, за исключением применения цефтриаксона или пенициллина внутривенно вместо доксициклина [8, 40]. Однако исследование, проведенное в Центре клещевых инфекций Венгрии в 1986–2009 гг. добавляет к ситуации новые штрихи [41]. За этот период в Центре наблюдалось 8149 пациентов с БЛ в эритемной форме, в том числе 95 рожениц. У 20 из них выявили 23 осложнения беременности разной степени тяжести. Показатели частоты выкидышей, преждевременных родов и мертворождений не превышали таковые в венгерской популяции в целом (соответственно 148, 82 и 5 случаев на 1000 беременностей). У детей, рожденных от матерей с БЛ во время беременности, заметно выше обычного была частота такого осложнения, как кавернозная гемангиома (у 4 из 95). Частота осложнений значимо различалась в трех группах: выше всего она была, если матери не получали антибиотикотерапию (6 осложнений на 10 беременных), несколько ниже – у беременных, получавших антибиотики перорально (6 на 19 беременных), и невелика при парентеральном лечении цефтриаксоном (8 на 66). При этом частота наиболее тяжелого неблагоприятного исхода – невынашивания беременности – различалась разительно: 3 на 10, 3 на 19 и всего лишь 1 случай на 66 беременных соответственно. Если это наблюдение будет подтверждено, можно будет предположить, что нелеченная БЛ способна вызывать осложнения, которых удается избежать при адекватной антибиотикотерапии. Это обстоятельство важно для российской ситуации, в которой далеко не все лица с БЛ в эритемной форме обращаются за медицинской помощью.
Переходя к патологии беременности при КВЛ, сразу следует заметить, что КВЛ являются «пренебрегаемыми тропическими болезнями». Для подготовки этого обзора пришлось разыскать статьи 30–50-летний давности и/или опубликованные в малодоступных журналах, издаваемых в Африке. Большинство исследований КВЛ у беременных выполнено в 60–80-е годы прошлого века в сельских районах Африки с использованием простейших лабораторных методов и фиксацией только самых тяжелых осложнений. Однако известно, что по сравнению с современным «золотым стандартом» диагностики КВЛ, а именно с ПЦР-методиками, традиционный метод выявления боррелий путем микроскопии мазка крови имеет чувствительность от 15 до 50% [42–44]. Кроме того, в африканских условиях в больницы направлялись только наиболее тяжелые пациенты, и в результате возможность и частота патологий беременности при среднетяжелом или легком течении заболевания не могла быть изучена. Публикации по КВЛ у беременных в развитых странах (США, Израиль) единичны. Поэтому встречаемость нелетальных, а возможно и летальных патологий беременности при КВЛ, вероятно, недооценена.
Уже в систематическом обзоре P.M. Southern Jr. и соавт. [45] упоминается высокая частота выкидышей при боррелиозных возвратных лихорадках. С 1960-х годов стали накапливаться данные о врожденных КВЛ у новорожденных [46–50], систематизированные в работе P. Yagupsky и соавт. [27] и обзоре P.F. Goubau [26]; отмечалась высокая летальность этого заболевания даже при своевременной антибиотикотерапии.
В результате исследования сотен беременных с КВЛ и другими инфекционными заболеваниями, сопровождающимися лихорадкой, в Руанде P.F. Goubau и С. Munyngeyo обнаружили высокий процент случаев прерывания беременности (выкидыши – 11%, преждевременные роды – 22%). Смертность матерей в перинатальном периоде составляла от 9 до 16%. Неонатальная смертность среди детей, рожденных от матерей с КВЛ, превышала 50%, но только в единичных случаях удалось подтвердить врожденную КВЛ [48].
В масштабном исследовании в Танзании [51] всего за год на базе одной сельской больницы Мвуми было выявлено более 570 больных, включая 45 беременных и 11 новорожденных, с лабораторно подтвержденной врожденной КВЛ. Двое из этих новорожденных умерли, несмотря на лечение антибиотиками. 27 беременных были госпитализированы, 22 из них разрешились в больнице, 10 – преждевременно, 11 – в срок; у 1 женщины случился выкидыш; лишь 5 женщин были выписаны с выздоровлением и сохранившейся беременностью. Четверо новорожденных из 21 умерли. В публикации H.T. Dupont и соавт. [52] сообщается, что в Демократической Республике Конго роды двух беременных с КВЛ закончились в одном случае благополучно, в другом – мертворождением. Р. Lepage и соавт. [53] сообщил о выявлении и успешном лечении новорожденного с врожденной КВЛ в Руанде.
Цикл исследований P.W. Melkert и соавт. [54–56] на базе больницы Сенгерема в Танзании выявил широкий спектр осложнений беременности и родов при КВЛ: внутриутробную гибель плода (7%), случаи перинатальной смерти матери (4%) или ребенка, высокую (до 60%) летальность при лабораторно подтвержденных случаях врожденной КВЛ. Было показано, что вероятность осложнений значительно выше у больных с высокой спирохетемией (от 1 боррелии на 1 лейкоцит в мазке толстой капли крови и более – вплоть до образования микроагрегатов боррелий). На этом этапе высказывались, хотя и без глубокого изучения проблемы, и гипотезы, объясняющие высокую перинатальную смертность иммуносупрессивным состоянием, развивающимся у многих беременных, и низкой фагоцитарной активностью нейтрофилов и моноцитов/макрофагов новорожденных. Позднее на моделях мышей, зараженных боррелиями-возбудителями возвратных лихорадок, была подтверждена возможность трансплацентарной внутриутробной инфекции, изучены патогенетические механизмы повреждения плода, и показана критическая важность фагоцитарной системы для защиты от КВЛ [57, 58].
Исследование V.H. Jongen и соавт. [59] было выполнено на базе больницы Ндала, располагавшейся в сельском районе Табора центральной части Танзании. За период с 1985 по 1995 г. в больницу поступили 137 женщин с острым заболеванием КВЛ на различных сроках беременности. 47 (34%) из них были выписаны после проведения антибиотикотерапии, последующее наблюдение за 17 беременными выявило 2 случая перинатальной гибели плода. У остальных 80 женщин в течение нескольких дней после госпитализации инфекция спровоцировала 4 выкидыша (вес плода меньше 500 г) и 76 родов, в 31 (41%) случае – на сроках беременности меньше 36 недель. Риск начала родовой деятельности был выше на поздних сроках беременности и при высоком уровне спирохетемии в крови матери. 20 из 78 детей родились мертвыми. Из 58 оставшихся в раннем неонатальном возрасте умерли 14 детей (у одного из них был подтвержден диагноз врожденной КВЛ). Это соответствовало перинатальной смертности в 436 случаев на 1000 родов, что более чем в 10 раз превышало показатель перинатальной смертности в этом регионе (37 смертей на 1000). В целом перинатальная смертность значимо зависела от сроков беременности и веса плода: при весе менее 2 кг были потеряны 69% детей (27 из 39), в то время как при весе более 2 кг – только 18% (7 из 39). Перинатальная смертность составила 100% на сроках беременности меньше 32 недель, 70% – на 32–36-й неделе и лишь 20% – на более поздних сроках. При этом вероятность перинатальной смерти не был связана с уровнем спирохетемии у матери, хотя в среднем спирохетемия у беременных была значимо выше, чем у небеременных больных КВЛ. Материнская смертность в группах беременных и небеременных больных КВЛ была сопоставима: 1,5 и 1,7% соответственно. Смертность беременных, больных КВЛ, составляла около 4% от всей смертности беременных [59]; в соседнем районе Танзании эта доля достигала 8% [60].

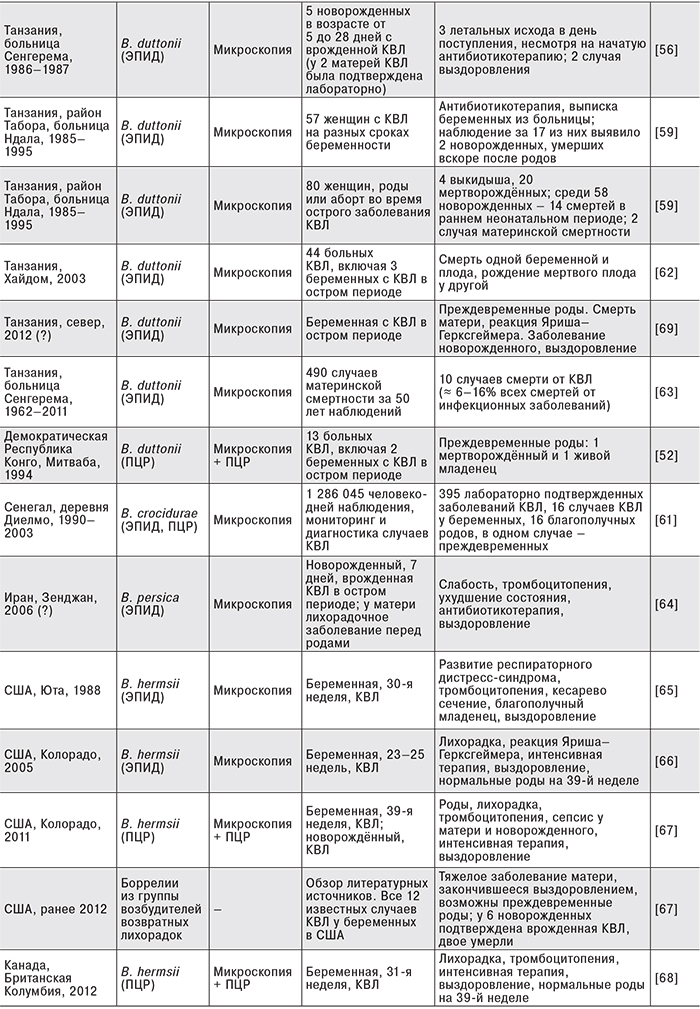
Результаты длительного, с 1990 по 2003 г., исследования в Сенегале, где КВЛ вызывается B. crocidurae, отчасти противоречат вышесказанному [61]. Наблюдения проводили в деревне Диелмо, где в среднем проживало около 330 человек, которых посещали ежедневно с целью выявления лихорадочных состояний и последующей лабораторной диагностики КВЛ. За 14 лет заболели КВЛ 236 человек, которые в сумме перенесли 395 независимых эпизодов КВЛ. Это соответствовало средней заболеваемости в 11 случаев на 100 жителей в год, что превышает заболеваемость любой из бактериальных инфекций в Сенегале. Аналогичные, хотя и менее точные оценки заболеваемости КВЛ были получены ранее в ходе исследований в северной Танзании [62]. В 121 случае наблюдалось от 1 до 6 рецидивов КВЛ, всего 208 рецидивов. Летальных исходов зарегистрировано не было; 16 матерей, перенесших КВЛ во время беременности, родили живых детей, хотя в одном случае наблюдались преждевременные роды. Авторы высказали предположение, что КВЛ, вызываемая B. crocidurae, протекает легче, чем КВЛ, вызываемая B. duttonii, при которой смертность составляет от 2 до 5%, и наблюдаются многочисленные патологии беременности [55, 62]. Однако возможно, что причиной является улучшение лечения КВЛ в Африке в 1980–2010 гг. Анализ отчетов за 1962–2011 гг. больницы Серенгема в Танзании, проведенный Р. Melkert и соавт. [63], показал, что из 490 зарегистрированных смертей женщин в перинатальном периоде, как минимум 10 были вызваны КВЛ. При этом вклад КВЛ в общую материнскую смертность составлял в 1962–1991 гг. около 5%, а в 1992–2011 гг. – менее 1%. Единичные наблюдения случаев КВЛ у матери или новорожденного, сделанные в США, Канаде и Иране в ХХ веке [64–68], показали, что, несмотря на жизнеугрожающее течение этого заболевания, в том числе с развитием острого респираторного дистресс-синдрома и тяжелейшей тромбоцитопении, своевременная диагностика и адекватная интенсивная терапия обеспечивают благополучный исход КВЛ. Очевидно, что бороться с основными причинами смерти при КВЛ – септическим состоянием с высокой спирохетемией и развитием органной недостаточности и реакцией Яриша–Герксгеймера (шоком, вызванным высвобождением пирогенов из бактерий под действием антибиотика) – легче в условиях отделения реанимации и интенсивной терапии современной больницы [59, 65–69].
Суммируя вышеизложенное, можно сделать несколько замечаний. КВЛ, несомненно, представляют угрозу здоровью матери и ребенка, хотя степень этой угрозы, зависящей и от социально-экономических условий, и от медико-биологических причин (показатель заболеваемости КВЛ; превалирующий на территории вид патогенной боррелии; уровень антиборрелиозного иммунитета у женщин детородного возраста; возможные различия в резистентности к КВЛ, связанные с этническим происхождением; особенности оказания медицинской помощи и т. д.) еще предстоит уточнить. Дизайн проведенных исследований не позволял проследить отдаленные последствия, например, влияние КВЛ, перенесенной в I триместре беременности, на исход родов и здоровье новорожденного, в том числе в долгосрочной перспективе. Однако возникает впечатление, что главный эффект КВЛ проявляется непосредственно в острый период инфекции и выражается в стимулировании выкидышей и (на более поздних стадиях беременности) начала родовых схваток. Чем больше срок беременности, тем выше вероятность преждевременных родов. Гибель плода или новорожденного может быть как следствием недоношенности неинфицированного плода, так и результатом внутриутробной инфекции. Неблагоприятный эффект КВЛ дозозависим, то есть он сильнее при высокой концентрации спирохет в крови.
Вероятность заболевания российских граждан КВЛ, переносимой «мягкими» клещами, невысока. Однако в условиях активизации туризма и внешнеэкономической деятельности они могут посещать эндемичные по КВЛ регионы – Среднюю Азию и Кавказ, Африку, США и Канаду, – и КВЛ должна рассматриваться в качестве возможного диагноза у лиц, возвращающихся из таких регионов. Кроме того, имеются публикации 50-х годов прошлого века о наличии клещей рода Ornithodoros и случаев КВЛ в Ставропольском и Краснодарском краях [70–72].
Важнее то, что совершенно неизвестна и заслуживает изучения способность боррелии B. miyamotoi, распространенной в большинстве российских регионов, вызывать патологию беременности и родов. Это исследование ИКБ-БМ у беременных может развиваться в России по двум направлениям. В одном варианте можно непосредственно выявлять трансплацентарные внутриутробные инфекции, приведшие к гибели плода на разных сроках беременности с помощью нескольких наборов для мультиплексной ПЦР, позволяющих детектировать ДНК или РНК основных возбудителей, ответственных за эту патологию [29–32], а также ДНК B. miyamotoi в тканях плода или в плаценте. Обнаружение ДНК B. miyamotoi в тканях плода однозначно подтвердит факт внутриутробной инфекции и позволит в дальнейшем изучить патогенез этого осложнения ИКБ-БМ. В другом варианте предполагается ретроспективное исследование матерей, проживающих в эндемичных по ИКБ-БМ регионах, у которых беременность закончилась неблагополучно по неустановленным причинам. Возможное определение у них серологическими методами специфических IgG- или даже IgM-антител к B. miyamotoi свидетельствовало бы о перенесенной ИКБ-БМ в анамнезе. Если доля серологически положительных женщин в этой группе окажется выше, чем среди благополучно родивших в это же время и в этом же месте женщин, это отразит вклад B. miyamotoi в патологию беременности и родов. Не исключено, что этот вклад окажется относительно невелик, поскольку, в отличие от классических африканских КВЛ, ИКБ-БМ не такое распространенное заболевание, и уровень спирохетемии при ИКБ-БМ ниже. Однако это позволит рекомендовать беременным в лихорадящем состоянии или после присасывания иксодового клеща обследование на инфекцию B. miyamotoi и тем самым предотвратить возможные осложнения.
* * *
Исследование выполнено за счет гранта Российского научного фонда (проект №15-15-00072).


