Интенсивное развитие высокотехнологичных, инвазивных методов диагностики и лечения в сочетании с широким распространением микроорганизмов с множественной лекарственной устойчивостью определяет необходимость непрерывного совершенствования систем надзора и контроля [1]. В соответствии с Национальной концепцией профилактики инфекций, связанных с оказанием медицинской помощи (ИСМП), проведение эпидемиологического надзора среди прочих мероприятий предусматривает осуществление микробиологического мониторинга за возбудителями ИСМП и определение спектра устойчивости микроорганизмов к антимикробным средствам (антибиотикам, антисептикам, дезинфектантам и др.) для разработки рациональной стратегии и тактики их применения [1].
Интенсивные разноплановые научные исследования эпидемиологии ИСМП привели к существенным изменениям в понимании причин их возникновения и закономерностей распространения. Доказаны ведущее значение лечебно-диагностического процесса в возникновении ИСМП и эндогенная природа различных инфекций, выявлены закономерности формирования госпитальных штаммов, определено значение иммунорезистентности пациентов [2–4].
Микроорганизмы, циркулирующие в медицинских организациях, существенно отличаются от внебольничных прежде всего резистентностью к применяемым антимикробным препаратам и дезинфицирующим средствам [5–7].
Проблема устойчивости микроорганизмов к дезинфицирующим средствам и антисептикам изучается уже на протяжении ряда лет [8–13]. Установлено наличие устойчивости к различным группам дезинфектантов у различных микроорганизмов [14–15]. Выбор тех или иных дезинфицирующих средств, технологий, режимов их применения определяется типом медицинского учреждения, эпидемической ситуацией [16]. В последние годы активно обсуждается возможность возникновения сочетанной резистентности к дезинфектантам и антибактериальным препаратам. Вероятно, возникновение сочетанной резистентности может быть объяснено сходством воздействия антибиотика и дезинфектанта на мишени микробной клетки. Наличие данных механизмов резистентности описано у S. aureus (ЧАС и β-лактамы), P. stutzeri (хлоргексидин и антибиотики), P. aeruginosa и E. coli (триклозан и антибиотики) [17–20].
Это определяет необходимость регулярного тестирования штаммов, длительно циркулирующих в стационарах, на чувствительность к дезинфектантам. Оценка устойчивости госпитальной микрофлоры к дезинфектантам должна быть составной частью общего микробиологического мониторинга, функционирующего в рамках производственного контроля, она является обязательной в соответствии с санитарными правилами и нормативами СанПиН 2.1.3.2630-10 «Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность» [21].
Цель исследования – определение устойчивости микрофлоры отделения хирургической реанимации к дезинфицирующим средствам.
Материалы и методы
Начиная с 2007 г. в рамках производственного контроля бактериологической лабораторией МБУЗ «Городская клиническая больница № 8» (Челябинск), имеющей лицензию на право работы с микроорганизмами 3–4-й групп патогенности, проводится анализ устойчивости ведущей микрофлоры к применяемым в больнице дезинфицирующим средствам. Анализ проводится в соответствии с руководством Р 4.2.2643-10 «Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности», утвержденным Главным государственным санитарным врачом Российской Федерации 1 июня 2010 г.
Нами проведен анализ устойчивости ведущей микрофлоры отделения хирургической реанимации к дезинфицирующим средствам за 6 лет (2007–2012 гг.).
Рассчитывались интенсивные показатели уровня заболеваемости ИСМП, экстенсивные показатели распределения структуры выделенных микроорганизмов, средняя ошибка показателя. Достоверность различий показателей оценивали с использованием критерия Стьюдента (t).
Результаты и обсуждение
За изучаемый период заболеваемость ИСМП в отделении хирургической реанимации составила 8,3 ± 1,6 случая на 1000 пролеченных. При бактериологическом исследовании 137 биологических субстратов у пациентов с установленным диагнозом ИСМП, культуры выделены в 130 (94,9%) случаях. Возбудители ИСМП представлены 11 микроорганизмами. В структуре микрофлоры преобладали грамотрицательные бактерии: Acinetobacter baumanni – 33,1% и Pseudomonas aeruginosa – 24,7% (рис. 1, см. на вклейке).
При проведении производственного контроля внешней среды отделения хирургической реанимации за указанной период были отобраны пробы с 8082 объектов. Микробная обсемененность составила 5,1 ± 2,6% (р < 0,05). Микробный пейзаж внешней среды характеризовался выраженным разнообразием (14 родов, 20 видов) с подавляющим преобладанием микроорганизмов рода Staphylococcus (32,2%; р < 0,05). Среди них доминировали Staphylococcus epidermidis – 59,1%. Из грамотрицательных микроорганизмов чаще всего встречались бактерии рода Pseudomonas – 14,6% (представлен P. аeruginosa) и рода Acinetobacter – 12,7% (представлен A. baumannii и A. lwoffi; р < 0,05).
За изучаемый период определена устойчивость к дезинфицирующим средствам 61 микроорганизма из отделения хирургической реанимации: 29 культур, выделенных от пациентов, 22 – с объектов больничной среды и 10 музейных штаммов. Среди культур, выделенных от пациентов, на долю Pseudomonas aeruginosa пришлось 31,2%, Acinetobacter baumannii – 24,1%, Klebsiella pneumoniae – 24,1%, Staphylococcus epidermidis – 6,9% (в том числе MRSE – 3,4%), Escherichia coli – 6,9%, Staphylococcus saprophyticus – 3,4%, Enterococcus spp. – 3,4% (р < 0,05). Среди культур, выделенных с объектов внешней среды, на долю Pseudomonas aeruginosa, Acinetobacter baumannii и Klebsiella pneumoniae пришлось по 22,7%, Staphylococcus epidermidis – 13,6% (в том числе MRSE – 4,5%), Staphylococcus aureus – 9,1% (в том числе MRSA – 9,1%), Escherichia coli и Enterococcus spp. – по 4,6% (р < 0,05). Среди музейных штаммов Pseudomonas aeruginosa составляли 60%, Escherichia coli – 30% и Staphylococcus aureus – 10% (р < 0,05). Устойчивость микроорганизмов определяли к 40 дезинфицирующим средствам, используемым в отделении хирургической реанимации. Устойчивость к средствам, содержащим четвертичные аммониевые соединения (ЧАС), определялась в 12% случаев, гуанидины – в 6%, амины – в 2%, хлоргексидин – 2%, спирты – 16%, хлор – в 10%, кислород – в 4%; к композитным средствам на основе ЧАС и альдегидов – в 10%, ЧАС и гуанидинов – в 4%, ЧАС и спиртов – в 2%, ЧАС и кислорода – в 4%, ЧАС и аминов – в 8%, спирта и кислорода – в 2%, спирта и фенола – в 2%; в средствах на основе спирта, гуанидинов и кислорода – в 2%; ЧАС, аминов и гуанидинов – в 8%; спирта, хлоргекидина и фенолов – в 2%; ЧАС, спиртов, аминов и гуанидинов – в 4% (р < 0,05).
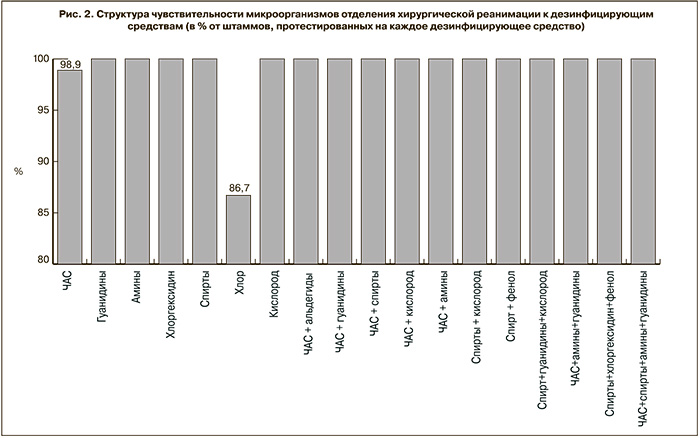
За период проведения анализа большинство культур проявляли чувствительность к дезинфектантам разных групп химических соединений в концентрациях, указанных производителем. Удельный вес штаммов с резистентностью к дезинфицирующим средствам составил от 1,1% (к дезинфектантам на основе ЧАС) до 13,3% (к хлорсодержащим дезинфектантам) (рис. 2).
В отношении хлорсодержащих дезинфицирующих средств установлено, что в большинстве случаев изученные культуры микроорганизмов проявляли чувствительность в концентрациях 0,06% и выше. При минимальных концентрациях 0,015%, рекомендованных производителями для проведения дезинфекции по бактерицидному и вирулицидному режимам, в 31,4% случаев культуры микроорганизмов оказались резистентными к дезинфектанту. Данный факт, на наш взгляд, свидетельствует о формировании госпитальных штаммов, устойчивых к хлорсодержащим препаратам.
Прослеживается определенная зависимость выраженности чувствительности к дезинфектантам от рода и вида микроорганизмов. В целом 82,3% штаммов были чувствительны к дезинфицирующим средствам в изучаемых режимах. Среди стафилококков полная чувствительность была отмечена у большинства изученных видов, в то же время дезинфектанты оказывали бактерицидное действие только на 75% штаммов S. аureus и 60% S. epidermidis. Среди представителей грамотрицательной микрофлоры наибольшая резистентность (20%) выявлена у Pseudomonas aeruginosa.
При анализе ситуации в динамике установлено, что в целом культуры, поступавшие на исследование из отделения хирургической реанимации, сохраняли чувствительность к дезинфектантам всех основных групп химических соединений. Однако в 2010 и 2012 гг. увеличилась частота встречаемости культур с резистентностью к дезинфектантам (рис. 3, см. на вклейке). В 2010 г. резистентными к хлорсодержащим дезинфицирующим средствам в минимальных концентрациях, рекомендованных производителем, оказались 10 выделенных микроорганизмов из 10 (2 от пациента и 8 с объектов больничной среды), в том числе 3 штамма Pseudomonas aeruginosa, 2 – Staphylococcus epidermidis, по 1 штамму Klebsiella pneumoniae, Acinetobacter baumannii, Staphylococcus aureus, Staphylococcus saprophyticus и Enterococcus spp. В 2012 г. из 16 выделенных культур 1 (выделенная от пациента Pseudomonas aeruginosa), оказалась устойчивой к дезинфицирующим средствам на основе ЧАС.
Таким образом, за 6 лет изучения устойчивости микрофлоры отделения хирургической реанимации к применяемым дезинфицирующим средствам в 0,3% cлучаев отмечена устойчивость микрофлоры к тем или иным группам дезинфицирующих средств, что делает необходимым проведение подобного анализа в отделениях высокого эпидемиологического риска не только в плановом порядке в рамках производственного контроля, но и по эпидемическим показаниям.
Выводы
Микрофлора внешней среды отделения хирургической реанимации характеризовалась выраженным разнообразием (14 родов, 20 видов) с подавляющим преобладанием бактерий рода Staphylococcus.
Удельный все штаммов микроорганизмов с резистентностью к дезинфицирующим средствам составил от 1,1 до 13,3%.
При минимальных концентрациях хлорсодержащих дезинфицирующих средств, рекомендованных производителями для проведения дезинфекции по бактерицидному и вирулицидному режимам, в 31,4% случаев культуры микроорганизмов оказались резистентными к дезинфектанту.
Отмечена зависимость выраженности резистентности к дезинфектантам различных микроорганизмов от 8,3% (Klebsiella pneumoniae, Acinetobacter baumannii) до 50% (Staphylococcus saprophyticus).
Учитывая динамику частоты резистентности микроорганизмов, в том числе музейных штаммов, к дезинфицирующим средствам, на наш взгляд, определение чувствительности микроорганизмов к дезинфектантам в разных концентрациях необходимо проводить при поступлении каждой новой партии дезинфицирующих средств.
Определение резистентности микроорганизмов к дезинфектантам в отделениях высокого эпидемиологического риска (учитывая возможность формирования госпитальных штаммов) необходимо проводить регулярно, с целью своевременной ротации дезинфицирующих средств.


