Средства химической дезинфекции позиционируются как средства неспецифической профилактики инфекционных болезней, эффективные в отношении любых микроорганизмов, которые могут использоваться во всех случаях, особенно в условиях отсутствия средств специфической профилактики. В связи с этим в последние годы к дезинфектантам проявляется повышенный интерес специалистов [1–6]. Наряду с изучением особенностей воздействия различных групп химических соединений на микробные клетки все чаще поднимаются вопросы, связанные с формированием устойчивости микроорганизмов к дезинфектантам [2, 6–14].
Экологическая пластичность, адаптационные способности лежат в основе формирования устойчивых вариантов микроорганизмов под действием селективного давления антибактериальных средств (АБС), включая антибиотики, антисептики (АС) и дезинфицирующие средства (ДС), что в свою очередь ведет к широкому распространению и циркуляции резистентных госпитальных эковаров [2–5, 14–16].
К настоящему времени накоплены научные данные о наиболее общих механизмах резистентности микроорганизмов к АБС, включающих: мутационную и плазмидную устойчивость, активное выведение АБС (эффлюкс), инактивацию веществ, механизмы снижения проницаемости внешних структур клетки, метаболическую и ферментную трансформацию, деградацию биоцидов, а также модификацию мишени действия АБС [2, 5–7, 9, 17, 18]. Тем не менее до сегодняшнего дня представления об устойчивости микроорганизмов к ДС существенно различаются и варьируют от полной расшифровки механизмов к некоторым ДС у отдельных бактерий до отсутствия какой-либо информации о процессах, лежащих в основе ее формирования. Довольно часто присутствует простая констатация факта существования устойчивости. К сожалению, достаточно распространена точка зрения об отсутствии устойчивости к ДС и самой возможности ее формирования вследствие особенностей повреждающего действия средств химической дезинфекции на микробные клетки.
Целью данной статьи является обобщение и систематизация данных разных исследователей и собственных результатов изучения устойчивости микроорганизмов к ДС, разработка классификации устойчивости.
Сообщения об устойчивости бактерий к биоцидам стали появляться с 1950-х годах, практически сразу же после начала применения в медицине катионных веществ [5]. Вопросы устойчивости микроорганизмов к ДС изучаются многими отечественными и зарубежными специалистами,
однако есть лишь единичные попытки систематизировать имеющиеся сведения. Так, существует классификация, предложенная G. McDonnel и A.D. Russel [1, 10], согласно которой выделяют следующие виды устойчивости в зависимости от механизмов ее формирования.
1. Внутренняя устойчивость (Intrinsic Bacterial Resistance Mechanism).
2. Приобретенная устойчивость (Acquired Bacterial Resistance Mechanism):
— опосредованная плазмидами (Plasmidmediated Resistance);
— мутационная (Mutational Resistance).
3. Физиологическая (фенотипическая) адаптация (Physiological (phenotypic) adaptation).
По мнению авторов, внутренняя устойчивость – это устойчивость, обусловленная строением наружной мембраны, клеточной стенки, цитоплазматической мембраны бактерий, присущая в большей степени грамотрицательным бактериям, спорам, микобактериям и связанная с естественными природными механизмами защиты микроорганизмов от неблагоприятных химических воздействий.
Приобретенная устойчивость к ДС определяется как связанная с мутациями или переносом генетического материала с помощью плазмид и транспозонов, вследствие чего появляется генетически закрепленная устойчивость.
Физиологическая (фенотипическая) адаптация описывается как устойчивость, связанная с образованием бактериями биопленок и снижением поступления ДС к клеткам через матрикс.
Экспертами Научного комитета по возникающим и вновь определенным рискам для здоровья (Scientific Committee on Emerging and Newly Identified Health Risks – SCENIHR) в 2009 г. были обобщены имеющиеся сведения об устойчивости микроорганизмов к биоцидам и выделены следующие механизмы устойчивости [5]:
Проницаемость – Permeability.
Эффлюкс – Efflux.
Деградация – Degradation.
Мутации – Mutation (target site).
Фенотипические изменения – Phenotypic change.
Индукция – Induction (stress response).
Механизм нарушения проницаемости, эффлюкс и деградация могут обусловливать формирование резистентных штаммов микроорганизмов вследствие как природной, так и приобретенной устойчивости. При этом отмечается, что в первых двух случаях может возникать перекрестная резистентность к различным биоцидам. Мутации лежат в основе приобретенной устойчивости и, как правило, не приводят к развитию перекрестной резистентности. Фенотипические изменения и индукция – ответ на стресс, обусловленный предшествующим воздействием на микроорганизмы биоцидов.
Необходимо отметить, что указанные работы – едва ли не единственные, где предприняты попытки систематизировать имеющиеся сведения об устойчивости бактерий к ДС. В целом исследования, посвященные изучению этой проблемы, носят разрозненный, выборочный, несистемный характер. Отдельные исследования раскрывают глубинные механизмы формирования устойчивости на генетическом уровне, но, как правило, они затрагивают лишь небольшой фрагмент данной проблемы, а единая общепринятая классификация устойчивости микроорганизмов к ДС отсутствует.
Используя многочисленные данные зарубежных и отечественных ученых, а также собственные результаты, мы предприняли попытку классификации устойчивости микроорганизмов к ДС (рис. 1).
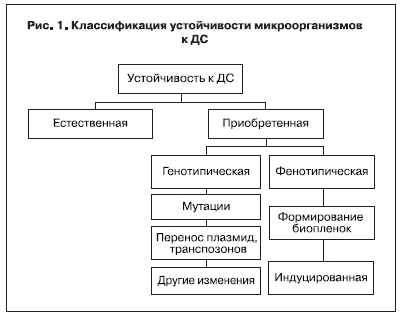
На основании классификационного признака «наличие или отсутствие исходной (природной)
устойчивости к ДС» можно выделить следующие виды устойчивости.
1. Естественная (имеется исходная/природная устойчивость к ДС).
2. Приобретенная (отсутствует исходная/природная устойчивость к ДС).
Естественная устойчивость микроорганизмов к ДС (соответствует зарубежным представлениям о
внутренней устойчивости – Intrinsic, innate resistance) – генетически закрепленное свойство микроорганизмов, относящихся к одному таксону, проявляющееся в устойчивости (сниженной чувствительности, нечувствительности) микроорганизмов к воздействию некоторых ДС. Является «врожденным» свойством микроорганизмов и характерна для всех представителей данного семейства, рода, вида.
Известно, что устойчивость различных видов микроорганизмов к ДС существенно варьирует, что связано со строением и функционированием клеток, благодаря чему микроорганизмы по-разному взаимодействуют с различными антимикробными веществами и обладают неодинаковой устойчивостью к воздействию химических соединений разных классов [1, 7, 10, 18–20]. Природная устойчивость, в основе которой, по мнению ряда исследователей, лежат внутренние механизмы, является естественным, хромосомно-контролируемым свойством бактериальных клеток, что позволяет им «ускользать» от действия ДС или АС [10]. Природная устойчивость микроорганизмов к ДС обусловлена прежде всего строением внешних структур клетки (наружная мембрана, клеточная стенка, цитоплазматическая мембрана), которые обеспечивают избирательное проникновение веществ и снижение поступления ДС внутрь клетки [6, 21]. Кроме того, природная устойчивость может быть связана с конститутивной выработкой микроорганизмами ферментов, вызывающих трансформацию и/или деградацию ДС [5, 17, 22], эффлюксом, модификацией мишени действия ДС [5].
Приобретенная устойчивость микроорганизмов к ДС (Acquired Resistance) – адаптация микроорганизмов к воздействию ДС, характеризующаяся формированием устойчивости к бактерицидным концентрациям одного или нескольких ДС, к которым отсутствует исходная (природная) устойчивость.
Базовым признаком, заложенным в основу классификации приобретенной устойчивости, являются механизмы ее формирования, в зависимости от которых можно выделить:
1. Генотипическую устойчивость, обусловленную:
— мутациями;
— переносом плазмид и транспозонов;
— другими изменениями хромосомной и внехромосомной ДНК.
2. Фенотипическую устойчивость:
— формирование биопленок;
— индуцированную устойчивость.
Приобретенная генотипическая устойчивость микроорганизмов к ДС – генетически закрепленная устойчивость, сформировавшаяся под влиянием ДС в результате изменений хромосомной и внехромосомной ДНК микроорганизмов.
Генотипическая устойчивость может быть связана с различными изменениями хромосомной или внехромосомной ДНК в результате мутаций или получения плазмид, транспозонов [10]. В зарубежной литературе существуют эквивалентные понятия устойчивости, обусловленной (опосредованной) плазмидами или перемещением (переносом генетического материала) – Plasmid-mediated resistance или Transferable biocide resistance. Молекулярно-генетические методы исследований позволили выявить и изучить генетическое разнообразие и распространенность генов устойчивости к АБС, таких как
qacA, qacB, qacC, qacG, qacH, qacJ, smr у S. aureus [13, 23–26], MexAB-OprM, MexCD-OprJ, MexEFOprN,
MexJK у P. aeruginosa [27, 28], AcrAB-TolC, AcrEF-TolC, EmrE у E.coli [11, 29]. Однако вклад этих генов, кодирующих эффлюкс (активное выведение веществ из клетки), в формирование устойчивости к ДС весьма скромен, поскольку их экспрессия приводит к увеличению МИК некоторых дезинфектантов (на основе ЧАС), но не к резистентности к высоким (рабочим) концентрациям.
Приобретенная фенотипическая устойчивость микроорганизмов к ДС – устойчивость, формирующаяся в результате воздействия дезинфектантов, не закрепленная генетически.
Необходимо отметить, что феномен приобретенной фенотипической устойчивости на данный момент изучен недостаточно, в связи с чем нельзя с полной уверенностью говорить о такой устойчивости исключительно как о внешнем (фенотипическом) проявлении адаптации. Вопрос о механизмах такой устойчивости и возможности ее закрепления на генетическом уровне остается открытым и требует углубленного исследования.
Одним из механизмов формирования приобретенной фенотипической устойчивости бактерий к ДС является образование биопленок. Многие исследователи отмечают, что микроорганизмы в составе биопленок значительно менее чувствительны к воздействию ДС по сравнению с планктонными клетками этих же видов, однако бактерии, изолированные из биопленки и выращенные на питательных средах, как правило, не более устойчивы, чем планктонные клетки этого вида [1, 8, 15, 16, 30–36]. Этот феномен в зарубежной литературе назван физиологической/фенотипической адаптацией микроорганизмов – Physiological (phenotypic) adaptation [10]. С нашей точки зрения, этот термин не вполне удачен, так как формирование устойчивости микроорганизмов к ДС вообще является приспособительной, адаптационной реакцией, затрагивающей физиологические процессы клетки, и не может быть связано только с образованием биопленок.
Описано несколько причин пониженной чувствительности бактерий в биопленках: 1) снижение доступа ДС через матрикс к клеткам внутри биопленки; 2) изменение/снижение метаболической активности; 3) собственно химическое взаимодействие между ДС и биопленкой; 4) модификация микроокружения; 5) продукция деградационных ферментов (и нейтрализация химических веществ); 6) генетический обмен между клетками в биопленке [8, 16, 33, 34, 36].
Индуцированная устойчивость микроорганизмов к ДС – устойчивость, формирующаяся в результате воздействия ДС, характеризующаяся адаптацией микроорганизмов, сопровождающейся фенотипическими изменениями клеток.
В зарубежной литературе такую устойчивость иногда называют адаптивной – Adaptive resistance
[37, 38], что, с нашей точки зрения, не совсем верно в соответствии с ранее приведенными
аргументами. Многие исследователи обращают внимание на то, что в большинстве случаев устойчивость микроорганизмов к биоцидам возникает как результат неправильного применения
(занижение концентраций) или хранения последних (снижение биоцидной активности) [5]. В целом ряде публикаций отмечается, что рост резистентности происходит за счет селекции
устойчивых вариантов под действием низких концентраций биоцидов [14, 27, 28, 39, 40]. Собственные исследования показали возможность выработки индуцированной устойчивости тест-штаммами микроорганизмов в лабораторных условиях в результате систематического воздействия ДС в заниженных (суббактерицидных) концентрациях [41, 42]. Формирование устойчивости сопровождалось выраженными фенотипическими изменениями, затрагивающими прежде всего клеточную стенку и цитоплазматическую мембрану бактериальных клеток. Это согласуется с данными некоторых исследователей, которые также указывают на изменения поверхностных структур клетки
под действием ДС (bleb formation) [43]. Таким образом, можно говорить об устойчивости, формирующейся в результате воздействия ДС на микроорганизмы, как об индуцированной
устойчивости, т.е. спровоцированной самими дезинфектантами.
Закономерно, что устойчивость к ДС должна рассматриваться в комплексе с устойчивостью к другим АБС.
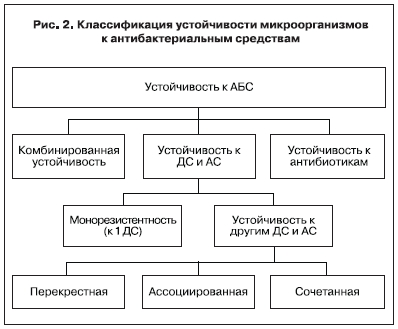
Другим признаком, положенным в основу классификации устойчивости микроорганизмов к ДС, является наличие одновременной резистентности к ДС и другим АБС (рис. 2). Исходя из наличия/отсутствия устойчивости к другим АБС можно выделить:
1. Устойчивость к одному ДС (монорезистент-
ность).
2. Устойчивость к другим ДС и АС:
— перекрестную;
– ассоциированную;
— сочетанную.
3. Комбинированную устойчивость.
Перекрестная устойчивость микроорганизмов к ДС – устойчивость к различным дезинфектантам, относящимся к одной группе химических соединений на основе одного активнодействующего вещества (АДВ). Так, например, микроорганизмы могут быть одновременно устойчивы к ДС разных наименований, созданных на основе одного и того же химического соединения.
В литературе перекрестной часто называют одновременную устойчивость к антибиотикам и дезинфектантам (cross-resistance). При описании антибиотикорезистентности перекрестной
называется резистентность микроорганизмов к антимикробным препаратам одной химической
группы. Поэтому во избежание путаницы термин «перекрестная устойчивость» по отношению к ДС предложен по аналогии с антибиотикорезистентностью.
Ассоциированная устойчивость микроорганизмов к ДС – устойчивость к ДС, относящимся к разным
группам химических соединений по АДВ. На практике приходится сталкиваться с ситуацией, когда микроорганизм, устойчивый к какомулибо дезинфектанту из одной группы соединений, оказывается нечувствителен к одному или нескольким веществам, созданным на основе других АДВ. Например, сочетанная устойчивость к ЧАС и кислородсодержащим ДС или альдегидам и гуанидинам и т.п.
Сочетанная устойчивость микроорганизмов к ДС – устойчивость к двум и более ДС из одной группы
химических соединений, но с различными АДВ (например, устойчивость к хлорсодержащим ДС на основе гидантоинов и изоциануратов).
Комбинированная устойчивость микроорганизмов – одновременная устойчивость к ДС и антиби-
отикам.
В литературе этот вид устойчивости часто называется перекрестной резистентностью (cross-resistance), однако предложенный термин «комбинированная устойчивость» нам представляется более приемлемым.
Еще в середине ХХ века было высказано предположение, которое и сегодня поддерживается
рядом исследователей, о том, что нечувствительные к антибиотикам бактерии способны также проявлять перекрестную устойчивость по отношению к антисептикам и/или дезинфицирующим средствам [1, 12, 44–48]. Известны отдельные исследования, посвященные изучению перекрестной устойчивости, касающиеся, прежде всего сравнения устойчивости метициллиночувствительных (MSSA) и метициллинорезистентных штаммов золотистого стафилококка (MRSA). Так, некоторые исследователи
указывают на большую устойчивость MRSA к отдельным ДС (хлоргексидину, ЧАС) по сравнению с MSSA [24, 46, 49]. Однако эти же авторы отмечают отсутствие перекрестной метициллинорезистентности стафилококков и устойчивости по отношению к другим группам ДС [24]. В различных исследованиях было показано, что среди MRSA и VISA, устойчивых к ЧАС, отмечается высокая частота носительства генов qacA, qacB; значительно реже встречаются гены qacC, qacH и smr; а qacG, qacH, qacJ не обнаружены [13, 24]. Установлено, что qacA/B – наболее важный ген, отвечающий за резистентность MRSA к антисептикам и красителям (акрифлавин, акринол, бензалкониум хлорид, бензетониум хлорид,
хлоргексидин диглюконат, алкилдиаминэтилглицина гидрохлорид) [25].
Что касается других госпитальных штаммов микроорганизмов, не относящихся к метициллинорезистентным стафилококкам, показано, что антибиотикорезистентные микроорганизмы
подвержены воздействию ДС в той же степени, что и чувствительные к антибиотикам штаммы
[1, 12, 45].
Таким образом, представлена классификация устойчивости к дезинфектантам и другим антибактериальным средствам с учетом результатов отечественных и зарубежных исследователей, а
также собственных данных.
Предпринята попытка согласовать терминологию, применяемую в отношении устойчивости к антибактериальным средствам, принятую в отечественной и зарубежной практике.
Не претендуя на окончательное и неоспоримое мнение, авторы статьи предлагают широкое конструктивное обсуждение проблемы.


