Хронический гепатит С (ХГС) занимает одно из ведущих мест в структуре инфекционной патологии. В мире сложилась неблагоприятная эпидемическая ситуация, связанная с неуклонным ростом заболеваемости ХГС во всех возрастных группах.
Благодаря тому что за последнее время значительно расширились знания о патогенезе гепатита С, совершенствуется и терапия этого заболевания. В настоящее время установлены различные факторы, позволяющие прогнозировать ответ на противовирусную терапию (ПВТ), возможные исходы при естественном течении болезни, что, безусловно, расширяет возможности успешного проведения лечения. Это связано в первую очередь с огромным накопленным опытом в применении комбинированной ПВТ. В Российских многоцентровых клинических исследованиях при использовании пегилированного интерферона альфа-2а (ИФН-α-2а) в дозе 180 мкг в неделю в комбинации с рибавирином в дозе, подобранной из расчета на 1 кг массы тела больного (800–1200 мг/сутки), частота успешного лечения с развитием стойкого вирусологического ответа составила 80,1% у пациентов с генотипами 2 и 3 и 55,9% у пациентов с генотипом 1 [1].
Успех лечения ХГС напрямую зависит от скорости снижения вирусной нагрузки до неопределяемого современными методами диагностики уровня. Для поддержания супрессии вирусной репликации требуется длительная комбинированная ПВТ ИФН-α и рибавирином. Ключевым фактором лечения является поддержание запланированного врачом режима дозирования и кратности приема препаратов. Однако существует очень важная проблема, связанная с тем, что комбинированная терапия ХГС имеет целый ряд значимых нежелательных явлений, напрямую связанных как с ИФН, так и с рибавирином. Эти изменения в ряде случаев требуют снижения дозы препарата, его временной отмены или отмены вообще, что обуславливает неэффективность ПВТ [1–3].
К наиболее частым и значимым среди гематологических нарушений при применении различных форм ИФН можно отнести развитие лейкопении со снижением количества нейтрофилов и лимфоцитов [4]. Лейкопения является характерным проявлением ПВТ, появляется уже на ранних сроках ее проведения и наблюдается на всем протяжении лечения вплоть до его окончания. Далеко не всегда можно точно предугадать развитие глубокой лейко/нейтропении у конкретного пациента. Это заставляет врача постоянно контролировать формулу крови. Необходимо отметить, что это нарушение является обратимым и после завершения полного курса лечения число нейтрофилов и лимфоцитов возвращается к исходному уровню в течение 4–24 нед [5].
Традиционной тактикой лечащего врача в подобных случаях является коррекция используемой дозы ИФН. В настоящее время разработаны четкие рекомендации по ведению больных ХГС с лейкопенией, включающие уменьшение дозы ИФН в 2 раза при снижении уровня лейкоцитов ниже 1,5x109/л или уровня гранулоцитов ниже 0,75x109/л с контролем анализа крови через 1 нед. Если указанные изменения сохраняются или уровень лейкоцитов ниже 1,0x109/л и гранулоцитов ниже 0,5x109/л, то ИФН рекомендуется отменить [1].
Именно эти обстоятельства послужили поводом к поиску препаратов, способных корригировать основные, наиболее выраженные нежелательные явления. С начала 90-х годов накоплен достаточно большой опыт применения препаратов для профилактики и лечения лейкопении различного происхождения. В основном их назначают при онкогематологических заболеваниях для коррекции токсичности цитостатических препаратов [3]. Среди лекарственных препаратов применяются искусственно синтезированные миелоидные факторы роста: гранулоцитарный колониестимулирующий фактор человека (Г-КСФ), включающий 2 типа препаратов рекомбинантного человеческого Г-КСФ – гликозилированный и негликозилированный, и гранулоцитарно-макрофагальный фактор роста (ГМ-КСФ) [6]. Рекомбинантные цитокины достаточно дороги, поэтому очень важно иметь четкие критерии для их назначения.
Наряду с зарубежными препаратами в терапии интерферон-индуцированной лейкопении широкое применение получил новый отечественный лекарственный препарат аллокин-альфа (регистрационное удостоверение № 002829/01 от 22.09.03 г.), представляющий собой синтетический линейный цитокиноподобный олигопептид с мол. массой 1265 дальтон и состоящий из 13L-аминокислот, действующим веществом которого является аллоферон.
Эффективность препарата изучали в нескольких крупных рандомизированных исследованиях при различных инфекционных заболеваниях, включая гепатиты В и С [2, 3, 5, 7–9]. Исследования показали, что аллокин-альфа оказывает стимулирующее влияние на лейкопоэз, повышая уровень лейкоцитов крови у больных ХГС, герпесом и другими вирусными инфекциями [10]. В проведенных ранее работах установлено, что аллокин-альфа оказывает влияние на факторы естественного иммунитета (систему ИФН, естественные киллеры), стимулирует фагоцитоз, обладает антивирусной активностью [10], это приводит к компенсации проявлений вторичной иммунной недостаточности и ликвидации дисбаланса компонентов систем иммунореактивности при воздействии вируса гепатита С (НСV).
Цель настоящего исследования – определить возможности коррекции лейкопении препаратом аллокин-альфа у больных ХГС, получающих комбинированную ПВТ.
Материалы и методы
В исследовании приняли участие 65 пациентов в возрасте от 18 до 36 лет с ХГС и лейкопенией, развившейся на фоне приема комбинированной терапии пегилированным ИФН-α-2а и рибавирином. Диагноз был поставлен согласно методическим рекомендациям Российского Консенсуса по гепатиту С [5] на основании анамнеза, клинической картины заболевания и подтверждающих лабораторных тестов с выявлением РНК НСV, anti-HCV. Критерием исключения являлись коинфицирование с вирусами гепатитов В, D, G, TTV и ВИЧ, а также соматические заболевания.
Среди пациентов было 52 мужчины и 13 женщин. Достоверной взаимосвязи между генотипом HCV и исходными уровнями лейкоцитов, биохимических показателей крови у мужчин и женщин не выявлено.
Заболевание протекало традиционно, клинические характеристики больных согласовалось с характеристиками, представленными в работах других авторов [1, 3].
Все пациенты получали комбинированную ПВТ пегелированным ИФН-α-2а в дозе 180 мкг/сутки и рибавирином из расчета 1,5 мг на 1 кг массы тела.
У всех пациентов к 3-му месяцу терапии развилась интерферон-индуцированная лейкопения. Больные были разделены на 2 группы: в 1-й пациенты получали стандартную ПВТ и аллокин-альфа, во 2-й – только стандартную терапию.
Для коррекции развившейся интерферон-индуцированной лейкопении пациенты 1-й группы получали 18 инъекций аллокина-альфа подкожно тремя последовательными курсами (по 6 инъекций на курс) по 1,0 мг 3 раза в неделю в течение 2 нед с перерывом между курсами в 1 нед. Препарат назначали после 12-й недели комбинированной терапии. Уровень лейкоцитов и другие лабораторные показатели оценивали до назначения аллокина-альфа и через 3 нед после каждого курса. Критерием эффективности действия препарата являлась динамика показателей лейкопении, цитолиза, маркера вирусной репликации – РНК НСV.
Выявление РНК НСV и определение его количественного содержания проводили методом ПЦР в режиме реального времени с использованием тест-систем ЗАО «ДНК-технологии». Диагностический порог чувствительности метода составил 200 МЕ/мл. При оценке динамики уровня вирусной нагрузки для удобства оценки эффективности проводимой терапии интегральная шкала количественной оценки ПЦР (ME/мл) была заменена на логарифмическую (log/ml). Положительный эффект определялся снижением вирусной нагрузки на 2 log и более. Выявление анти-HCV проводили на закрытом анализаторе Architect («Abbott», США). Определение биохимических показателей крови осуществляли на аппарате Olympus AU-60 («Beckman Coulter», США). Определение формулы крови проводили на аппарате Sysmex XE 2100.
Срок наблюдения за пациентами включал весь период терапии. Полученные результаты подвергнуты статистической обработке методами вариационного анализа статистической программой «Stadia». Различия между сравниваемыми величинами признавались статистически достоверными при p<0,05.
Результаты и обсуждение
У всех пациентов до начала ПВТ отмечались классические лабораторные признаки ХГС: повышение уровня АЛТ, выявление РНК НСV. При этом определялся нормальный уровень лейкоцитов периферической крови. Динамика основных биохимических показателей, РНК НСV и лейкоцитов периферической крови у больных ХГС представлена в таблице.
Примечание. РБВ – рибавирин; * р<0,05.
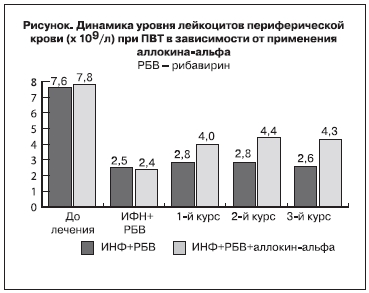
При анализе результатов, полученных на 12-й неделе после начала лечения, выявлено, что у всех пациентов независимо от генотипа НСV и достижения быстрого и раннего вирусологического ответов отмечалось достоверное (р<0,05) снижение количества лейкоцитов в крови до 2,4±0,41х109/л в 1-й и до 2,5±0,43х109/л во 2-й группе по сравнению с этими показателями до лечения.
90% пациентов обеих групп достигли вирусологического ответа к 12-й неделе наблюдения, при этом уровень АЛТ достоверно снизился до 55±11ЕД/л в 1-й группе и до 61±15 ЕД/л во 2-й. Схожая динамика наблюдалась и в снижении вирусной нагрузки в обеих группах более чем на 2 log (4,1±1,7 log и 4,3±1,4 log соответственно).
Как видно из таблицы, достоверной разницы в динамике уровня АЛТ и вирусной нагрузки в исследуемых группах на всем протяжении терапии обнаружено не было.
Последующие наблюдения выявили стабильное снижение количества лейкоцитов в периферической крови у пациентов 2-й группы на всем протяжении терапии, в то время как у пациентов 1-й группы отмечался достоверный стойкий подъем уровня лейкоцитов после назначения аллокина-альфа (см. рисунок). Однако следует заметить, что не все пациенты 1-й группы, получавшие препарат, ответили повышением уровня лейкоцитов в крови. В нашем исследовании статистически значимое увеличение было достигнуто только у 75% пациентов.
Терапия ХГС представляет достаточно сложную задачу. Возможность быстрой элиминации вируса и достижение устойчивого вирусологического ответа можно считать основными ее задачами. В то же время возникающие нежелательные явления, такие как интерферон-индуцированная лейкопения, могут в значительной степени повлиять на возможность продолжения лечения. Таким образом, в сферу интересов врача попадают препараты, оказывающие одновременно стимулирующее действие на пролиферацию лейкоцитов и избирательное действие на механизмы регуляции противовирусного ответа, тем самым предотвращая развитие вторичной иммунной недостаточности и ликвидируя дисбаланс компонентов систем иммуноре активности.
Сегодня большое внимание обращено на биологически активные пептиды, среди которых особое место занимает препарат аллокин-альфа.
Проведенные клинические исследования показали, что применение аллокина-альфа при стандартной ПВТ ХГС приводит к устранению интерферон-индуцированной лейкопении у 75% пациентов. На практике это позволяет провести большинству пациентов весь курс ПВТ без снижения дозы ИФН.
Точные механизмы стимуляции роста количества лейкоцитов при применении аллокина-альфа до конца не ясны.
Регуляция работы костного мозга осуществляется группой гемопоэтических цитокинов. В зависимости от характера влияния на костный мозг гемопоэтины условно разделяют на позитивные и негативные регуляторы гемопоэза. К позитивным регуляторам относятся факторы, которые поддерживают пролиферацию полипотентной стволовой клетки (PPSC), миелоидных, эритроидных и лимфоидных предшественников, стимулируя соответствующие ростки кроветворения. Это прежде всего различные колониестимулирующие факторы (CSF), эритропоэтин (EPO), цитокины IL-1, IL-3, IL-6, IL-11 и т.д. [11]. Другие цитокины, такие как TNF, IFN, трансформирующий фактор роста (TGF), напротив, могут снижать клоногенность всех типов предшественников гемопоэтических клеток, способны подавлять эритро-, моно- и гранулопоэз и относятся к негативным регуляторам гемопоэза [12, 13].
Основными клетками-продуцентами цитокинов являются Т-хелперы и макрофаги, которые выполняют главные функции в поддержке приобретенного и врожденного иммунитета. Т-хелперы 1-го типа (Tх1) продуцируют IL-2 и INF-γ, тогда как Т-хелперы 2-го типа (Tх2) – IL-4, IL-5, IL-6, IL-9, IL-10 и IL-13. Tх1 осуществляет хелперную функцию в формировании клеточного иммунитета, а Tх2 – гуморального. Нарушение баланса цитокинпродуцирующей активности Тх1 и Tx2 играет значительную роль в развитии аутоиммунных состояний, хронизации, прогрессировании инфекционных заболеваний. Антигенная стимуляция белками НСV приводит к переключению защитного клеточного иммунитета на гуморальный с развитием дисбаланса цитокиновой регуляции Т-хелперов (Tх2>Tх1), поликлональной активацией гуморального звена иммунитета и механизмов аутосенсибилизации, развитием депрессии клеточного звена иммунитета [10, 14].
Наряду с развитием вирусопосредованной лейкопении во время лечения ХГС на костный мозг оказывают влияние и препараты ИФН-α, которые в высоких дозах являются негативными регуляторами гемопоэза, обладают выраженной миелотоксичностью и способны напрямую подавлять лейкопоэз.
Известно, что введение аллокина-альфа вызывает усиление продукции цитокинов, способствующих формированию преимущественно Тх1-иммунного ответа, который имеет решающее значение в санации организма от вирусных инфекций [11]. Вероятно, этот препарат, в отличие от известных индукторов ИФН, активируя Т-хелперы, является также кофактором активации ранних гемопоэтических ростовых факторов [колониестимулирующего и гранулоцитарного колониести мулирующего (Г-КСФ)] и поздних специфических ростовых факторов [макрофагального колониестимулирующего (М-КСФ)] [8, 12]. Активированные Т-хелперы вырабатывают IL-3, который в свою очередь стимулирует пролиферацию и дифференцировку промежуточных клеток-предшественников, а также дифференцировку поздних клеток-предшественников в мегакариоциты, гранулоциты, моноциты и эритроциты. IL-3 действует как неспецифический гемопоэтин, стимулирующий образование колоний не только нейтрофилов и макрофагов, но и мегакариоцитов, эритроидных и тучных клеток. Таким образом, IL-3 действует не только на предшественников всех клеток крови, но и на зрелые клетки. Вероятно, именно через эти механизмы аллокин-альфа влияет на лейкопоэз.
В проведенном исследовании мы не выявили достоверного влияния аллокина-альфа на вирусную нагрузку и достижение устойчивого вирусологического ответа. Однако опубликованные ранее материалы о результатах влияния препарата на интерфероновый статус, цитокиновый профиль и экспрессию цитокиновых генов [6] позволяют предположить, что полученные нами результаты требуют бoльшей выборки пациентов, у которых он применяется, и ретроспективной оценки его влияния на эффективность проводимой ПВТ.


