Туберкулез с давних времен привлекает к себе внимание ученых. Большая часть открытий в области диагностики и новых методов лечения заболевания приходится на конец XIX в.
Середина XX в. была ознаменована открытием лекарственных средств для лечения туберкулезной инфекции. До этого времени осуществлялось лишь санаторное лечение больных туберкулезом, включавшее покой, свежий воздух и усиленное питание. Несмотря на получение определенного эффекта от такого лечения, долгосрочные результаты были неутешительными. Более 60% выписанных больных умирали от туберкулеза в течение 6 лет [1–5].
Несколько улучшило результаты лечения туберкулеза внедрение в практику хирургических методов, таких как искусственный пневмоторакс и торакопластика, вызывающих коллапс пораженных сегментов легкого [6,7].
Однако настоящий прорыв произошел в 1944 г. после открытия стрептомицина учеными З.А. Ваксманом и А. Шатсом, которые выделили Streptomyces griseous и получили мощный противотуберкулезный антибиотик. С открытия стрептомицина берет начало эра противотуберкулезной химиотерапия, за что З. Ваксману в 1952 г. была присуждена Нобелевская премия. Внедрение этого препарата во фтизиатрическую практику позволило добиться существенных успехов в снижении смертности от туберкулеза, которая снизилась в 6,5, а в отдельных районах – в 10 раз [8].
Позднее были проведены исследования химиотерапии комбинацией стрептомицина и аминосалициловой кислоты (ПАСК), на примере которых доказали, что терапия несколькими препаратами является предупреждением развития лекарственной устойчивости туберкулеза и эффективно излечивает его [2].
Затем в практику были внедрены новые для того времени противотуберкулезные препараты (ПТП), такие как изониазид (H), пиразинамид (Z), циклосерин (Cs), этионамид (Eto), канамицин (Km), капреомицин (Cm), рифампицин (R), этамбутол (E) [2, 7]. В конце 1980-х годов были созданы антибиотики группы фторхинолонов, часть из которых проявила активность в отношении микобактерий туберкулеза (МБТ) [9]. Однако надежды на полную победу над туберкулезом не увенчались успехом, а проблема повышения эффективности лечения заболевания во всем мире стоит остро и в настоящее время [2, 3, 5].
В свете нарастающей распространенности туберкулёза с лекарственной устойчивостью возбудителя особое значение приобретает лечение туберкулеза легких с сохраненной лекарственной чувствительностью возбудителя, организация качественной диагностики и лечения, которые бы способствовали предотвращению развития лекарственной устойчивости МБТ.
До настоящего времени показатель прекращения бактериовыделения у впервые выявленных больных туберкулезом легких в целом не достигает по стране 75,0%, а клиническое излечение констатируют только у 30,0–32,0% больных [10, 11].
Наиболее частыми причинами низкой эффективности терапии являются: отсутствие выявления возбудителя (60%) [11], что важно для верификации диагноза и определения спектра лекарственной устойчивости МБТ; большое число нежелательный явлений (НЯ) на фоне химиотерапии, которые приводят к отмене терапии; рост коморбидности: сегодня каждый 2-й пациент имеет от 2 до 3 заболеваний; отсутствие приверженности к лечению у больных туберкулезом и недостаточное число новых ПТП [12]. Это основные факторы, которые сильно затрудняет подбор терапии и проведение качественного лечения.
Представляем клинический пример.
Больная К., 42 года, проходила стационарное лечение в ФГБУ «Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии» Минздрава России с 15.10.13 по 14.05.2014.
Поступила с диагнозом «двусторонний фиброзно-кавернозный туберкулез легких в фазе инфильтрации и обсеменения. Разрушено левое легкое. МБТ (+). ШЛУ МБТ (S, H, R, E, K, Pa, Ofl, Cap)».
Из анамнеза: на момент обращения в стационар больна туберкулезом 15 лет. Туберкулезный контакт не установлен. Заболевание выявлено при обращении в противотуберкулезный диспансер в 1998 г. Социально благополучна, до болезни длительное время работала массажистом. Мотивация к излечению высокая.
Получала терапию по I режиму по поводу инфильтративного туберкулеза верхней доли левого легкого. Терапия была отменена в связи с тяжелой переносимостью лечения, ввиду чего курс терапии был нерегулярным. В период с 2005 по 2012 г. в динамике отмечается прогрессирование заболевания с возобновлением бактериовыделения и формированием двустороннего фиброзно-кавернозного туберкулеза легких с широкой лекарственной устойчивостью возбудителя [13].
И такие примеры, к сожалению, нередки.
Существенным фактом в получении низкой эффективности лечения туберкулеза является большое число препаратов, которые вынуждены принимать пациенты. Это часто пугает их и создает психологические трудности при приеме терапии, а значит не способствует формированию приверженности к лечению. Кроме того, часто отсутствует возможность контроля за проведением полихимиотерапии, что также является одним из ключевых моментов, приводящих к отсутствию ожидаемого эффекта от лечения.
У больных с плохой переносимостью ПТП вследствие трудностей проведения адекватного лечения развитие НЯ на 21,7% снижает частоту закрытия полостей распада в легочной ткани и на 22,4% – частоту прекращения бактериовыделения у впервые выявленных больных (р < 0,001). Согласно литературным данным, наличие НЯ ассоциируется с двукратным повышением риска неэффективности 6-месячных курсов химиотерапии (ОШ 1,89; 95% ДИ 1,3–3,0). В ретроспективном исследовании, проведенном Г.Ю. Марфиной и соавт. [13], прерывание интенсивной фазы химиотерапии из-за непереносимости повышало риск смертельного исхода (ОР 3,20, p = 0,001). Было показано, что развитие НЯ не только приводит к значимому продлению сроков госпитализации, но и способно стать непосредственной причиной смерти больных (4,4% от всех больных с НЯ).
Негативное влияние НЯ на результаты лечения происходит тремя основными путями: 1) у 20–60% больных развитие НЯ влечет за собой отмену одного и более ПТП, что приводит к неудаче лечения, рецидивам, амплификации лекарственной устойчивости МБТ; 2) вследствие НЯ происходит снижение качества жизни и, как следствие, страдает мотивация больных к лечению, что также ведет к нарушениям режима химиотерапии; 3) на фоне лекарственного поражения желудочно-кишечного тракта, печени, почек страдает фармакокинетика ПТП, снижается их антимикобактериальный эффект, замедляются репаративные процессы [14].
Таким образом, получение «уникальной» таблетки, которая могла бы включать несколько веществ, обладающих высокой фармакологической активностью и вызывающих наименьшее число НЯ, является особо важной задачей.
Трудности в проведении химиотерапии появились сразу после разработки схем полихимиотерапии туберкулеза с включением 2 препаратов – стрептомицина и изониазида или ПАСК – на срок от 12 до 24 мес. В связи с этим встала необходимость разработки иных, комбинированных форм препаратов, то есть создание «чудесной таблетки», состоящей из комбинации нескольких препаратов.
Сегодня, когда пациент может получать за один период госпитализации, по данным коллег, в среднем до 19 ± 7 препаратов, такая задача становится не только актуальной, но и необходимой, чему было уделено особое внимание на 46-й конференции Всемирного союза по здоровью легких (Кейптаун, 2015).
Совершенствование схем лечения туберкулеза является одним из важнейших пунктов, изложенных в Дорожной карте по детскому туберкулезу, опубликованной ВОЗ совместно с Центром по контролю и профилактике заболеваний США, ЮНИСЕФ, Международным союзом по борьбе с туберкулезом и заболеваниями легких и Партнерством «Остановить туберкулез». В руководстве ВОЗ по лечению туберкулеза у детей (2013) рекомендованы к применению комбинированные препараты (КП), что облегчает прием лекарств и способствует соблюдению режима терапии.
КП не уступают по своей активности входящим в их состав компонентам при их раздельном применении; обеспечивают более надежный контроль приема лекарственных средств; снижают риск передозировки отдельных ПТП, удобны при использовании в стационаре и, особенно, в амбулаторных условиях. С другой стороны, они могут ограничивать возможности подбора индивидуальной терапии в связи с непереносимостью отдельных ПТП и при лекарственной устойчивости МБТ.
В последних нормативных документах, принятых в Российской Федерации (Приказ Минздрава России от 29.12.2014 № 951 «Об утверждении методических рекомендаций по совершенствованию диагностики и лечения туберкулёза органов дыхания», в положении VIII п.6) впервые регламентирована возможность применения КП в лечении туберкулеза.
Необходимость применения КП существует в разных областях медицины. Они активно применяются в лечении заболеваний пищеварительного тракта, бронхолегочной патологии (например, бронхиальной астмы), инфекционных заболеваний, таких как хронический гепатит С и грипп.
Началом внедрения КП во фтизиатрии можно считать применение в 60-х годах комбинации ПАСК (0,5 г) и дигидрострептомицина (1,0 г) в препарате Пасомицин («Рош Фарма С.А., Ф. Хоффман-Ля Рош Лтд.», Испания) и комбинации стрептомицина (0,5 г) и салюзида (1,0 г) в препарате Стрептосалюзид («ЭГИС, Лтд.», Венгрия).
Перед КП стоят следующие задачи:
- оптимизация контролируемого лечения;
- оптимизация дозировок для взрослых и детей.
Решение этих задач позволят улучшить организацию лечебного процесса, повысить приверженность пациентов к лечению, что обеспечит снижение числа отрывов от терапии.
Немаловажным фактом является и высокая экономическая эффективность применения КП [15].
Сегодня бесспорным лидером в разработке КП является компания АО «АКРИХИН», которая ведет свою историю с 1936 г. и за время существования создала более 200 препаратов по основным фармакологическим направлениям.
Во фтизиатрии активно применяются такие комбинации основных ПТП, как изониазид (0,15 г) и пиразинамид (0,5г) – Фтизопирам®, изониазид (0,15 г) и этамбутол (0,4 г) – Фтизоэтам®, к которым еще присоединен витамин В6 (0,015 г) (Фтизопирам® В6, Фтизоэтам® В6). Присоединение витамина обусловлено необходимостью его пополнения, так как он выводится из организма при приеме изониазида.
Один из самых интересных препаратов, который может применяться в современных схемах химиотерапии, – Изокомб®, состоящий из изониазида (60 мг), пиразинамида (300 мг), рифампицина (120 мг), этамбутола (225гм) и витамина В6 (20 мг) [16]. Однако назначение препарата всегда вызывает трудности, что связано с отсутствием подбора его дозировки.
На рынке присутствуют не только отечественные, но и зарубежные аналоги КП: Изозид композитум – изониазид (0,3 г) и В6 (0,05 г) (рег. №: П N009789 от 23.09.11; «Fatol Arzneimittel», Германия), Изо-Эремфат – изониазид (0,15 г) и рифампицин (0,3 г) (рег. номер: П N015081/01-2003 от 21.05.09; «Fatol Arzneimittel», Германия) и Фтизамакс – изониазид (0,15 г), рифампицин (0,15 г), пиразинамид (0,3 г) (рег. № ЛП-001810 от 27.08.2012/26.12.2014; «Macleods Pharmaceuticals Ltd», Индия).
При таком разнообразии препаратов возникает вопрос об их эффективности в лечении туберкулеза и об исследованиях, которые проводились в данном направлении. Среди зарубежных исследований по запросу в системе Elsevier «fixed-dose combination» найдено 1780 публикаций, из них 1075 статей, но при анализе публикаций оказалось, что соответствуют заданной теме только 13.
Международные исследования отличаются достаточно строгим дизайном, где проводится сравнение двух групп, а также длительностью периода наблюдения и определения эффективности лечения только по данным бактериологических методов обследования (табл. 1).
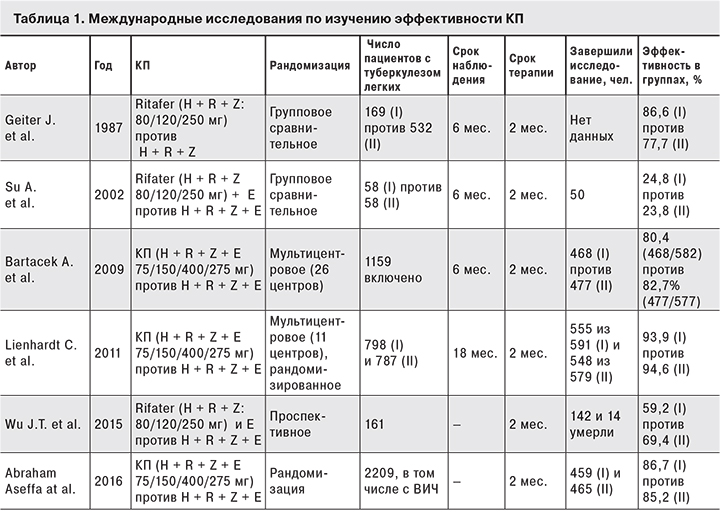
Одно из исследований, опубликованное в 2002 г., демонстрирует результаты двухлетнего применения препарата Рифатер (Rifter) (I группа) в сравнении со стандартным режимом терапии (изониазид, рифампицин, этамбутол и пиразинамид). Всего в исследование было включено 105 пациентов, которые получили 6-месячный курс терапии. 50 пациентов завершили лечение по разным причинам, а у 1 пациента в I группе был рецидив. По результатам исследования был сделан вывод об эффективности лечения в 2 группах по негативации мазка мокроты [17].
Уже в 2007 г. был опубликован первый мета-анализ 68 исследований по применению препаратов с фиксированными дозами «fixed-dose combinations» или КП, проводимых с 1987 по 2002 г. Однако критериям включения соответствовало всего 9 исследований. КП получали 11 925 пациентов, в группу сравнения вошли 8317 человек, которые лечились стандартной комбинацией препаратов (H, R, E, Z). Возраст участников составил от 40 до 68 лет. По результатам исследований был сделан вывод о том, что применение КП снижает риск отрывов от лечения на 24–26% [18].
Рифампицин – один из основных компонентов КП. Однако доза препарата варьируется, что является предметом дискуссии среди исследователей об эффективности лечения при снижении дозы препарата. В 2008 г. были опубликованы данные исследования по изучению фармакокинетики рифампицина и изменения его свойств в зависимости от массы тела. Коллегами сделан вывод об отсутствии влияния массы тела на биодоступность рифампицина, а изменение скорости выведения препарата было незначительным [19].
В одном из немногих мультицентровых рандомизированных исследований с участием 26 центров и включением 1156 больных туберкулезом легких с бактериовыделением, результаты которого были опубликованы австрийскими коллегами в 2009 г., проведено сравнение 2 групп пациентов. В 1-й группе пациенты получали в течение 2 мес. КП Римстар (Rimstar®, «Sandoz GmbH, Kundl», Австрия; HRZE 75/150/400/275 мг в таблетках) + 6 мес. фазы продолжения (I-я группа), в группе сравнения (2-я группа) – 4 мес. Римактозид (Rimactazid®, «Sandoz GmbH», Австрия; H + R 75/150 мг) + 6 мес. фазы продолжения. Анализ эффективности терапии проводили через 9 и 12 мес. после завершения курса лечения [20]. Доказано, что эффективность лечения в группах была практически сопоставима. Однако в 1-й группе курс терапии признан эффективным в 80,41% случаев (у 468 пациентов из 582), а во 2-й – в 92,7% (у 477 пациентов из 577). Дизайн данного исследования можно посчитать не совсем корректным, однако он продиктован спонсором, а полученные результаты очень интересны. Лечение КП, содержащим изониазид и рифампицин, в течение 6 мес. по эффективности не отличается от 2-месячного курса лечения комбинацией из 4 препаратов.
В 2011 г. опубликованы данные рандомизированного многоцентрового исследования, в котором также показана сопоставимая с монопрепаратами эффективность терапии КП [21].
С 2011 г. исследователи указывают на низкий уровень применения КП в лечении туберкулеза, несмотря на десятилетия рекомендаций.
Авторы большинства публикаций стремилось продемонстрировать, что КП и отдельные препараты обладают сходной эффективностью. Эта гипотеза была подтверждена в ряде исследований, проведенных в течение последних 20 лет с использованием КП из 2, 3 и 4 ПТП, при получении конверсии мазка мокроты и низкой частоте рецидивов.
При одинаковой эффективности терапии туберкулеза с использованием КП несомненным их преимуществом является удобство применения, снижение затрат на лечение пациентов. Повсеместное использование КП по-прежнему рекомендуется.
При малом числе рандомизированных исследований в 2011 г. были опубликованы результаты лечения впервые выявленных больных туберкулезом (n = 1585), проведенных в 11 центрах Африки, Азии и Латинской Америки с 2003 по 2008 г. с периодом наблюдения 18 мес. [22]. Сравнение эффективности лечения проводили у пациентов, принимающих КП (R + H + Z + E) в течение 8 нед. в интенсивной фазе химиотерапии (n = 798), и у пациентов, которые принимали монопрепараты (n = 787). Благоприятный результат терапии был получен в 93,3% случаев (у 555 из 591 пациентов) и в 94,6% случаев (у 548 из 579) соответственно.
Высокая эффективность терапии КП не была подтверждена только в одном из проспективных исследований, проведенном в период с 2008 по 2009 г., в котором 142 пациента также получали терапию КП в течение 8 нед. [23].
Однако положительные результаты лечения по критерию «прекращение бактериовыделения» были получены только у 59,2% пациентов в группе принимавших КП и у 69,4% – в группе принимавших монопрепараты.
Проводились единичные исследования с участием больных туберкулезом легких и ВИЧ-инфекцией. В международном рандомизированном исследовании, результаты которого были опубликованы в 2015 г. [24], изучали эффективность и безопасность применения КП у 2209 больных с сочетанной инфекцией туберкулез/ВИЧ при уровне CD4+-лимфоцитов > 350 клеток/мкл. Дизайн исследования не отличался от вышепредствленных. 2 группы пациентов принимали препарты в течение 8 нед, однако из исследования выбыла половина пациентов (п = 1209), и в анализ были включены только 1000 больных – по 500 в основную группу и в группу сравнения. Авторы также указывают на отсутствие достоверных различий показателей в сравниваемых группах после завершения основного курса терапии (86,7 и 85,2% соответственно). При этом показатели безопасности также были сопоставимы.
В последнем из опубликованных анализов [25] представлены результаты 13 рандомизированных исследований, в которых с 1987 по 2015 г. приняли участие 5824 пациента из стран с высоким уровнем распространения туберкулеза, в том числе в 2 исследованиях участвовали пациенты с ВИЧ-инфекцией. Завершили курс терапии 3606 пациентов, эффективность по критерию «прекращение бактериовыделения» составила 61,9%.
Таким образом, в зарубежных публикациях показана необходимость применения КП, в том числе у пациентов с ВИЧ-инфекцией, что обосновано их высокой эффективностью, экономической целесообразностью и созданием высокой приверженности пациентов к лечению.

Отечественные исследования, результаты которых представлены в табл. 2, не отличаются строгим дизайном, длительным периодом наблюдения и корректностью групп сравнения; лишь единичные исследования могут соответствовать данным характеристикам. Из большого числа публикаций, посвященных описанию опыта применения КП и представленных в системе www.elibrary.ru (n = 459 896), только 24 исследования могут быть включены в анализ.
Большинство исследований посвящено изучению эффективности препаратов Изокомб®, Комбитуб, Фтизоэтам® и Фтизопирам®; есть единичные данные о применении зарубежных КП (Фтизомакс и др.).
Разработанные в ХХ в. российские КП учитывали отечественный опыт лечения туберкулеза и первый опыт лечения туберкулеза с множественной лекарственной устойчивостью МБТ.
Одно из исследований, в котором проводилось сравнение эффективности препаратов Фтизоэтам® [H (0,15 г) + E (0,4 г); n = 20], Фтизопирам® [Н (0,15 г) + Z (0,5 г); n = 20] и стандартной схемы химиотерапии, включающей 4 основных ПТП (n = 40) c добавлением витамина В6, показало эффективность терапии у больных туберкулезом легких после 2 мес. применения этих препаратов. У части пациентов [1 (I), 9 (II) и 16 (III)] была выявлена лекарственная устойчивость, что послужило основанием для исключения их из исследования [26]. После 3 мес. лечения бактериовыделение прекратилось в 100 (I), 90,9 (II) и 90,9% (III) случаев. Однако КП при сопоставимой эффективности были более удобны в применении и создавали комфортные условия для пациентов.
Далее большая часть исследований была посвящена КП, которые представляли собой комбинации препаратов первого и второго ряда.
Результаты лечения препаратом Комбитуб-Нео® (ломефлоксацин, пиразинамид, протионамид и этамбутол) оказались ожидаемо выше результатов применения препаратов только первого ряда (изониазида, пиразинамида, этамбутола и рифампицина) – 76,7% против 66,6% [27].
Аналогичные результаты были получены в исследовании Т.И. Морозовой (2013), где эффективность терапии с применением Комбитуб-Нео® составляла 80,0% [28].
Достоверно высокая (71,4%) эффективность КП Изопаск (71,4%) была показана при лечении пациентов с туберкулезом легких в сравнении с применением стандартной схемы химиотерапии, включающей ПАСК (57,1%). В данном исследовании обращала на себя внимание достоверно высокая частота НЯ в группе сравнения (6,4% против 27,6%; р < 0,05) [29].
В одном из немногочисленных исследований применения КП у детей была показана возможность использования и доказана высокая эффективность применения препарата Фтизомакс [30, 31].
В исследованиях, проведенных в последние годы [32, 33], доказана высокая экономическая целесообразность применения КП в схеме терапии туберкулеза легких.
Недавно в России стартовало новое мультицентровое «Наблюдательное исследование применения препаратов Фтизоэтам®, Фтизопирам®, Фтизопирам® В6, Фтизоэтам® В6, Изокомб® в рамках интенсивной фазы I и III режимов химиотерапии больных туберкулезом легких для оценки исходов и переносимости лечения», в котором будет изучена эффективность ПТП первого ряда в лечении туберкулеза органов дыхания.
Сегодня многими исследованиями доказаны сопоставимость фармакокинетических показателей и соответствие доз КП и монопрепаратов. Современные КП пока могут быть использованы главным образом при лечении лекарственно чувствительного туберкулеза. Применение их позволит обеспечить эффективное лечение туберкулеза легких, уменьшить число НЯ, улучшить психо-эмоциональное состояние пациентов и усилить мотивацию к лечению, что будет способствовать сокращению сроков бактериовыделения и терапии, предотвращению отрывов от лечения и формированию туберкулеза с лекарственной устойчивостью возбудителя. Возможно будет достичь экономии средств на оказание помощи больным туберкулезом до 25–50%.
В скором времени, с учетом появления новых ПТП, необходимо будет создать КП для лечения туберкулеза со множественной ЛУ возбудителя – Бедадел (бедаквилин + деламанид), Перхлобед (перхлозон + бедаквилин), Бедалинедазоперх (бедаквилин + линезолид + перхлозон).


