Этиопатогенез туберкулеза (ТБ) традиционно связывали с инфицированием пациента одним штаммом туберкулезных микобактерий (Mycobacterium tuberculosis complex), поэтому рецидив после проведенного курса химиотерапии считали результатом реактивации процесса, обусловленного тем же штаммом возбудителя. Однако начиная с 70-х годов прошлого века, по мере совершенствования методологии внутривидового типирования микобактерий, были накоплены доказательства возможности первичного инфицирования несколькими штаммами и экзогенной реинфекции штаммом M. tuberculosis, отличным от выделенного первично [1–3]. В настоящее время генотипическая и фенотипическая неоднородность штаммов M. tuberculosis и вероятность смешанной инфекции (mixed infection) при туберкулезе не вызывают сомнения [4, 5].
Под смешанной инфекцией понимают присутствие в организме больного ТБ двух или более штаммов возбудителя одновременно [1, 6]. Так, по данным I. Shamputa и соавт. [6], доля смешанных субпопуляций возбудителя составила 8,2% при анализе 97 изолятов M. tuberculosis, полученных от вновь выявленных больных до начала лечения противотуберкулезными препаратами (ПТП). На территориях с высоким уровнем заболеваемости ТБ частота смешанной инфекции достигает 20–26% [5, 7].
Клинико-эпидемиологические особенности туберкулезной инфекции не всегда позволяют определить точное время и место заражения, а в связи с этим достоверно установить источник и обстоятельства инфицирования. Полагают, что возможно как одномоментное инфицирование несколькими штаммами возбудителя (собственно смешанная инфекция), так и последовательное инфицирование на протяжении длительного латентного периода, когда на фоне ослабления иммунитета, обусловленного присутствием в организме одного штамма, происходит заражение другим штаммом возбудителя, нередко с отличным от первого спектром фенотипической лекарственной устойчивости (ЛУ) [8]. Таким образом, смешанную инфекцию следует отличать от экзогенной реинфекции – нового эпизода заражения, возникшего у излеченного пациента, и суперинфекции – заражения новым штаммом возбудителя на фоне уже имеющегося в организме, когда в результате лечения по разным причинам абациллирование не было достигнуто. Показано, что риск повторного эпизода, возникшего после проведенного лечения, в 4–7 раз выше, чем при первичном инфицировании [4]. Клинически случаи повторного заражения могут протекать в форме обострений или рецидивов ТБ, требующих хирургического лечения в случае множественной/широкой лекарственной устойчивости (МЛУ/ШЛУ) возбудителя [9, 10]. Показано, что рецидив ТБ с МЛУ возбудителя (МЛУ-ТБ) у больных, завершивших курс лечения, в 5,2% случаев возникает в течение двухлетнего периода наблюдения [11].
 В этой связи возникает вопрос об интерпретации результатов теста фенотипической лекарственной чувствительности (ЛЧ), особенно при выделении от больного и чувствительного, и мультирезистентного к ПТП изолятов возбудителя. Так, в обзоре N. Walter и соавт. [8] приведены примеры ошибочной трактовки появления МЛУ как результата амплификации резистентности M. tuberculosis при терапии препаратами 1-го ряда в течение нескольких месяцев. С другой стороны, свежее заражение чувствительным штаммом может совпасть по времени или спровоцировать реактивацию латентной инфекции, обусловленной МЛУ штаммов возбудителя [12, 13]. Таким образом, инфицирование несколькими штаммами возбудителя одновременно или в течение нескольких эпизодов заражения осложняет эпидемиологический анализ, лабораторную диагностику и лечение больных МЛУ-ТБ.
В этой связи возникает вопрос об интерпретации результатов теста фенотипической лекарственной чувствительности (ЛЧ), особенно при выделении от больного и чувствительного, и мультирезистентного к ПТП изолятов возбудителя. Так, в обзоре N. Walter и соавт. [8] приведены примеры ошибочной трактовки появления МЛУ как результата амплификации резистентности M. tuberculosis при терапии препаратами 1-го ряда в течение нескольких месяцев. С другой стороны, свежее заражение чувствительным штаммом может совпасть по времени или спровоцировать реактивацию латентной инфекции, обусловленной МЛУ штаммов возбудителя [12, 13]. Таким образом, инфицирование несколькими штаммами возбудителя одновременно или в течение нескольких эпизодов заражения осложняет эпидемиологический анализ, лабораторную диагностику и лечение больных МЛУ-ТБ.
Доказательством присутствия в организме пациента нескольких штаммов M. tuberculosis служит выделение из мокроты и/или других видов исследуемого материала изолятов возбудителя с существенно различающимися профилями генотипирования [3, 4, 14, 15]. С этой целью используют метод типирования на основе ПЦР, который позволяет оценить число тандемных нуклеотидных повторов в двух или более локусах MIRU-VNTR хромосомы [3, 5, 16]. Однако «золотым стандартом» генотипирования M. tuberculosis остается трудоемкий, но и наиболее дискриминирующий в большинстве случаев метод IS6110-RFLP-типирования, основанный на сравнении числа и взаиморасположения копий мобильного элемента IS6110 в паттернах рестрикции ДНК изолятов M. tuberculosis [17, 18]. При этом необходимо учитывать, что клональная микроэволюция возбудителя в организме хозяина может обусловить аллельный полиморфизм серийных изолятов (субпопуляций) M. tuberculosis пациента, первоначально инфицированного одним штаммом. В этом случае наблюдают незначительные различия паттернов ДНК, касающиеся числа повторов в единственном локусе MIRU-VNTR и/или 1–2 копий мобильного элемента IS6110 [5, 8, 15, 17, 19].
В любом случае оценка генетической вариабельности изолятов M. tuberculosis способствует не только правильной интерпретации результатов теста ЛЧ, но и установлению эпидемиологических связей между случаями заболевания ТБ, особенно в противотуберкулезных учреждениях, где частота внутрибольничного инфицирования штаммами возбудителя с МЛУ может составлять 5,1–25,2% [9, 12, 20, 21].
Цель исследования – проведение молекулярно-эпидемиологического анализа случаев заболевания и установление факторов риска рецидива и обострения ТБ легких у пациентов, многократно госпитализированных в противотуберкулезные учреждения.
Материалы и методы
Проведено ретроспективное эпидемиологическое исследование по материалам медицинских карт (ф.003/у) 163 пациентов, госпитализированных в противотуберкулезный стационар более 1 раза в 2009–2013 гг. 34 человека составили основную группу, 129 – контрольную. Главной причиной повторной госпитализации пациентов основной группы было отсутствие эффекта от специфической противотуберкулезной химиотерапии, что проявлялось возникновением новых очагов в легких и изменением профиля фенотипической ЛЧ изолятов возбудителя. 129 пациентов контрольной группы были госпитализированы для проведения планового этапного хирургического лечения по поводу ТБ легких. Для исследования были доступны 73 серийные культуры (изоляты) M. tuberculosis с известными профилями ЛЧ из музейной коллекции бактериологической лаборатории Санкт-Петербургского НИИ фтизиопульмонологии Минздрава России (далее – СПбНИИФ), полученные от больных основной группы. МЛУ, ШЛУ и полирезистентность возбудителя ТБ определяли согласно приказу Приказу Минздрава России № 951 от 29.12.2014 г. [22]. Молекулярно-генетические исследования выполнены в лаборатории молекулярной микробиологии НИИ эпидемиологии и микробиологии имени Пастера. Выделение ДНК из чистых культур микобактерий ТБ (МБТ) осуществляли согласно рекомендациям J. Van Embden и соавт. [18]. Идентификацию изолятов МБТ до вида проводили с использованием набора реагентов HAIN-GenoType MTBС («Hain Lifescience», Германия; регистрационное удостоверение № ФСР 2008/02297 от 15.07.2008). Для первоначальной дифференциации изолятов M. tuberculosis на группы Beijing и non-Beijing методом ПЦР в режиме реального времени использовали тест-систему «Амплитуб-Beijing» (ООО «Синтол», Москва). Для генотипирования изолятов M. tuberculosis использовали сполиготипирование (оценка полиморфизма 43 нуклеотидных последовательностей-спейсеров, разделяющих прямые повторы, линейно расположенные в DR-области хромосомы) [23], MIRU-VNTR-типирование (15 локусов) [16], а также IS6110-RFLP-типирование [18] преимущественно для изолятов семейства Beijing. Результаты сполиготипирования представляли с помощью бинарного кода в формате Excel и сравнивали с имеющимися в локальной базе данных «Сполигопрофили Mycobacterium tuberculosis на Северо-Западе России» (свидетельство о государственной регистрации базы данных № 2014620898). Международный код сполиготипа (SIT), профиль MIRU-VNTR (15 локусов) и принадлежность штаммов возбудителя к генетическим семействам (генотипам, линиям) определяли согласно компьютерным базам данных: международной обновляемой SITVITWEB (http://www.pasteur-guadeloupe.fr:8081/SITVIT_ONLINE/) и MIRU-VNTRplus (http://www.miru-vntrplus.org) [18, 24]. Присутствие в исследуемом образце ДНК двух или более генотипов M. tuberculosis с cущественно различавшимися паттернами (IS6110-RFLP и MIRU-VNTR) рассматривали как доказательство инфицирования несколькими штаммами возбудителя. Статистическую обработку данных проводили с использованием программ Winpepi11.47, EpiCalc2000, вычисляя χ2, точный критерий Фишера (F) и отношение шансов (OШ). Статистически значимыми считали различия при 95% доверительном интервале (ДИ) (p < 0,05).
Результаты и обсуждение
В основной группе из 34 больных ТБ легких было 22 мужчины и 12 женщин, средний возраст пациентов составлял 33,6 ± 8,5 года. Средняя продолжительность заболевания – 6,7 ± 3,7 года, число госпитализаций по поводу основного заболевания в противотуберкулезные учреждения – не менее 2. Пребывание в местах лишения свободы отмечено у 7 (20,6%) пациентов (в контрольной группе таковых не было). По характеру течения туберкулезного процесса в основной группе выделены 2 подгруппы: «рецидив» – 10 пациентов (7 мужчин и 3 женщины, средний возраст – 26,3 года) и «обострение» – 24 пациента (15 мужчин и 9 женщин, средний возраст – 36,7 года).
На момент первой госпитализации в противотуберкулезный стационар МЛУ возбудителя была обнаружена у 19 (56%) больных, ШЛУ – у 12 (35,3%), полирезистентность – у 1 (2,9%), ЛЧ – у 2 (5,8%). В процессе лечения число пациентов с ШЛУ возбудителя возросло до 30 (88,2%). Изменение спектра ЛЧ (с ЛЧ или МЛУ на ШЛУ) в 12 (35,0%) случаях произошло в течение 1 года, в 5 (14,7% ) – от 1 года до 2 лет, 2,9 % (1) – более 3 лет. В 16 (47%) случаях МЛУ/ШЛУ наблюдали нарастание (амплификацию) числа препаратов, к которым возбудитель проявлял резистентность.
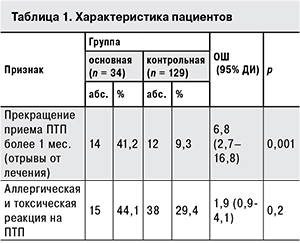
 Различий в возрастно-половой структуре между основной и контрольной группами больных ТБ легких не наблюдалось. Анализ возможных причин и факторов риска рецидива и обострения заболевания показал, что в основной группе доля пациентов с нарушением схемы лечения (прекращение приема препаратов более 1 мес.) была в 4,4 раза выше, чем в контрольной группе (табл. 1).
Различий в возрастно-половой структуре между основной и контрольной группами больных ТБ легких не наблюдалось. Анализ возможных причин и факторов риска рецидива и обострения заболевания показал, что в основной группе доля пациентов с нарушением схемы лечения (прекращение приема препаратов более 1 мес.) была в 4,4 раза выше, чем в контрольной группе (табл. 1).
Вместе с тем из табл. 1 видно, что доля пациентов с аллергической и токсической реакцией на противотуберкулезную химиотерапию в основной группе была в 1,5 раза больше, чем в контрольной (p = 0,2). При этом у 4 (28,6%) из 14 пациентов были документированы отрыв от лечения и аллергическая реакция на ПТП. Снижение приверженности к лечению и отказ от специфической терапии могут быть обусловлены наличием нежелательных эффектов ПТП. Прерывание лечения приводит к амплификации ЛУ МБТ, в том числе к формированию МЛУ/ШЛУ.
Таким образом, нарушения режима химиотерапии и побочные реакции на ПТП негативно влияют на течение специфического процесса, повышая риск его возобновления, и наряду с неудовлетворительным качеством инфекционного контроля способствуют формированию и распространению (в том числе в противотуберкулезном стационаре) МЛУ/ШЛУ штаммов M. tuberculosis [25–27]. Напротив, приверженность к лечению снижает риски рецидива или обострения процесса за счет эндогенной реактивации, а также повторного заражения [11, 25, 26].
В дальнейшее молекулярно-эпидемиологическое исследование были включены серийные культуры M. tuberculosis 34 пациентов основной группы. Анализ полученных данных показал, что 9 (90,0%) случаев рецидива ТБ были ассоциированы с принадлежностью возбудителя к генетическому семейству Beijing.
У пациентов с обострением процесса генотип Beijing M. tuberculosis наблюдался в 19 (79,2%) случаях. В остальных случаях изоляты возбудителя принадлежали к другим (non-Beijing) семействам: LAM9 – 3 (12,5%), Haarlem1 – 1 (4,2%), Unknown (не установлено) – 1 (4,2%).
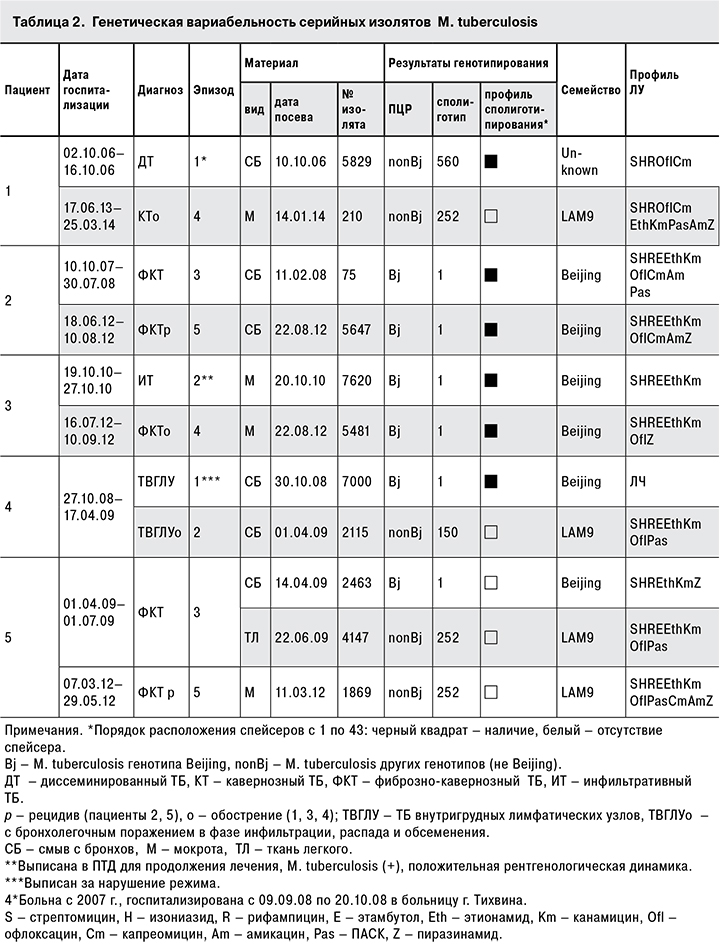
Средний возраст пациентов с МБТ генотипа Beijing составил 31,7 ± 7,5 года, non-Beijing – 41,0 ± 8,2 года. При сравнении генотипов серийных изолятов M. tuberculosis одних и тех же пациентов основной группы выявлено 5 (14,7%) случаев несовпадения профилей генотипирования по одному или нескольким независимым генетическим маркерам.
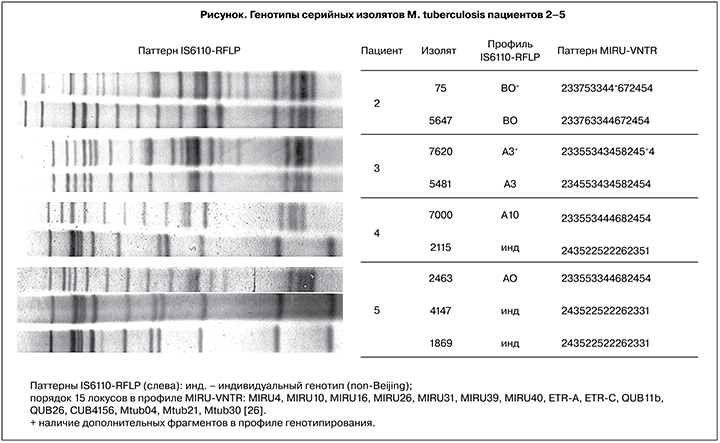
Как видно из табл. 2, у пациенток 1, 4 и пациента 5 наблюдали различия генотипов изолятов M. tuberculosis на уровне генетического семейства; у пациентов 2 и 3 – различия профилей MIRU-VNTR и/или IS6110-RFLP в пределах генотипа Beijing (рисунок, см. на вклейке).
Доступные для исследования первые по времени выделения культуры M. tuberculosis № 75 и 7620 пациентки 2 (рецидив) и пациента 3 (обострение) соответственно по результатам ПЦР и сполиготипирования были отнесены к генотипу Beijing сполиготипа SIT1, который является маркером принадлежности возбудителя к данному генетическому семейству. Однако наличие дополнительных фрагментов слабой интенсивности в профилях IS6110-RFLP и MIRU-VNTR культур № 75 и 7620 (по сравнению с четкими профилями культур № 5674 и 5481, выделенных при следующих эпизодах госпитализации), ставит вопрос о смешанной инфекции – заражении, как минимум, двумя штаммами M. tuberculosis. С другой стороны, эти данные могут свидетельствовать о повторном (экзогенном) инфицировании в результате длительного контакта с несколькими источниками инфекции, что, вероятнее всего, может наблюдаться в противотуберкулезных учреждениях, а также в местах лишения свободы. Действительно, анализ медицинских данных показал, что оба пациента (2 и 3) имели более двух госпитализаций в анамнезе, режим лечения – как стационарный, так и амбулаторный, длительность заболевания ТБ легких – 10 лет и 4 года соответственно.
Известно, что пациент 3 находился в учреждении ФСИН до 2007 г. (предположительное место инфицирования), но к концу 2009 г. успешно завершил лечение по поводу ТВГЛУ. В 2010 г. был госпитализирован в клинику СПбНИИФ по поводу прогрессирования процесса (ИТ в фазе распада и обсеменения). Тогда же в мокроте выявлено присутствие нескольких генотипов возбудителя одновременно (культура M. tuberculosis № 7620). Один из них по наличию характерного профиля IS6110-RFLP, несомненно, принадлежал генотипу Beijing (вариант А3). Персистенцию в организме больного доминирующего штамма А3 Beijing подтверждает и совпадение базового спектра МЛУ (SHREEthKm) в субпопуляциях возбудителя (изоляты № 7620 и № 5481). Приобретение устойчивости к офлоксацину (Ofl) и пиразинамиду (Z) свидетельствует о неэффективности лечения (период наблюдения около двух лет) и прогрессировании МЛУ/ШЛУ возбудителя ТБ). Показано, что формирование ШЛУ происходит в результате амплификации ЛУ возбудителя в период неэффективного или прерванного курса химиотерапии МЛУ [11, 25, 26].
У пациентки 2, возможно, имела место экзогенная суперинфекция (ФКТ, 3-й эпизод госпитализации) или контаминация при выполнении фибробронхоскопии в стационаре, поскольку культура № 75 содержала фрагменты слабой интенсивности («+», см. рисунок на вклейке) в дополнение к доминирующим профилям IS6110-RFLP Beijing В0 и MIRU-VNTR (числовой профиль 233762344672454), которые были определены через 4,5 года у изолята № 5647 (уже не содержал дополнительных фрагментов слабой интенсивности). Вместе с тем незначительная вариабельность числа копий (6 и 5) MIRU31 касается одного локуса MIRU-VNTR и, скорее всего, является следствием клональной микроэволюции возбудителя в организме хозяина [5, 15]. Персистенцию в организме больной доминирующего штамма В0 Beijing подтверждает и совпадение базового спектра ШЛУ (SHREEthKmOflCmAm) обеих культур M. tuberculosis.
Ретроспективный анализ результатов генотипирования изолятов M. tuberculosis, полученных при посеве в разное время материала фибробронхоскопии (ФБС) от пациентов № 1, 2, 4 и 5, выявил вариабельность спектра ЛЧ, а также профилей IS6110-RFLP и MIRU-VNTR в пределах наиболее распространенных в России генетических семейств Beijing (варианты В0, А0, А10) и LAM9 (SIT252, SIT150). Следует отметить, что бронхоскопы считают наиболее возможным фактором нозокомиальной передачи МЛУ/ШЛУ штаммов (особенно генотипа Beijing) M. tuberculosis при внутрибольничных вспышках заболевания, связанных с эндоскопическими процедурами [9, 12, 27–30].
Молекулярно-эпидемиологический анализ показал, что культуры M. tuberculosis, полученные от пациентки 1 в 2006 г. из материала ФБС (№ 5829) при первом эпизоде болезни и в 2014 г. из мокроты (№ 210), имели одинаковые базовые профили ШЛУ (SHROflCm). Расширение спектра ЛУ (выделено курсивом в табл. 2) у последнего по времени выделения изолята № 210 можно было бы объяснить неуклонным прогрессированием заболевания (4 госпитализации в течение 7 лет) за счет эндогенной реактивации возбудителя и амплификацией резистентности к ПТП в процессе лечения. Однако различия сполиготипов (SIT560 и SIT252) и профилей MIRU-VNTR (более чем по двум локусам), указывающие на принадлежность изолятов возбудителя к разным генетическим семействам, свидетельствует в пользу экзогенной инфекции.
В 2 (5,9%) случаях (пациентка 4 и пациент 5) произошла радикальная смена генотипа возбудителя в период пребывания больных в противотуберкулезном стационаре. Так, от пациентки 4 в течение полугода лечения получены 2 изолята M. tuberculosis, генотипы и профили ЛЧ которых не совпадают. Учитывая характер течения процесса (прогрессирование), логично предположить, что имела место экзогенная (нозокомиальная) суперинфекция ШЛУ штаммом генотипа LAM9(SIT150). Аналогичные рассуждения могли бы быть применимы и в случае пациента 5, однако полная смена генотипа возбудителя (изоляты № 2463 – смыв с бронхов и № 4147 – ткань легкого) в течение 2 мес. лечения в стационаре при наличии одинакового профиля базовой МЛУ изолятов M. tuberculosis ставит это положение под сомнение. В данном случае нельзя исключить контаминацию как при ФБС в стационаре, так и при посеве материала в лаборатории.
Критерию эффективности лечения (достижение абациллирования) после проведения химиотерапии и хирургического лечения на момент выписки из стационара соответствовали 22 (64,7%) из 34 пациентов; не достигли абациллирования 12 (35%) больных. От таких пациентов после лечения продолжали выделять в основном различные IS6110-RFLP варианты возбудителя генотипа Beijing: В0 (эпидемически значимый в России [29]) –33,3%, А0 – 16,6%; А14, B21, L5, C3, M12 – по 8,3%; генотипа LAM9 (SIT252) – в одном случае (пациентка 1) – 8,3%. Данные генотипы были описаны еще в конце 90-х годов у штаммов M. tuberculosis, выделенных от больных тяжелым прогрессирующим ТБ легких, оперированных в клиниках СПбНИИФ [19].
Доля достигших абациллирования пациентов, инфицированных штаммами non-Beijing, составила 85,7% (6 из 7), а инфицированных штаммами M. tuberculosis Beijing – 59,3% (16 из 27). Наиболее распространенным генотипом штаммов non-Beijing оказался генотип LAM9 (SIT42, SIT252, SIT150)
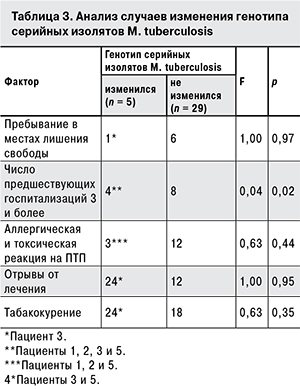
Далее был проведен анализ случаев предполагаемой смешанной или экзогенной инфекции. Для оценки возможного влияния на изменения генотипа серийных изолятов возбудителя были выбраны следующие факторы: пребывание в местах лишения свободы в анамнезе; число госпитализаций; аллергическая и токсическая реакция на ПТП; отрывы от лечения и табакокурение, поскольку установлено влияние последнего на эффективность лечения; скорость абациллирования и развитие резистентности к лекарственной терапии [31, 32] (табл. 3).
Как видно из табл. 3, установлена связь между числом госпитализаций (3 и более) в противотуберкулезные учреждения и изменением генотипа серийных изолятов возбудителя (p = 0,02). Полученные данные можно объяснить высокой степенью риска экзогенного инфицирования за счет контактов с многочисленными источниками МЛУ/ШЛУ инфекции при госпитализации в специализированные учреждения. При этом, учитывая ограниченный объем выборки, ассоциация изменения генотипа изолятов M. tuberculosis с предполагаемым инфицированием (смешанная или экзогенная инфекция) в период госпитализаций требует дальнейшего изучения.
Выводы
Фактором риска рецидива или обострения туберкулезного процесса был отрыв от лечения [OШ = 6,8; 95% ДИ (2,7–16,8); p = 0,001].
Из 34 случаев рецидива и обострения ТБ легких 90 и 79,2% соответственно были вызваны штаммами M. tuberculosis генетического семейства Beijing.
У 5 (14,7%) из 34 больных ТБ легких выявлена вариабельность спектра ЛЧ, а также профилей IS6110-RFLP и MIRU-VNTR серийных изолятов M. tuberculosis в пределах наиболее распространенных в России генотипов Beijing (варианты В0, А0) и LAM9 (SIT252, SIT150).
Результаты генотипирования и анализ спектра ЛЧ серийных изолятов M. tuberculosis, полученных от больных ТБ легких, позволяют провести углубленный эпидемиологический анализ, выявить факторы риска при рецидиве и обострении заболевания.
______________________________
Молекулярно-генетические исследования выполнены при поддержке Российского научного фонда (РНФ), грантовое соглашение № 14-14-00292.


