Острые респираторные инфекции (ОРИ) сохраняют ведущие позиции в структуре инфекционной патологии во всех возрастных группах и, вследствие широкой распространенности, представляют серьезную проблему. По данным государственной статистической отчетности, в 2016 г. Российской Федерации было зарегистрировано более 30 млн случаев респираторных заболеваний, из которых 73% были диагностированы у детей. Показатель заболеваемости ОРИ среди детей до 14 лет в 2016 г. составил 88 681 на 100 тыс., что делает их самыми частыми инфекционными заболеваниями в детском возрасте, обусловливающими 90% обращений за амбулаторной педиатрической помощью в осенне-зимний период [1, 2].
 В педиатрической практике тяжесть и нередко длительность болезни в сочетании с анатомо-физиологическими особенностями детского организма приводят к развитию нарушений нейровегетативного статуса, который может проявляться в виде функциональных соматовегетативных (нарушения сна, дисфункция сердечно-сосудистой системы, снижение аппетита, появление потливости, стойкого дермографизма и др.) и психо-эмоциональных расстройств (симптомы астении, эмоциональная лабильность, синдром «белого халата»), значимость и возможность развития которых нередко недооценивается практическими врачами, особенно при наиболее распространенных инфекционных заболеваниях у детей – острых респираторных и кишечных инфекциях [3–5].
В педиатрической практике тяжесть и нередко длительность болезни в сочетании с анатомо-физиологическими особенностями детского организма приводят к развитию нарушений нейровегетативного статуса, который может проявляться в виде функциональных соматовегетативных (нарушения сна, дисфункция сердечно-сосудистой системы, снижение аппетита, появление потливости, стойкого дермографизма и др.) и психо-эмоциональных расстройств (симптомы астении, эмоциональная лабильность, синдром «белого халата»), значимость и возможность развития которых нередко недооценивается практическими врачами, особенно при наиболее распространенных инфекционных заболеваниях у детей – острых респираторных и кишечных инфекциях [3–5].
Среди терапевтических подходов к коррекции нарушений нейровегетативного статуса у детей, перенесших ОРИ, перспективным представляется изучение эффективности метаболитной терапии, являющейся в данном случае патогенетической. Наиболее изученным препаратом в этой области является глицин. Была доказана его роль не только как тормозного нейротрансмиттера практически во всех отделах ЦНС, но и как естественного метаболита мозга. Глицин обладает общеметаболическим действием: при острой ишемии головного мозга он связывает низкомолекулярные токсичные продукты [6]. Эффективность глицина в педиатрии была показана при нарушениях адаптационного потенциала [7], хронической сердечно-сосудистой недостаточности [8], церебральной дисфункции [9] и др.
Исследователи в последнее время уделяют внимание и другим метаболитам ЦНС, в частности, L-глутаминовой кислоте, являющейся нейромедиаторной аминокислотой, стимулирующей передачу возбуждения в синапсах ЦНС. В исследованиях, проведенных ранее, было показано, что при развитии гипоксии у больных, находящихся в критическом состоянии, в плазме крови содержание глутаминовой кислоты снижается в 5 раз и это приводит к развитию гипофункции глутаматергической нейромедиаторной системы [10], что является одним из важных факторов снижения нейрональной адаптации к гипоксии, так как она реализуется путем увеличения биосинтеза жирных кислот из глутамина и глутамата с последующей этерификацией в липиды [11]. Недавние исследования показали, что, помимо метаболического действия на нервную ткань, глицин, лизин и глутамат непосредственно усиливают бактериолитическую активность лизоцима, а глутамат активирует и интерлейкин-2, и лизоцим. Это позволяет по-новому оценить патогенетические аспекты применения данных соединений при инфекционной патологии [12].

В этой связи изучение эффективности комплексного метаболитного препарата, включающего L-глутаминовую кислоту, глицин и L-цистин, в коррекции нарушений нейровегетативного статуса у детей с ОРИ представляется значимым для клинической практики. Препарат ранее продемонстрировал эффективность в терапии синдрома вегетативной дисфункции у детей [13], хронической сердечно-сосудистой недостаточности у детей и взрослых [8, 14].
 Целью нашего исследования была оценка эффективности, переносимости и безопасности применения данного комбинированного препарата в сравнении с базисной терапией при коррекции нарушений нейровегетативного статуса у детей с ОРИ сравнении с базисной терапией.
Целью нашего исследования была оценка эффективности, переносимости и безопасности применения данного комбинированного препарата в сравнении с базисной терапией при коррекции нарушений нейровегетативного статуса у детей с ОРИ сравнении с базисной терапией.
Материалы и методы
В исследовании приняли участие 53 пациента в возрасте от 12 до 18 лет с ОРИ и клиническими проявлениями нарушений нейровегетативного статуса. Критериями включения в исследование были: возраст старше 12 лет и моложе 18 лет, установленный диагноз ОРИ легкой и среднетяжелой формы, длительность проявления симптомов ОРИ не более 3 суток, установленные нарушения нейровегетивного статуса, подписанное информированное согласие на участие в исследовании законными представителями пациента. Все пациенты были распределены случайным образом с использованием рандомизационных таблиц в 2 группы. В основную группу были включены 27 пациентов (средний возраст 14,0 ± 0,4 года), получавших в составе комплексной терапии метаболитный препарат по 1 таблетке 3 раза в сутки подъязычно в течение 30 дней. В группу сравнения вошли 26 пациентов (средний возраст 14,8 ± 0,5 года), которые получали базисную терапию ОРИ. Группы были сопоставимы по полу и возрасту пациентов. Клинические проявления, тяжесть основного заболевания, сроки поступления в стационар, проводимая терапия основного заболевания также были сопоставимы в сравниваемых группах.
 Всем детям в динамике (при поступлении, при выписке на 7–12-е сутки и в катамнезе через 1 мес.) проводили комплексную оценку состояния нейровегетативного статуса. Оценивали наличие и характер жалоб пациента; анализировали коэффициенты Кердо и Хильдебранта [15], результаты теста астении и теста настроения по И.К. Шац [16], теста Ч.Д. Спилбергера и Ю.Л. Ханина [17]; степень нарушений внимания и поведения на основании таблиц Шульте [18]; результаты оценки внимания по методике 10 слов А.Р. Лурии [19]. У всех детей в динамике оценивали влажность кожных покровов для определения типа реакции ВНС.
Всем детям в динамике (при поступлении, при выписке на 7–12-е сутки и в катамнезе через 1 мес.) проводили комплексную оценку состояния нейровегетативного статуса. Оценивали наличие и характер жалоб пациента; анализировали коэффициенты Кердо и Хильдебранта [15], результаты теста астении и теста настроения по И.К. Шац [16], теста Ч.Д. Спилбергера и Ю.Л. Ханина [17]; степень нарушений внимания и поведения на основании таблиц Шульте [18]; результаты оценки внимания по методике 10 слов А.Р. Лурии [19]. У всех детей в динамике оценивали влажность кожных покровов для определения типа реакции ВНС.
Статистическую обработку полученных данных проводили с использованием программы Microsoft Excel. Рассчитывали среднюю арифметическую (М), стандартную ошибку (m). Для оценки различий между показателями использовали t-критерий Стъюдента и критерий χ2. Различия считались достоверными при р < 0,05, высоко достоверными – при p < 0,01 и p < 0,001, недостоверными – при р > 0,05. Сравнительный анализ качественных переменных проводили с помощью точного двустороннего критерия Фишера для частот менее 5 [20].
Результаты и обсуждение
Основными показателями эффективности терапии были результаты специальных тестов по оценки нейровегетативного статуса пациента.
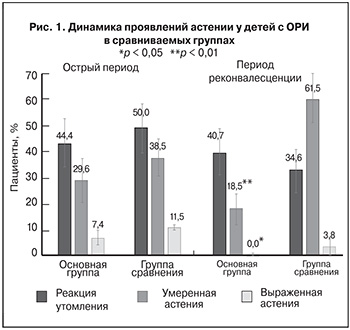
 Оценку выраженности и типа астении проводили в остром периоде заболевания и в катамнезе через 1 мес. (рис. 1).
Оценку выраженности и типа астении проводили в остром периоде заболевания и в катамнезе через 1 мес. (рис. 1).
В основной группе было установлено достоверно значимое снижение выраженности астении в динамике болезни: доля пациентов с выраженной астенией в катамнезе снизилась до 0 (р < 0,05). В то же время отмечено достоверно меньшее число пациентов с умеренной астенией после окончания курса терапии, чем в группе сравнения (р < 0,01).
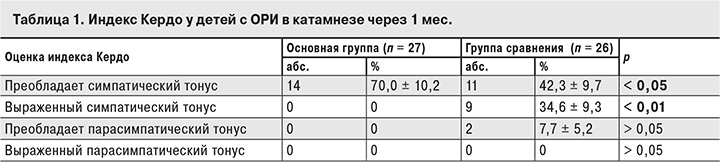
Средние значения индекса Кердо, характеризующего системную дистонию, достоверно не различались: в основной группе они составили 20,4 ± 2,8, в контрольной – 22,5 ± 4,6, что свидетельствует о превалировании симпатических влияний у детей. Однако через 1 мес. в основной группе у большинства пациентов было диагностировано преобладание симпатического тонуса вегетативной нервной системы, при этом выраженных отклонений в симпатической регуляции, в отличие от пациентов группы сравнения, не выявлено, что свидетельствует о восстановлении функционирования нейрорегуляторной системы (табл. 1).
Межсистемный кардиореспираторный вегетативный тонус, оцененный с помощью индекса Хильдебранта, имел в основном эйтонический характер в обеих группах в остром периоде заболевания. В катамнезе через 1 мес. индекс Хильдебранта снижался как в основной группе, так и в группе сравнения, но достоверных различий между его показателями не выявлено (3,9 ± 0,1 и 3,7 ± 0,1 Ед соответственно; p > 0,05).
Оценка состояния слуховой памяти на слова, утомляемости, активности внимания, запоминания, сохранения, воспроизведения проводилась с помощью методики 10 слов А.Р. Лурии. Она заключается в том, что у здоровых детей с каждым воспроизведением количество правильно названных слов увеличивается. Повышенная утомляемость регистрируется в том случае, если испытуемый сразу воспроизвёл 8–9 слов, а затем с каждым разом все меньше и меньше. Число слов, сохранившихся в памяти пациента и воспроизведенных через 1 ч, показывает объем слуховой долговременной памяти. Результаты тестирования детей в катамнезе показали, что в основной группе быстрое истощение функции ЦНС наблюдалось у меньшего числа пациентов, а нормальные показатели – у большинства (табл. 2).
При анализе внимания методом тестирования по таблицам Шульте в остром периоде ОРИ до начала метаболитной терапии было отмечено снижение внимания у всех пациентов, при этом достоверных различий показателей между группами не получено. В катамнезе в основной группе достоверно улучшились показатели эффективности работы и степени врабатываемости (табл. 3).
Определение уровня тревожности по шкале Спилберга показало достоверно значимые различия в сравниваемых группах: в катамнезе доля пациентов с высоким уровнем ситуационной и личной тревожности в группе сравнения была больше (рис. 2). В остром периоде по уровню тревожности у пациентов группы были сопоставимы.
Одним из маркеров дисфункции вегетативной нервной системы является влажность кожных покровов, которую в исследовании определяли инструментальным методом. Влажность кожных покровов на тыльной поверхности кисти у пациентов основной группы была менее выражена и снизилась через 1 мес. (рис. 3).
Данные клинико-лабораторного обследования выявили достоверную нормализацию всех показателей в катамнезе в обеих группах. Отсутствие отклонений показателей гемограммы от референсных значений после окончания курса терапии у пациентов основной группы говорит о безопасности применения метаболитной терапии у детей при ОРИ.
Нежелательных явлений у пациентов в сравниваемых группах не зарегистрировано.
Таким образом, результаты проведенного исследования продемонстрировали эффективность комбинированного метаболитного препарата в снижении постинфекционной астении (тест астении), выраженности дестабилизации симпатической нервной системы (тест Кердо), уменьшении процессов истощения ЦНС (методика 10 слов), повышении эффективности работы и степени врабатываемости (тест Шульте) и снижении влажности кожных покровов. Отсутствие нежелательных явлений, а также отклонений в показателях гемограммы по окончании курса терапии в основной группе подтвердило высокий профиль безопасности исследуемого препарата.


