Генерализованные формы менингококковой инфекции (ГМФИ) занимают важное место среди инфекционных заболеваний центральной нервной системы в связи с тяжестью течения и высокой летальностью. Возможность развития ГМФИ обусловливается как восприимчивостью организма конкретного человека к инфекции, так и повышенными вирулентными свойствами возбудителя – бактерий вида Neisseria meningitidis.
На основании антигенных свойств капсульного полисахарида и характеристик генов, ответственных за синтез капсулы, выделено 12 серогрупп N. meningitidis [1]. При этом ГФМИ, за редким исключением, вызывают N. meningitidis серогрупп A, B, C, W, X и Y. На территории России в эпидемический процесс вовлечены N. meningitidis серогрупп A, B и C, данные о распространенности других серогрупп немногочисленны [2, 3]. Для определения серогрупп N. meningitidis традиционно применяют серологические методы (распространенной методикой является постановка реакции латекс-агглютинации, в которой детектируется взаимодействие капсульного полисахарида со специфическими сыворотками), однако в настоящее время все шире используют основанные на ПЦР методики исследования ввиду их очевидных преимуществ, неоднократно описанных ранее [4, 5].
 Для эпидемического процесса ГФМИ характерно чередование периодов подъема заболеваемости с периодами эпидемиологического благополучия. Во многих исследованиях было показано, что циклические колебания показателя заболеваемости ГФМИ могут быть связаны с изменением соотношения N. meningitidis различных серогрупп. С 1991 г. в России наблюдается период относительного эпидемиологического благополучия, длящийся до сих пор; заболеваемость в основном поддерживается за счет вовлечения в эпидемический процесс детей в возрасте до 2 лет [3]. При этом заболеваемость до 2005 г. превышала эпидемический порог, сохраняясь на уровне 2–3 случаев на 100 тыс. населения. В последнее десятилетие наблюдается дальнейшее снижение показателей заболеваемости, что не исключает возникновения новых периодов эпидемиологического неблагополучия [3, 6].
Для эпидемического процесса ГФМИ характерно чередование периодов подъема заболеваемости с периодами эпидемиологического благополучия. Во многих исследованиях было показано, что циклические колебания показателя заболеваемости ГФМИ могут быть связаны с изменением соотношения N. meningitidis различных серогрупп. С 1991 г. в России наблюдается период относительного эпидемиологического благополучия, длящийся до сих пор; заболеваемость в основном поддерживается за счет вовлечения в эпидемический процесс детей в возрасте до 2 лет [3]. При этом заболеваемость до 2005 г. превышала эпидемический порог, сохраняясь на уровне 2–3 случаев на 100 тыс. населения. В последнее десятилетие наблюдается дальнейшее снижение показателей заболеваемости, что не исключает возникновения новых периодов эпидемиологического неблагополучия [3, 6].
Небольшие подъемы заболеваемости ГФМИ в Москве в 1996 и 2003 гг. (также как и эпидемический подъем заболеваемости в 1968–1984 гг.) были связаны с циркуляцией N. meningitidis серогруппы А [2, 3, 7, 8]. В последние годы эпидемиологическую настороженность вызывает высокая (до 30%) доля N. meningitidis серогруппы А, выделяемых от больных ГФМИ [6], что диктует необходимость проведения внутривидовой характеристики циркулирующих штаммов с целью идентификации представителей наиболее вирулентных клональных комплексов [7, 8]. Ранее было показано, что представители одних и тех же серогрупп N. meningitidis различаются по вирулентности, и рост показателя заболеваемости ГФМИ может быть связан с присутствием на той или иной территории гипервирулентных штаммов N. meningitidis [7, 9–11]. Поэтому изучение особенностей и закономерностей распределения гипервирулентных штаммов является неотъемлемой частью эпидемиологического надзора за ГФМИ [2, 3, 10]. Для генетической и антигенной характеристики штаммов и внутривидовой классификации N. meningitidis с целью определения сиквенс-типов и принадлежности штаммов к клональным комплексам, обладающим разным эпидемическим потенциалом, применяют метод мультилокусного секвенирования-типирования (МЛСТ) в сочетании с характеристикой трех вариабельных фрагментов белков наружной мембраны [10, 12, 13]. Результаты, полученные с помощью МЛСТ, объединяются в международную базу данных http://pubmlst.org/neisseria/, которая позволяет сопоставлять результаты, полученные в разных лабораториях. На момент окончания исследования база данных http://pubmlst.org/neisseria/ содержала информацию о 35538 изолятах (11578 сиквенс-типов). Своевременное выявление неизвестных штаммов N. meningitidis или представителей гипервирулентных клональных комплексов в совокупности с данными о заболеваемости дает возможность оптимизировать планирование и проведение иммунопрофилактических и противоэпидемических мероприятий.
В связи с этим целью настоящей работы было проведение молекулярно-биологического мониторинга N. meningitidis, направленного, с одной стороны, на определение удельной доли серогрупп N. meningitidis, вызвавших случаи ГФМИ на территории Москвы, с другой стороны – на характеристику генетических свойств с целью проспективного анализа эпидемической опасности циркулирующих штаммов.
Материалы и методы
В рамках данной работы исследованы образцы биологического материала (кровь и спинномозговая жидкость) от 253 пациентов с ГФМИ, проходивших стационарное лечение в клинической инфекционной больнице № 2 г. Москвы с июня 2011 г. по декабрь 2015 г. Среди пациентов, включенных в исследование, было 107 детей в возрасте от 2 мес. до 18 лет и 146 взрослых в возрасте от 18 до 78 лет. Для сравнительного анализа выявленных частот серогрупп N. meningitidis использованы данные работы К.О. Миронова и соавт. [5], полученные на той же клинической базе в 2007–2010 гг.
 Для экстракции ДНК использовали набор реагентов РИБО-преп. Наличие в биологических образцах ДНК N. meningitidis определяли с использованием набора реагентов «АмплиСенс® N. meningitidis/H. influenzae/S. pneumoniae-FL» (ФБУН Центральный НИИ эпидемиологии Роспотребнадзора, Москва). Для определения серогрупповой принадлежности менингококков использовали методику на основе ПЦР в режиме реального времени для детекции серогрупп-специфических генетических локусов N. meningitidis серогрупп A, B, C и W [5]. Амплификацию проводили на приборе Rotor Gene3000/6000 («Corbett Research», Австралия).
Для экстракции ДНК использовали набор реагентов РИБО-преп. Наличие в биологических образцах ДНК N. meningitidis определяли с использованием набора реагентов «АмплиСенс® N. meningitidis/H. influenzae/S. pneumoniae-FL» (ФБУН Центральный НИИ эпидемиологии Роспотребнадзора, Москва). Для определения серогрупповой принадлежности менингококков использовали методику на основе ПЦР в режиме реального времени для детекции серогрупп-специфических генетических локусов N. meningitidis серогрупп A, B, C и W [5]. Амплификацию проводили на приборе Rotor Gene3000/6000 («Corbett Research», Австралия).
МЛСТ N. meningitidis проводили согласно международным требованиям [13] по методике К.О. Миронова и соавт. [12]. Для секвенирования использовали реагенты и оборудование фирмы «Applied Biosystems» (США). Присвоение номеров аллелям, сиквенс-типам и клональным комплексам, а также сопоставление результатов исследования с зарубежными данными проведено с использованием базы данных http://pubmlst.org/neisseria/.
Результаты и обсуждение
Серогруппы N. meningitidis
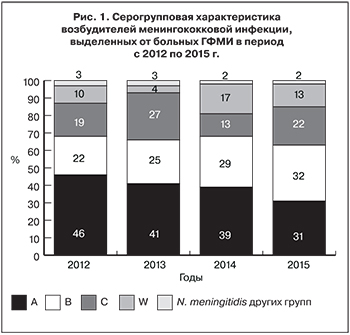
Использованная методика [5] позволила определить серогруппу N. meningitidis в 247 клинических образцах, что составляет 98% от всех образцов, включенных в исследование. Выявлено следующее распределение: серогруппа А найдена в 99 (39%) образцах, серогруппа В – в 73 (29%), серогруппа С – в 48 (19%) и серогруппа W – в 27 (11%); в 6 (2%) образцах обнаружена ДНК N. meningitidis других серогрупп. Таким образом, в этиологической структуре ГФМИ на территории Москвы N. meningitidis серогруппы А по-прежнему занимают первое место. В то же время в течение последних четырех лет наблюдается устойчивая тенденция к снижению процентного соотношения N. meningitidis серогруппы A, а в 2014–2015 гг. – повышение доли N. meningitidis серогрупп B и W, в то время как колебания доли N. meningitidis серогрупы С не позволяют говорить о каких-либо выраженных закономерностях (рис. 1).
В исследовании [5], проведенном в период с 2007 по 2010 г., были изучены образцы спинномозговой жидкости, полученные от больных ГФМИ на той же клинической базе. В периоды с 2007 по 2010 и с 2011 по 2014 гг. было исследовано сопоставимое количество биологических образцов, содержащих ДНК N. meningitidis: 187 и 185 соответственно. Среди образцов, полученных в 2007–2010 гг., 103 (55%) содержали N. meningitidis серогруппы A, 45 (24%) – серогруппы B, 30 (16%) – серогруппы С, 5 (3%) – серогруппы W; в 4 (2%) образцах были обнаружены N. meningitidis других серогрупп. Результаты исследования образцов, полученных в 2011–2014 гг., демонстрируют снижение процентного соотношения N. meningitidis серогруппы A, на долю которых пришлось 78 (42%) образцов. В 51 (27%) образце была обнаружена N.meningitidis серогруппы В, в 33 (18%) – серогруппы С, в 18 (10%) – серогруппы W, а в 5 (3%) – N. meningitidis других серогрупп. Таким образом, доля N. meningitidis серогруппы W выросла по сравнению с предыдущим четырехлетним периодом более чем в 3 раза: с 3 до 10%.
Так как максимальный уровень заболеваемости ГФМИ регистрируется среди детей (по данным за 2014 г., в структуре пациентов с ГФМИ доля детей до 17 лет составляет 71% [6]), был проведен анализ распределения выявленных серогрупп N. meningitidis в разных возрастных группах. Среди пациентов было 146 взрослых в возрасте старше 18 лет и 107 детей в возрасте моложе 18 лет, из которых в возрастной группе до 5 лет было 67 человек и в возрастной группе от 5 до 18 лет – 40 человек.
Полученные результаты свидетельствуют, что серогрупповая структура N. meningitidis, выделенных от больных ГФМИ моложе 18 лет, существенно отличается от распределения серогрупп, наблюдаемого у взрослых. Среди взрослых пациентов с ГФМИ на долю N. meningitidis серогруппы А приходится почти половина всех случаев, в то время как среди детей младше 5 лет – меньше четверти. Кроме того, соотношение N. meningitidis разных серогрупп варьирует в зависимости от возраста. У детей младше 5 лет наиболее часто встречаются N. meningitidis серогруппы В, доля N. meningitidis серогруппы А в возрастной группе от 5 до 18 лет и у взрослых примерно одинакова, а доли N. meningitidis серогруппы С существенно отличатся (рис. 2).
МЛСТ N. meningitidis
Поскольку циркуляция N. meningitidis серогруппы W не характерна для территории Москвы и России в целом [2, 3, 12], помимо традиционного мониторинга циркулирующих генетических субгрупп N. meningitidis серогруппы А [2, 7], было принято решение провести исследование генетических свойств N. meningitidis серогруппы W, циркулирующих в наблюдаемый период.
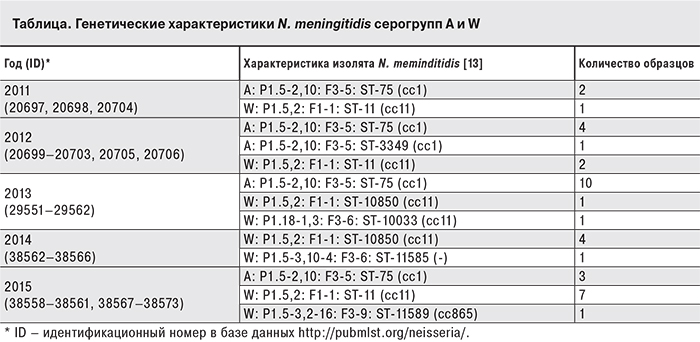
Методом МЛСТ в сочетании с антигенной характеристикой [13] было исследовано 38 биологических образцов, содержащих ДНК N. meningitidis серогрупп А (20 образцов) и W (18 образцов). Характеристики исследованных N. meningitidis представлены в таблице.
Все N. meningitidis серогруппы А входили в клональный комплекс ST-1 complex/subgroup I/II, и принадлежали генетической субгруппе X [7, 12].
Циркуляция N. meningitidis серогруппы А, входящих в клональный комплекс ST-1 complex/subgroup I/II, характерна для межэпидемического периода на наблюдаемой территории, и выделение от больных ГФМИ представителей этого клонального комплекса не ассоциировано с осложнениями эпидемиологической обстановки. Характерно присутствие на территории Москвы N. meningitidis с сиквенс-типом ST-75: данный сиквенс-тип выявлялся у большинства N. meningitidis серогруппы А, начиная с 2006 г. [7]. В связи с этим эпидемиологическая обстановка, обусловленная N. meningitidis серогруппы А, может расцениваться как стабильная и не вызывающая опасений.
При проведении МЛСТ N. meningitidis серогруппы W однократно было найдено 2 новых сиквенс-типа, не встречавшихся ранее: ST-11585 и ST-11589. Все остальные N. meningitidis серогруппы W входят в клональный комплекс ST-11 complex/ET-37 complex и в подавляющем большинстве имеют сиквенс-тип ST-11, найденный в 15 клинических образцах. Клональный комплекс ST-11 complex/ET-37 complex является вторым по объему клональным комплексом, характерным для зарубежных штаммов (содержит около 13% всех N. meningitidis, записи о которых присутствуют в базе данных http://pubmlst.org/neisseria/). Входящие в этот клональный комплекс N. meningitidis ранее неоднократно выделялись в течение эпидемических подъемов заболеваемости во многих странах мира, начиная c 1990-х годов [9–11].
Наблюдаемая в течение многих лет невысокая частота выделения от российских больных ГФМИ N. meningitidis серогруппы W [2] не позволяет говорить об эпидемической опасности этих штаммов, что подтверждает спорадический характер заболеваемости ГФМИ, обусловленными представителями этой серогруппы, на наблюдаемой территории. До проведения данного исследования было проведено МЛСТ 15 N. meningitidis серогруппы W, выделенных в нескольких регионах России, начиная с 1999 г. Практически все они входили в клональный комплекс ST-11 complex/ET-37, имели сиквенс-тип ST-11 и антигенный профиль W: P1.5,2: F1-1 (http://pubmlst.org/neisseria/). Однократное выделение других сиквес-типов у N. meningitidis серогруппы W, циркулирующих на территории России, не позволяет говорить о повышенных вирулентных свойствах этих штаммов или их эпидемической опасности. В то же время такие параметры течения эпидемического процесса, как увеличение доли N. meningitidis серогруппы W, выделенных от больных ГФМИ, увеличение показателя заболеваемости среди взрослого населения и/или увеличение количества N. meningitidis, выделенных от больных ГФМИ, принадлежащих клональному комплексу ST-11 complex/ET-37 complex, должны расцениваться как предвестники осложнения эпидемиологической обстановки.
Таким образом, в этиологической структуре ГФМИ на территории Москвы N. meningitidis серогруппы А по-прежнему занимают первое место. В то же время на протяжении последних 4 лет наблюдается тенденция к снижению доли N. meningitidis серогруппы А (с 46 до 31%), а в 2014–2015 гг. – к увеличению N. meningitidis серогруппы W (более 10%). Большинство заболевших ГФМИ, обусловленными N. meningitidis серогруппы А – взрослые, а среди детей младше 5 лет основным этиологическим агентом ГМФИ выступали N. meningitidis серогруппы B.
Результаты генотипирования с помощью МЛСТ демонстрируют присутствие на территории Москвы N. meningitidis серогруппы А, входящих в клональный комплекс ST-1 complex/subgroup I/II (генетическая субгруппа X), характерный для межэпидемического периода и не ассоциированный с активизацией эпидемического процесса. Наблюдаемое увеличение доли N. meningitidis серогруппы W, а также выявление представителей гипервирулентного клонального комплекса ST-11 complex/ET-37 complex диктуют необходимость дальнейшего мониторинга циркуляции этих штаммов с целью определения их эпидемиологической значимости для наблюдаемой территории.


