В последние годы особую медико-социальную значимость приобрели внутриутробные инфекции, а среди них – инфекции TORCH-группы, основные из которых – токсоплазмоз, краснуха, цитомегаловирусная инфекция и герпетическая инфекция, вызываемая вирусами простого герпеса 1-го и 2-го (ВПГ-1 и ВПГ-2) типов. Первичное инфицирование возбудителями этих заболеваний в период беременности, а также реинфекция могут повлечь тяжелые нарушения в развитии плода и являются одной из ведущих причин детской смертности в раннем неонатальном периоде [1–3]. В связи с этим исключительно важной становится возможность тотального лабораторного мониторинга групп риска по этим инфекциям – супружеских пар, планируюших беременность, беременных женщин, новорожденных и детей в возрасте до 1 года – на наличие в их крови маркеров соответствующих возбудителей [4–6].
Для организации такого мониторинга необходимо наличие высокоэффективных и вместе с тем достаточно доступных средств лабораторной диагностики. Первому требованию удовлетворяет большинство как импортных, так и отечественных тест-систем для диагностики инфекций TORCH-группы. Однако полное скрининговое обследование одного пациента группы риска потребует проведения целого ряда исследований методом иммуноферментного анализа (ИФА) с использованием порядка 10 отдельных иммуноферментных тест-систем (ИФТС): 5 – для выявления антител класса M к каждому возбудителю и 5 – для выявления IgG к ним. Общая стоимость и продолжительность таких исследований делает проблематичной организацию лабораторных исследований такого масштаба [7].

Способом решения задачи, очевидно, может стать применение тест-систем, позволяющих одновременное выявление соответствующего класса антител ко всем четырем основным возбудителям TORCH-инфекции. В мировой лабораторной практике такие тест-системы уже используются, например: «RecomLine TORCH Screening IgG» и «RecomLine TORCH Screening IgM» фирмы «Mikrogen Diagnostik» (Германия), а также «TORCH Profile IgG/М» фирмы «EUROIMMUN» (Германия). Однако отечественных тест-систем такого рода пока нет.
Целью исследования явилась разработка тест-системы, позволяющей при проведении одного анализа одновременно выявить наличие антител к каждому из возбудителей инфекций TORCH-группы методом линейного иммуноблоттинга (ИБ). В данном методе иммуносорбент представляет собой стрип из нитроцеллюлозной мембраны с нанесенными на него в заданных местах линиями антигенов, наличие и интенсивность окраски которых предполагается оценивать. В настоящем сообщении представлены результаты первой части разработки новой тест-системы «Лайн-Блот TORCH-профиль», которую можно применять для выявления антител класса G к возбудителям основных инфекций TORCH-группы («Лайн-Блот TORCH-профиль-IgG»).
Материалы и методы
Иммуносорбент – разрезанная на стрипы нитроцеллюлозная мембрана производства фирмы «PROTRANS» (Германия), на которой в виде дискретных линий были иммобилизованы очищенные нативные и рекомбинантные антигены:
- нативный антиген TOXOPLASMA GONDII производства фирмы «Fitzgerald» (США), кат. № 30R-AT015 и рекомбинантный аналог токсоплазменного антигена р30 rec. (SAG 1) фирмы «DSI» (Италия), кат. № ATG 401a;
- нативный антиген вируса краснухи производства фирмы «Fitzgerald» (США), кат. № 30-1330 или фирмы «Biokit» (Испания), кат. № 3000–5205 3000–5203, а также международный стандарт ВОЗ Anti-Rubella immunoglobulin, Human NIBSC code: RUBI-1-94, представляющий собой IgG человека к вирусу краснухи в концентрации 15–20 МЕ/мл;
- рекомбинантный аналог мозаичного антигена цитомегаловируса (ЦМВ), содержащего иммунодоминантные последовательности белков рр150, рр52, рр28 и gB производства ЗАО «ЭКОлаб»;
- рекомбинантные аналоги антигена G1 ВПГ-1 и антигена G2 ВПГ-2 производства ЗАО «ЭКОлаб».
Кроме этих линий на стрипе имеются 3 контрольные линии, две из них – «+0,5» и «+2,0» – это человеческие IgG (фирм «ИМТЕК» или «Микроген», Россия) в разных концентрациях.
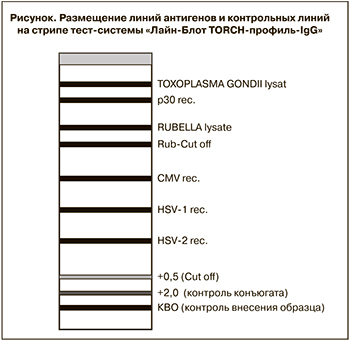 Линия «+0,5» служит линией критического уровня интенсивности окрашивания Cut off (то есть менее интенсивное окрашивание позволяет расценивать соответствующий результат как отрицательный, а более интенсивное – как положительный). Линия «+2,0» (она же линия контроля конъюгата) служит для контроля правильности выполнения анализа на этапе внесения конъюгата.
Линия «+0,5» служит линией критического уровня интенсивности окрашивания Cut off (то есть менее интенсивное окрашивание позволяет расценивать соответствующий результат как отрицательный, а более интенсивное – как положительный). Линия «+2,0» (она же линия контроля конъюгата) служит для контроля правильности выполнения анализа на этапе внесения конъюгата.
Вместе линии «+0,5» и «+2,0» позволяют полуколичественно оценивать интенсивность окрашивания полос, соответствующих антигенам возбудителей инфекции токсоплазмоза, ЦМВ-инфекции и герпеса 1-го и 2-го типов. Интенсивность окрашивания антигенной линии возбудителя краснухи оценивается в сравнении с интенсивностью окрашивания линии Rub-Cut off (табл. 1).
Третья контрольная линия – КВО (контроль внесения образца) – козьи антитела к IgG-антителам человека (фирмы «ИМТЕК», Россия) служит для контроля правильности выполнения анализа на этапе внесения исследуемого образца в зону реакции.
Размещение линий на стрипе показано на рисунке.
Окрашивание антигенных линий возбудителей токсоплазмоза, ЦМВ-инфекциии, простого герпеса 1-го и 2-го типов выше «+0,5» говорит о наличии в исследуемом образце соответствующих антител и о необходимости более подробного исследования иммунного статуса пациента.
Наличие на стрипе дополнительной полосы рекомбинантного аналога токсоплазменного антигена р30 позволяет ориентировочно оценить сроки инфицирования, поскольку окрашивание обеих полос (TOXOPLASMA GONDII lysate и р30 rec.) позволяет исключать первичную инфекцию в течение последних 3 месяцев.
Дополнительную информацию об иммунном статусе пациента относительно вируса краснухи дает также полоса контроля вакцинации Rub-Cut off. Концентрация IgG- антител против вируса краснухи, равная 15–20 МЕ/мл, по международным стандартам считается минимальной, обеспечивающей защитный уровень иммунитета организма. Поэтому сравнение интенсивности окрашивания этой линии и линии нативного антигена краснухи (RUBELLA lysate) позволяет судить о наличии или отсутствии достаточного количества антител к этому вирусу в организме пациента. Соответственно интенсивность окрашивания антигенной линии RUBELLA lysate выше «+0,5» говорит о наличии иммунитета к вирусу краснухи у данного пациента.
В состав тест-системы входят следующие компоненты:
- иммуносорбент – промаркированные стрипы из нитроцеллюлозной мембраны с нанесенными на них антигенами и контрольными линиями;
- конъюгат – козьи антитела к IgG человека, конъюгированные со щелочной фосфатазой в стабилизирующем растворе;
- РРО – раствор для разведения образцов;
- ПР(х10) – 10-кратный концентрат промывочного раствора;
- СР – субстратный раствор.
Результаты
Исследования были начаты с оценок диагностической чувствительности и специфичности новой тест-системы на сыворотках стандартных коммерческих панелей, содержащих и не содержащих антитела к антигенам возбудителей инфекций TORCH-группы:
- «Стандарт АТ-G(+/-)ВПГ-1,2» (ОСО 42-28-373-04) – стандартная панель сывороток, содержащих и не содержащих антитела класса G к ВПГ-1 и ВПГ-2 (ЗАО «МБС», Россия; кат. № SGS-36);
- «Стандарт АТ-G(+/-)ЦМВ» (ОСО 42-28-360-01) – стандартная панель сывороток, содержащих и не содержащих антитела класса G к ЦМВ (ЗАО «МБС», Россия; TGS-24);
- «Стандарт АТ-G(+/-)T. gondii» – стандартная панель сывороток, содержащих и не содержащих антитела класса G к Toxoplasma gondii (ЗАО «МБС», Россия; TGC-8);
- «Рубелла – контрольная панель сывороток» – лиофилизированные сыворотки, содержащие и не содержащие иммуноглобулины классов М и G (низкоавидные и высокоавидные) к вирусу краснухи (ЗАО «Вектор-Бест», Россия; кат. № D-2558).
В этих испытаниях было получено полное совпадение оценок сывороток в новой тест-системе с их паспортными характеристиками, то есть была показана 100% диагностическая чувствительность и специфичность тест-системы «Лайн-Блот TORCH-профиль-IgG».
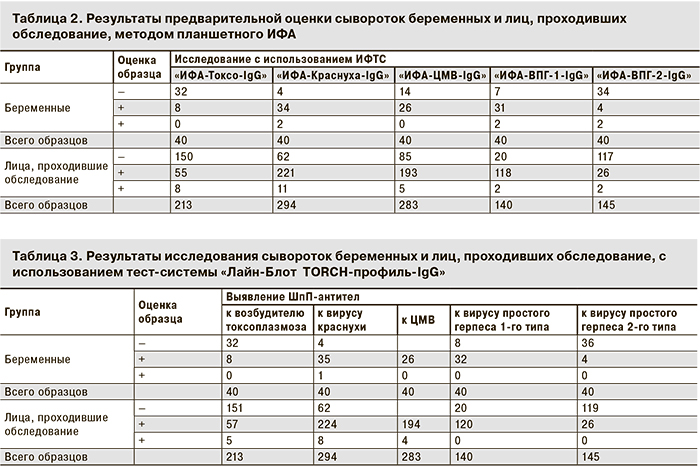
Высокая диагностическая эффективность новой тест-системы была показана также при исследовании сывороток беременных женщин и лиц, проходивших плановое или специализированное (по назначению врача) обследование. Соответствующие образцы были получены в диагностическом центре «El Clinic» (г. Электрогорск) и в ОПК МУЗ «Павлово-Посадская ЦРБ».
Предварительно все эти образцы были исследованы методом ИФА с использованием соответствующих тест-систем производства ЗАО «ЭКОлаб». Полученные при этом данные представлены в табл. 2 и 3.
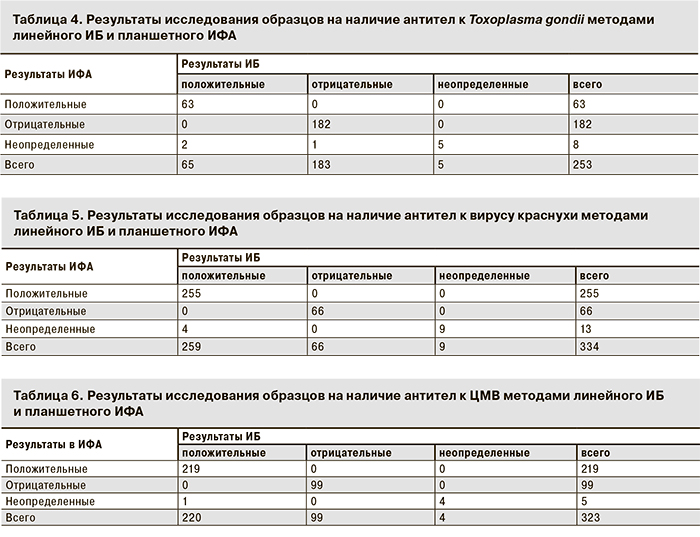
Результаты, полученные при исследовании сывороток беременных и лиц, проходивших обследование, с использованием ИФТС и тест-системы «Лайн-Блот TORCH-профиль-IgG», перераспределенные по каждой инфекции, представлены в табл. 4–8.

Как следует из приведенных в таблицах данных, получено практически полное совпадение оценок образцов, исследованных методами ИФА и ИБ – из 1115 образцов результаты оценок не совпали только по 16 (3 – по Toxoplasma gondii, 4 – по вирусу краснухи, 1 – по ЦМВ, 4 – по ВПГ-1 и 4 – по ВПГ-2).
Эти 16 образцов были дополнительно исследованы в тест-системе «RecomLine TORCH Screening IgG» фирмы «Mikrogen Diagnostik» (Германия). Полученные результаты представлены в табл. 9.
Как видно из данных, приведенных в табл. 9, оценки образцов, полученные с помощью этих двух тест-систем, большей частью совпадают, то есть при разночтениях в скрининговых оценках методами ИФА и ИБ в большинстве случаев следует ориентироваться на данные ИБ.
Таким образом, ИБ традиционно рассматривается как тест, используемый для подтверждения результатов скрининговых исследований. Однако, как показали специалисты фирм «Mikrogen Diagnostik» и «Euroimmun» (Германия), использование формата line-blot позволяет эффективно применять ИБ и для скрининга, в частности, на наличие антител к возбудителям инфекций TORCH-группы – для этого достаточно разместить на стрипе наиболее иммунокомпетентные антигены этих возбудителей.
Эффективность такого подхода полностью подтверждена результатами настоящего исследования. Новая тест-система «Лайн-Блот TORCH-профиль-IgG», на стрипы (иммуносорбент) которой нанесены соответствующие антигены пяти возбудителей инфекций TORCH-группы, может быть адекватной заменой пяти скрининговых ИФТС как по диагностической эффективности, так и по конечной стоимости единичного исследования.


