Концепция биохимического паспорта человека (6 субстратов и 6 ферментов) является результатом двадцатилетней исследовательской работы д-ра мед. наук, специалиста в области биохимии и патофизиологии И.М. Рослого. Он лично выполнил более 500 000 исследований сывороток крови на клинической базе Центрального НИИ эпидемиологии (ЦНИИЭ)Роспотребнадзора, в Инфекционной клинической больнице (ИКБ) № 2 и в роддоме при ИКБ № 2, в Московском научно-практическом центре наркологии при наркологической больнице № 17, в детском консультативно-диагностическом центре Научного медико-хирургического центра им. Н.И. Пирогова (Москва).
В исследование были включены пациенты с инфекционной патологией (менингококковая инфекция, вирусные гепатиты, инфекционный мононуклеоз, корь, пищевая токсикоинфекция, сальмонелез, дизентерия) и больные с алкогольной зависимостью. Биохимические данные анализировали с учетом тяжести течения патологического процесса, возраста, пола, наличия преморбидного фона и метаболической сущности наблюдаемых сдвигов в сравнении с различными группами контроля, а также с учетом особенностей биохимического паспорта у беременных женщин, новорожденных детей и у здоровых людей в условиях экспериментальной гипоксии (студенты) и в состоянии хронического стресса (педагоги).
Уровни субстратов в сыворотке крови (общего белка, альбумина, глюкозы, холестерина, мочевины, креатинина) и активность ключевых метаболических ферментов [аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), гаммаглутамилтранспептидазы (ГГТП), лактатдегидрогеназы (ЛДГ), щелочной фосфатазы (ЩФ) и креатинфосфокиназы (КФК)] определяли на биохимических анализаторах класса OLLI 3000 (Финляндия), ABBOT Lab. (США), HITACHI 902 (Япония) и Beckman Coulter (США) с обязательным использованием калибровочных и контрольных материалов. В рамках выполняемой работы канд. мед. наук Е.Г. Фокиной были проведены клинические наблюдения, исследования системы гемостаза, изучение историй болезни и систематизация клинико-лабораторных данных по дифтерии ротоглотки, лакунарной ангине, роже лица и роже нижних конечностей.
По результатам исследования 15 ноября 2013 г. в ЦНИИЭ Роспотребнадзора состоялся дискуссионный круглый стол «Адаптационные механизмы при дифтерии и роже».
Обсуждались актуальные вопросы патогенеза, диагностики и тактики ведения пациентов с инфекционной патологией (дифтерия и рожа):
- Восстановление метаболических показателей – путь к выздоровлению. Интерпретация физиологического смысла ферментемии с позиций гуморальных адаптационных механизмов.
- Биохимический паспорт человека – 6 субстратов и 6 ферментов – путь к персонифицированной медицине.
- Биохимические признаки лихорадочно-интоксикационного синдрома при дифтерии и роже. Адекватный порог термогенеза и глюконеогенеза. КФК в роли фермента срочной адаптации и универсального мембранопротектора.
- Отек подкожной клетчатки при дифтерии – защитный механизм? Сравнение с отеком при роже.
- Сравнение изменений гемостаза при дифтерии и роже. Саногенетический уровень гиперкоагуляции и фибринолиза. Морфофункциональные свойства тромбоцитов и эритроцитов в динамике наблюдения.
- Влияние преморбидного фона на работу адаптационных механизмов при дифтерии (алкоголизм) и при роже (ожирение, онихомикоз).
Краткую информацию по обсуждаемой проблеме представила Е.Г. Фокина. Главная тема ее сообщения – обоснование физиологического смысла ферментемии, при котором традиционное сравнение получаемых результатов с «усредненными» величинами не отражает истинного смысла происходящих в организме биохимических превращений адаптационной направленности. В рамках первого вопроса «Восстановление метаболических показателей – путь к выздоровлению» было озвучено новое направление интерпретации клинико-лабораторных (биохимических) сдвигов: а) ферменты крови работают в комплексе друг с другом и регулируют обменные процессы как внутри, так и между клетками; б) организм запускает синтез ряда ключевых ферментов для возврата в состояние здоровья; в) комбинации ферментов могут быть различными, во многом определяются типом инфекционного заболевания и работают как адаптационные механизмы.
Автор доклада подчеркнула, что уровень ферментемии определяет интенсивность и направленность метаболических потоков, а количества циркулирующих в кровотоке ферментов являются мерилом патофизиологических (адаптационных) сдвигов. Чем больше молекул фермента присутствует в крови, тем выше его активность, а значит – выше интенсивность биохимических процессов (на примере данных по дифтерии ротоглотки и роже). Следовательно, в основу оценки активности ферментов крови должен быть положен принцип обоснования физиологического смысла ферментемии, а традиционное сравнение получаемых результатов с «усредненными» величинами не отражает истинного смысла происходящих в организме биохимических превращений и их адаптационную направленность.
На примере АСТ – ведущего показателя биоэнергетики – была продемонстрирована корреляция физиологических и биохимических показателей. Например, у крысы температура тела – 39–40 °C, пульс – 240 ударов в минуту, общий белок – 65 г/л, уровень АСТ – 400 МЕ/л (рис. 1, см. на вклейке)
У новорожденного ребенка температура тела – 36,6 °C, пульс – 120–140 ударов в минуту, число дыханий – до 40 в минуту, общий белок – 64 г/л, уровень АСТ – до 200 МЕ/л. У взрослого человека температура тела – 36,6 °C, пульс – 60–80 ударов в минуту, число дыханий – 16 в минуту, общий белок – 75–85 г/л, уровень АСТ – 30 МЕ/л с возможным повышением до 50 МЕ/л (рис. 2, см. на вклейке).
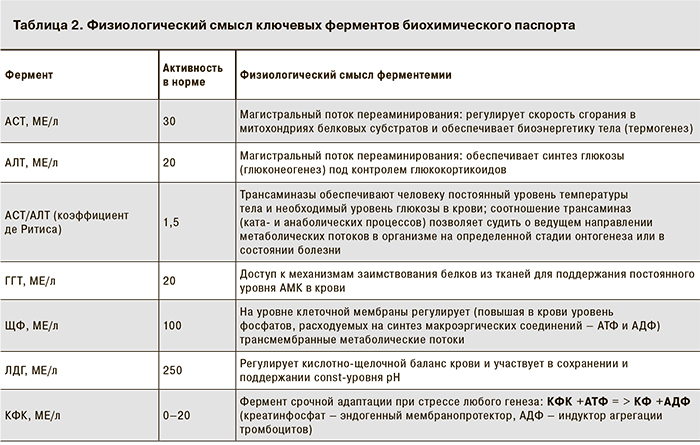
В выступлении д-ра мед. наук И.М. Рослого озвучена важность пересмотра оценки традиционных подходов к ферментемии как к признаку цитолиза клеток и обсуждения прикладной задачи исследования – формирование биохимического паспорта человека (табл. 1 и 2).
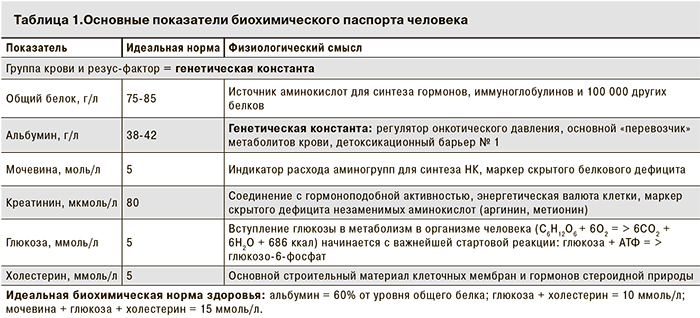
И.М. Рослый, обобщая формат биохимического паспорта, уточнил, что АСТ – это прежде всего характеристика (!) и ключевой регулятор термогенеза; АЛТ управляет активностью глюконеогенеза и контролируется уровнем глюкокортикоидов в крови; коэффициент де Ритиса (АСТ/АЛТ) отражает соотношение ката- и анаболических потоков метаболизма; ГГТ позволяет использовать аминокислотный ресурс тканей и является индикатором тканевой подпитки; ЩФ регулирует трансмембранные межклеточные потоки и через изменение фосфатного потенциала (запас макроэргических соединений) влияет на мощность биоэнергетических процессов; ЛДГ регулирует окислительно-восстановительные процессы в организме и определяет постоянный уровень рН крови; КФК, будучи самым лабильным показателем (интервал колебаний – от 0,1 до 25 000 МЕ/л) является ферментом срочной адаптации при стрессе любого генеза (рис. 3, см. на вклейке). Эти 6 ферментов отражают разнообразие адаптационных механизмов в организме, а не соотношение разрушенных гепатоцитов и миокардиоцитов [1–3].
Согласно полученным результатам исследования системы гемостаза было установлено, что при дифтерийной инфекции ведущим звеном развития тромбогеморрагических нарушений выступают тромбоциты, тогда как при рожистом воспалении – эритроциты [4, 5].
Тот факт, что дирижером геморрагических нарушений при дифтерии является тромбоцитарное звено, подтверждают глубокая тромбоцитопения (число клеток снижалось до 23 000–60 000 × 109/л при токсических формах дифтерии) и угнетение АДФ-индуцированной агрегационной активности пластинок на 50% и более. Морфофункциональные свойства эритроцитов при дифтерии страдали в меньшей степени: COЭ снижалось в среднем до 20 мм/час, агрегация клеток на индукторе протамина сульфате (ПС) снижалась умеренно (на 17%) и составила 51% при контрольном значении 61%.
Нарушения гемостаза сочетались с глубоким угнетением процессов синтеза белков в организме больного (специфическое действие дифтерийного токсина), выявляемых в динамических лабораторных (биохимических) и в экспериментальных исследованиях. Следовательно, при токсических формах дифтерии тромбоцитопения первой недели болезни может быть не только признаком развития тромбогеморрагического синдрома, но и результатом недостаточного поступления кровяных пластинок в кровоток из костного мозга, вызванных угнетением процессов синтеза белков и замедлением скорости роста новых клеток и темпов «отшнуровки» тромбоцитов от мегакариоцитов.
Дирижером геморрагических нарушений при роже является эритроцитарное звено и эндотелий сосудистой стенки. Морфофункциональные характеристики тромбоцитов страдают в меньшей степени, чем эритроцитов. Рожистое воспаление характеризуется глубоким угнетением всей биоэнергетики пациента и развертывается на уровне НАД-зависимых окислительных процессов. Специфическое действие β-гемолитического стрептококка проявляется в первую очередь на морфофункциональных свойствах эритроцитов, которые являются главным транспортировщиком НАД-зависимых ферментов. В динамике наблюдения за больными рожей нижних конечностей при достаточном (!) орошении тканей кислородом содержание эритроцитов в крови уменьшается, нарастает СОЭ, увеличивается средний объем эритроцитов и частота спонтанного гемолиза, о чем сообщают и другие авторы [6, 7]. Увеличивается процент эритроцитов шарообразной формы вместо нормальной дисковидной. Страдают конформационные свойства мембраны эритроцита: она становится уязвимой для агрессивных воздействий. Этот факт подтвержден в экспериментальных условиях Е.Г. Фокиной. Для изучения агрегации кровяных шариков (in vitro) использовался раствор трехвалентного хлористого лантана и раствор ПС. Под действием LaCl3 эритроциты у обследованных больных рожей нижних конечностей быстрее агрегировали между собой, образуя быстро оседающие на дно пробирки крупные конгломераты (рис. 4, см. на вклейке). Агрегация повреждённых β-гемолитическим стрептококком кровяных шариков была выше нормы на 10% в начале заболевания (1–4-й день), увеличивалась еще на 17% к 8–12-му дню и на 21% – к 14-му дню болезни.
Механизм агрегации, индуцированной хлористым лантаном, основан на образовании мостиков между отрицательными зарядами карбоксильных групп сиаловой кислоты на мембране эритроцитов и положительными зарядами LaCl3. Действие индуктора приводит к конформационной перестройке эритроцитов: они утрачивают дисковидную форму, превращаются в стоматоциты и легко агрегируют друг с другом, образуя крупные конгломераты. Агрегаты, образованные введением другого индуктора – 0,1% раствора ПС (лекарственный препарат белковой природы из натурального сырья – лососевых рыб; вызывает агрегацию эритроцитов по мере абсорбирования на эритроцитах белковых субстратов, которые постепенно нейтрализуют отрицательный заряд мембраны по мере осаждения белков) – значительно меньших размеров (см. рис. 4, на вклейке).
Следовательно, при рожистом воспалении мембрана эритроцитов утрачивает свою эластичность/устойчивость и легко теряет воду. При неблагоприятных условиях клетки быстро склеиваются, разрушаются, образуют агрегаты и тем самым способствуют микротромбированию сосудов.
Е.Г. Фокина уточнила, что участие сосудистой стенки в патогенезе развития геморрагических нарушений при роже подтверждено трехкратным повышением уровня фактора Виллебранта (fW) – специфического маркера поражения эндотелия кровеносных сосудов. Среднее значение fW в обследуемой группе из 60 больных рожей нижних конечностей составило 192%, разброс колебаний был от 165 до 220% (при норме в группе здоровых лиц 150,4 ± 19%). Уровень fW оставался достоверно высоким в динамике стационарного наблюдения у всех больных рожей.
В обсуждении представленных Е.Г. Фокиной материалов приняли участие: директор НИИ общей патологии и патофизиологии, акад. РАН, проф. А.А. Кубатиев; директор НИИ общей реаниматологии им. В.А. Неговского член-корр. РАН, проф. В.В. Мороз; директор ЦНИИЭ Роспотребнадзора акад. РАН, проф. В.И. Покровский; заведующая кафедрой инфекционных болезней Российской медицинской академии последипломного образования, заслуженный врач РФ, проф. Н.М. Беляева; профессор кафедры инфекционных болезней лечебного факультета Первого Московского государственного медицинского университета им. И.М. Сеченова д-р мед. наук А.А. Еровиченков; руководитель лабораторной службы больницы им. С.П. Боткина (Москва) канд. мед. наук В.Г. Жуховицкий; а также заведующий лабораторией молекулярных механизмов инфекций ЦНИИЭ акад. РАМН, проф. В.А. Юркив.
Идею адаптационной оценки уровня ферментемии в крови поддержали все участники круглого стола. Акад. РАН А.А. Кубатиев обратил внимание на значимость в развитии инфекционного процесса не только процессов катаболизма и угнетения синтеза белка на молекулярном уровне, но и развития стресса эндоплазматического ретикулума на надмолекулярном уровне. Он уточнил, что формирование клеточного стресса проявляется, во-первых, угнетением мощности рибосомального аппарата, во-вторых, развитием синдрома незавершенного фолдинга (нарушение синтеза белка на уровне третичной структуры) и уже потом (!) завершается клеточным апоптозом.
Акад. РАН А.А. Юркив отметил, что энзимология в настоящий момент должна находиться в симбиозе с молекулярной биологией. При проведении современных научных исследований важно понимание того, что любая мутация гена, проявляющаяся на этапе синтеза последовательности аминокислотной цепочки, изменяет нативные свойства фермента. На уровне макроорганизма это проявляется «слабым звеном» в формировании адекватных адаптационных механизмов.
Канд. мед. наук В.Г. Жуховицкий указал на важность учета практическими врачами факторов патогенности микроорганизма. Инфекционный процесс – это всегда взаимодействие макро- и микроорганизма. Свойства возбудителя во многом влияют на выбор механизмов защиты на уровне макроорганизма, что выглядит как реализация различных вариантов гуморальной (адаптационной) защиты.
Член-корр. РАН В.В. Мороз привлек внимание присутствующих к вопросу интерпретации получаемых лабораторных данных в неразрывной связи с клиническим статусом инфекционных больных, отметив, что показатели общего белка, альбумина и ферментемии врачу всегда следует оценивать в динамике наблюдения (!), исходя из объективного состояния больного и характера проводимой терапии. Развивая эту мысль, он заметил, что при норме белка в крови 75–85 г/л уровень белка свыше 85 (88; 90) г/л следует оценивать критически: не является ли он следствием сгущения крови на фоне обезвоживания и терапии диуретиками. Подсказкой врачу в данном случае будет уровень гематокрита.
Проф. Н.М. Беляева подтвердила, что дифтерия никуда не исчезла, новые случаи заболевания регистрируются и сейчас. Недавно в НИИ скорой помощи им. Н.В. Склифосовского (Москва) ей пришлось осматривать пациентку с дифтерией половых органов, у которой отек – типичный признак токсической дифтерии (согласно действующей классификации) – локализовался не только в области промежности, но и спускался до колен. Проф. Н.М. Беляева акцентировала внимание на недопустимости введения гигантских (от 1 до 7 млн EД) доз гетерогенной лошадиной противодифтерийной сыворотки, которые практиковались в начальный период эпидемии дифтерии 90-х годов, и напомнила о необходимости пересмотра классификации дифтерии и приведении ее в соответствие с международной практикой и накопленным в России клинико-эпидемическим опытом.
Проф. А.А. Еровиченков уделил особое внимание системному подходу к оценке результатов любого лабораторного исследования. Врач должен анализировать данные биохимических показателей в комплексе с данными клинического анализа крови. Он заметил, что направление, озвученное докладчиками Е.Г Фокиной и И.М. Рослым как «интерпретация физиологического смысла ферментемии с позиций гуморальных адаптационных механизмов», заслуживает внимания и дальнейшего изучения.
В завершение работы круглого стола директор ЦНИИЭ акад. РАН В.И. Покровский поблагодарил присутствующих за положительную оценку представленной на обсуждение научной работы. Комментируя выступление акад. РАН А.А Кубатиева, он подчеркнул, что в ЦНИИЭ стартовало исследование фагоцитирующих и опсонизирующих свойств тромбоцитов – одного из современных патофизиологических направлений.


