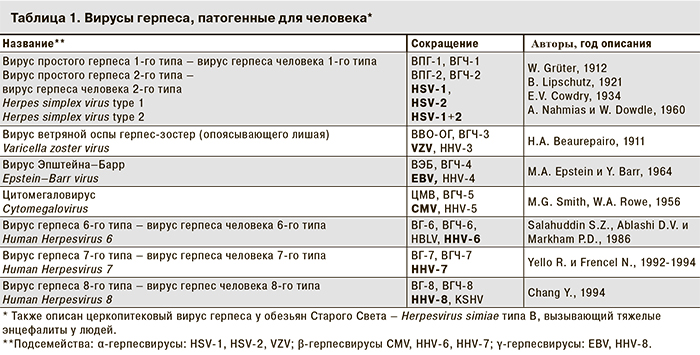
«Герпес» (греч. ερπυσμός – ползучий) известен врачам более 2500 лет. «Простуда», или «лихорадочный герпес» был описан римским врачом Геродотом в 100 г. до н. э. Упоминания о нем встречаются в трактатах «отцов медицины» – Гиппократа, Авиценны и Парацельса. C помощью биологических и иммунохимических методов при гибридизации ДНК описано более 100 представителей семейства Herpesviridae, из которых 9 патогенны для людей, а наибольшее клиническое, эпидемиологическое и медико-социальное значение имеют герпесвирусы человека (ГВЧ) первых шести типов (HSV-1, HSV-2, VZV, EBV, CMV, HHV-6). В табл.1. представлены основная классификация, принятые обозначения и год описания ГВЧ. При этом наиболее распространенные аббревиатуры выделены в колонке сокращений [1, 2; с дополнениями].
В настоящее время известно, что HSV-1 и HSV-2 имеют около 50% гомологии, содержат группы высоко консервативных генов для всех герпесвирусов (ГВ), поэтому обнаружение ДНК HSV-1+2 – это диагностический критерий простого герпеса. Инфицированность ГВ всего населения Земли (около 7 млрд человек) составляет от 65 до 100%, причем от 2 до 25% из них (от 120 до 1250 млн, что сопоставимо с населением Китая) ежегодно страдают рецидивирующими клиническими формами заболеваний, у 30% инфекция имеет субклиническую (латентную) форму, у 6–10% взрослых – генитальный герпес (ГГ), при этом в 15–20% случаев его причиной является HSV-1 (поражение кожи и слизистых оболочек).
Герпес является одной из самых распространенных вирусных инфекций в истории человека cо всеми признаками эпидемии [3–5] и занимает второе место после гриппа и ОРВИ в структуре всей инфекционной патологии.
В структуре ОРВИ не менее 5–16% случаев обусловлены HSV-1+2, CMV, EBV или их сочетанием [6–8]. Первичное инфицирование HSV-1 воздушно-капельным путем диагностировано у 50% детей к 7-летнему возрасту [1].
К концу XX и началу XXI века распространенность ГГ в популяции по сравнению с 80-ми годами прошлого столетия возросла в Азии на 7–14%, в Австралии – на 14%, в Европе – на 10–16%, в Африке – на 30–40%, в США – на 13–40% [9].
Крупномасштабные национальные исследования в США показали, что среди пациентов старше 12 лет инфицированность HSV-2 составляет в среднем 21,9% (25,6% среди женщин и 17,8% среди мужчин). Среди афроамериканцев инфицированность достигает в среднем 45,9%, среди белого населения – 17,6%, среди латиноамериканцев – 22,3% [9].
Антитела к HSV-2 выявляются у 4% обследованных учащихся колледжей, у 9% студентов университетов, у 25% представителей средних слоев общества; среди пациентов кожно-венерологических клиник с гетеросексуальной ориентацией – у 26%, с гомосексуальной ориентацией – у 46%; среди лиц, занимающихся коммерческим сексом – у 70–80%. Антитела к HSV-2 чаще выявляются у представителей негроидной расы, чем у белых, при этом женщины инфицируются чаще. Так, антитела к HSV-2 были обнаружены у 23% пациентов венерологических клиник Лондона, в то время как у доноров крови этот показатель составлял 8%.
По данным официальных исследований, проведенных в 10 наиболее развитых странах мира, серопозитивными к HSV-2 являются не менее 107 млн человек. Количество носителей HSV-2 еще в период с 1976 по 1992 г. в мире увеличилось на 30% [10]. Активное распространение герпесвирусных инфекций (ГВИ) связывают с сексуальной революцией 60-х годов. Герпес одним из первых был «удостоен чести» называться чумой XX века.
Распространенность хронических рецидивирующих ГВИ в США – 200–600 случаев на 100 тыс. населения, в Европе – 80, в РФ – не менее 16,3 [11].
В РФ обязательная регистрация ГГ введена в 1993 г. Полагают, что в стране ежегодно не менее 23 000 человек переносят ГВ-нейроинфекции (летальность составляет от 5 до 70%), 250 000–300 000 – офтальмогерпес, около 8 млн – ГГ и 10–12 млн – герпес оролабиальный и герпес гладкой кожи. Если суммировать, то инфекции, вызванные НSV-1+2, поражают ежегодно около 20 млн человек (не менее 14,3% населения России) и распространены больше, чем все гепатиты В, С, D и ВИЧ. Ветряная оспа поражает преимущественно детей в возрасте 1–14 лет [12]. Герпес-зостер носит спорадический характер, чаще встречается при иммунодефицитных состояниях и у лиц старше 50 лет [4, 5].
Обращаемость к врачам – гинекологам, урологам, дерматологам – по поводу ГГ в РФ составляет не более 15% от реальной частоты заболевания, а общее число пациентов только с ГГ в России – не менее 8 млн человек. На территории РФ и СНГ различными формами хронических рецидивирующих ГВИ с ежегодными рецидивами страдают около 22 млн человек [6, 9, 12]. Рецидивы ГВИ у лиц с иммунодефицитными состояниями встречаются со следующей частотой: у онкологических больных и пациентов старше 50 лет – в 50% случаев, при ВИЧ/СПИДе – в 95–100% [13]. Известно, что СMV можно обнаружить в моче каждого сотого новорожденного ребенка. К году заражен каждый пятый, к 35 годам – 40% населения, а к 50 годам – все 100%. В Европе и Северной Америке антитела к CMV обнаруживают у 40–60% лиц старше 35 лет, а в регионах Африки и Азии – практически у 100%.
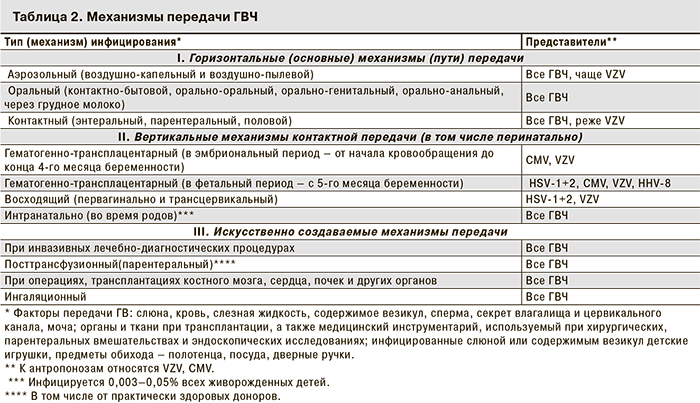
Для ГВ человека характерна высокая распространенность и разные механизмы передачи, которые предопределяют особенности первичной инфекции, локализацию вирусной сыпи и хронические рецидивирующие формы инфекционного процесса. В табл. 2 представлены пути передачи ГВИ. До 15 лет воздушно-капельным путем практически все люди инфицируются ГВЧ первых шести типов.
Особенности эпидемиологии ГВЧ [1–4]
Глобальный нозоареал: от спорадических вспышек до эпидемий.
Множество путей и способов передачи (см. табл. 2).
Чрезвычайно высокая инфицированность во всем мире.
Рост заболеваемости опережает темпы прироста населения Земли.
Серопозитивность коррелирует с социально-экономическим статусом.
Характеризуются эпидемиологическим вирусным синергизмом, ассоциированы в развитии ко- и суперинфекций, смерти у лиц с иммунодефицитными состояниями.
Естественная восприимчивость людей высока, однако характерно широкое распространение латентных ГВИ: антитела к ГВ коррелируют с возрастом. Они вызывают латентную, острую и хроническую формы ГВИ.
Маркер иммунной дисфункции в популяции и у отдельно взятого человека.
В табл. 3 представлены наиболее характерные для каждого ГВЧ клеточные мишени и инкубационный период. Низкая иммуногенность, тканевой пантропизм, множество клеток-мишеней, способность поражать различные ткани и органы, способность к персистенции и латенции, вариабельный инкубационный период предопределяют высокую значимость ГВИ для врачей – инфекционистов, иммунологов, вирусологов, эпидемиологов, организаторов здравоохранения и смежных специалистов.
Латентность – это пожизненное сохранение ГВ в неявной, морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных ганглиев чувствительных нервов; характеризуется персистенцией в инфицированных клетках, отсутствием или низкой репликацией ГВ и практически без экспрессии его белков-мишеней для иммунного ответа.
Суммируя, отметим наиболее важные клинико-эпидемиологические аспекты ГВ:
- после первичного инфицирования ГВ интегрируются в геном клеток, персистируют пожизненно, т. е. способны непрерывно и циклично реплицироваться в инфицированных клетках тропных тканей, вызывая нестерильный иммунитет в организме человека;
- вызывают развитие иммунодефицитных состояний различных звеньев адоптивного иммунитета и, как следствие – неполная элиминация ГВ из организма;
- вызывают поражение иммуннопривилегированных областей – органов зрения и нервно-психической сферы. Около 5% лиц, поступающих в глазные клиники, имеют рецидивирующую патологию, обусловленную HSV (ретинит, хориоретинит и др.). ГВ-кератиты и иридоциклиты составляют около 60–65% от общего числа патологий роговицы, причем обусловлены они в основном HSV (89,6%) и CMV (10,4%). При ГВИ возможно развитие катаракты и необратимой слепоты. ГГ – причина примерно 10% случаев депрессий и суицидов (по данным Минздрава США);
- являются причиной хронической боли в 14–30% случаев (HSV-1+2, VZV);
- сопряжены с индукцией нестабильности генома человека, онкогенной трансформацией [5, 14–17];
- при внезапном и тяжелом течении – маркер онкологических заболеваний и ВИЧ/СПИДа [HSV-2 (реже HSV-1), CMV, EBV, HHV-6, HHV-8]. ГВ могут реактивироваться и реплицироваться в условиях относительного благополучия иммунной системы, т. е. без выраженных признаков иммунодефицитных состояний [18]. HSV-независимый фактор риска заражения и передачи ВИЧ; при этом ВИЧ вдвое чаще встречается при наличии клинических проявлений HSV-инфекции, чем без них. Бронхит, пневмония, эзофагит ГВ-генеза продолжительностью свыше 1 мес, а также 2 и более эпизодов ГВ-стоматитов в течение 1 года – индикатор ВИЧ/СПИДа (уровень CD4+ Т-лимфоцитов в крови < 400–600 клеток в 1 мкл) [19];
- могут иметь различную клиническую картину – от оппортунистического носительства до развития ГВ-сепсиса.
В середине 90-х годов XX века были проведены исследования Международного герпетологического форума на тему отношения врачей к проблеме ГВИ человека [20]. Как показала практика, во всех странах мира врачи субъективно оценивают значимость этих заболеваний, не проводится должным образом скрининг больных герпесом.
Риск инфицирования и источник инфекции
Наиболее высокий риск передачи ГВИ отмечается при развитии рецидива с местными проявлениями заболевания или же в продромальный период. Во время рецидива лабиального герпеса или ГГ рекомендуется воздержаться от половых контактов. Передача инфекции может произойти и без ее клинических проявлений. Риск передачи выше от мужчины к женщине. Первичное инфицирование HSV-1 снижает риск сероконверсии HSV-2 у серодискордантных пар [21]. Таким образом, резервуаром и источником инфекции могут быть вирусоносители и пациенты с манифестными, стертыми и латентными формами ГВИ.
Факторы риска возникновения ГВИ [3, 22, 23, с дополнениями]:
- биологические: возраст, раса, пол;
- физические и экологические: охлаждение, солнечная инсоляция, ионизирующее излучение, УФ-облучение, нахождение в условиях резких колебаний температуры воздуха и/или воды, инструментальное вмешательство на гениталиях, локальная травматизация, массаж, резкая смена климатических поясов;
- поведенческие: число и выбор половых партнеров, половая ориентация, частота половых контактов, использование резиновых контрацептивов;
- психологические: эмоциональный стресс (в том числе экзаменационные нагрузки, одиночество), депрессии, физическое перенапряжение, постоянное недосыпание;
- физиологические: болезненные месячные, аборты, беременность, роды, постменопауза; спортивные нагрузки;
- алиментарные: голодание, протеиновая депривация нутритивного генеза, преобладание в пище продуктов, богатых аргинином и/или с низким поступлением лизина, избыточное употребление алкогольных напитков;
- фармакологические: прием иммуносупрессивной терапии (глюкокортикостероиды, цитостатики, антиметаболиты, антибиотики, биосимиляры и др.).
Группы риска возникновения ГВИ [4, 5, 22, 24, с дополнениями]:
I. Лица с первичными иммунодефицитными состояниями (первичная иммунная дисфункция): общей вариабельной иммунной недостаточностью (CVID), синдромами Вискотта–Олдрича, Луи–Барр, ТКИН, Х-сцепленным аутоиммунным синдромом, синдромом Дункана [23] и др.
II. Лица с транзиторной или устойчивой вторичной иммунной недостаточностью (вторичная иммунная дисфункция): пациенты с гриппом, частыми ОРВИ с затяжным течением, аденовирусной инфекцией;
- беременные (herpes gestationis), недоношенные новорожденные; лица старше 60 лет; новорожденные и взрослые с бактериальной пневмонией;
- пациенты, получающие иммуносупрессивную системную терапию: пульс-терапию и/или длительное применение глюкокортикостероидов, цитостатиков (химиотерапия), муромонаба-CD3 (OKT3), инфликсимаба, адалимумаба (для лечения соответственно аутоиммунных, онкологических заболеваний, после трансплантаций); нерациональную и/или длительную антибиотикотерапию;
- пациенты с массивными гемопотерями и/или реципиенты крови;
- пациенты с онкопатологией (в том числе с гемобластозами, лимфомами), тяжелыми и длительными анемиями;
- пациенты после радикальных оперативных вмешательств, нейрохирургических и кардиохирургических операций (аортокоронарное шунтирование и др.), с комплексными тяжелыми травмами, ожогами; после трансплантаций костного мозга, других органов и тканей;
- пациенты с сепсисом, активным туберкулезом;
- пациенты с ИППП и ВИЧ-инфицированные (особенно в стадии СПИДа);
- пациенты, имеющие половые связи с несколькими партнерами, раннее начало половой жизни; пациенты венерологических клиник;
- представители негроидной расы (чаще встречается HSV-2, чем HSV-1); лица с низким уровнем образования, работающие на улице; занимающиеся коммерческим сексом;
- лица, использующие наркотические вещества и препараты; пациенты с синдромом аггравации, умышленно принимающие глюкокортикостероиды и цитостатики;
- пациенты с аутоиммунными заболеваниями в активной фазе;
- пациенты с атопическими заболеваниями, себорейным дерматитом;
- пациенты после лучевой (радио-, кюри-, рентгено-) терапии, с формированием и наличием лучевой болезни, после воздействия ионизирующего излучения [не менее 65–100 бэр (0,6–1 Гр) на одного человека]; лица, контактирующие с радиационным фактором в экстремальных условиях (участники ликвидации последствий аварии на Чернобыльской АЭС), включая радиологов, рентгенологов, радиобиологов, персонал ядерных хранилищ и других подразделений предприятий атомно-энергетического комплекса (ПАЭК) с особо опасными условиями труда, контактирующие с высокорадиоактивными топливосодержащими массами, работники угольной промышленности, шахтеры, летчики, космонавты; подразделения особого риска (ПОР) –военнослужащие, которые контактировали с ионизирующим излучением при испытаниях ядерного оружия, на атомных подводных лодках, на НПО «Маяк», на ядерных полигонах [5];
- врачи, контактирующие с биоматериалом: инфекционисты, вирусологи, иммунологи, дерматовенерологи, неонатологи, акушеры-гинекологи, стоматологи, гематологи, урологи, хирурги, врачи скорой помощи, трансфузиологи, реаниматологи и др.
Эпидемиологический надзор за ГВИ в полном объеме (учет абсолютного числа заболевших и заболеваемости в интенсивных показателях, выявление факторов и групп риска, проведение противоэпидемических и профилактических мероприятий) осуществляется только в отношении официально регистрируемых ГВИ (ветряная оспа, инфекционный мононуклеоз, ГГ). Другие формы ГВИ не регистрируются, поэтому противоэпидемические мероприятия проводятся весьма ограниченно [1]. Несмотря на появление вакцин против простого герпеса и ветряной оспы, до настоящего времени ГВИ считаются «неуправляемыми» средствами иммунопрофилактики, с вариабельной типоспецифичностью ГВ на разных континентах и эндемичностью среди коренного населения. Обычно ГВИ протекают доброкачественно, но могут приобретать и генерализованные формы, требующие госпитализации. В то же время ГВИ низкоиммуногенны и могут быть признаком иммунной дисфункции на индивидуальном и популяционном уровне, c множественными путями передачи, наличием сопряженности ГВ в виде ко- и микст-инфекций с другими социально-значимыми заболеваниями, включая ВИЧ/СПИД, бесплодие, онкологические заболевания, сердечно-сосудистую и лучевую патологию.

Все вышеперечисленное позволяет считать ГВИ важной медико-социальной проблемой современного здравоохранения, актуализирует и обосновывает необходимость создания федеральной программы по ГВИ с участием представителей законодательной и исполнительной власти, производителей оригинальных противовирусных препаратов и профессионального сообщества как приоритетное национальное направление клинической вирусологии, инфектологии, иммунологии, фарминдустрии и современной медицины в целом.


