Объем кардиохирургических операций на сердце и сосудах у пациентов с тяжелыми поражениями коронарных сосудов, нарушениями клапанного аппарата и сердечной недостаточностью не имеет тенденции к снижению. Послеоперационные инфекционные осложнения (ПИО), несмотря на совершенствование и применение более технологичного оборудования, остаются одной из значимых причин летальности и увеличения финансовых затрат. Частота ПИО в зависимости от различных клинических факторов колеблется от 3 до 9,8% [1–3]. Бактериальные инфекции кровотока (бактериемии) как осложнения у кардиохирургических пациентов встречаются достаточно часто [4, 5]. Как правило, бактериемии возникают в первые дни после операции у пациентов в отделениях реанимации и интенсивной терапии [6]. После операции аортокоронарного шунтирования у пациентов с инфекциями кровотока риск смертности был в 2,4 раза выше, чем у неинфицированных пациентов [7]. Охват этим видом ПИО возрастает у больных с механической поддержкой кровообращения при помощи устройств, увеличивающих число возможных путей проникновения возбудителей инфекционных осложнений. Важно отметить, что этиологическими агентами, как правило, являются бактерии, обладающие набором факторов патогенности. Наряду с инфекциями кровотока, источником которых могут быть различные очаги (рана, трахея, сосудистые катетеры и др.), имеют место первичные инфекции кровотока без определяемого источника. Летальность среди пациентов с бактериемиями составляет до 36% [7]. Колебания этого показателя зависят от разных факторов, значение которых еще недостаточно исследовано. Вместе с тем выяснение их будет способствовать распознаванию факторов риска и принятию предупредительных мер.
Цель работы – определить частоту бактериемий среди ПИО, спектр возбудителей и тяжесть течения (по показателю летальности).
Материалы и методы
Проведен ретроспективный анализ инфекций кровотока после 8292 кардиохирургических операций за период с 2000 по 2012 г. Возраст пациентов – от 20 до 78 лет. Возбудители ПИО определены у 587 пациентов и бактериемий – у 463 в соответствии с общепринятыми приказами и инструкциями. Стерильно забранную кровь культивировали в аппарате BactAllert фирмы «BioMerieux» (Франция). Для выделения и выращивания микроорганизмов использовали стандартизированные питательные среды фирмы «Pronadisa» (Испания). Идентификацию микробов проводили с применением панелей BD Crystal с автоматическим считыванием данных с использованием базы данных BBL Crystal MIND. Выборочно проведена оценка чувствительности выделенных штаммов условно-патогенных бактерий к антибиотикам диско-диффузионным методом на среде Мюллера–Хинтона в соответствии со стандартами NCCLS (США). Определение зон задержки роста осуществляли на приборе «Озирис» фирмы «Biorad» (Франция) с использованием экспертной программы, позволяющей учитывать минимальную ингибиторную концентрацию антибиотиков, природную резистентность микроорганизмов, метициллинрезистентность и продукцию бета-лактамаз расширенного спектра (БЛРС). Метициллинрезистентность оценивали по чувствительности выделенных штаммов к оксациллину и цефокситину. Бета-лактамазную активность определяли, используя диски с цефтазидином и цефтазидином/клавулановой кислотой.
Статистическую обработку данных проводили в рамках базовой программы статистики (Microsoft Excel) с определением значения среднего арифметического (M) и стандартной ошибки (m). Достоверность различий оценивали с помощью t-критерия Стьюдента.
Результаты и обсуждение
Проведен анализ ПИО после кардиохирургических операций и летальности с 2000 по 2012 г. (табл. 1).
Как следует из представленных данных, за период с 2000 по 2012 г. показатели общей летальности и ПИО снизились соответственно с 8,8 до 4,2% и с 8,2 до 4,6%.
Анализ клинико-лабораторных маркёров ПИО показал, что основным их видом явились инфекции крови. Частота встречаемости бактериемий показана в табл. 2.
Как следует из представленных данных, число регистрируемых бактериемий значительно уменьшилось именно за период 2010–2012 гг. Анализ показал, что другие виды инфекционных осложнений (вентиляционно-зависимые легочные осложнения, инфекции места хирургического вмешательства, мочевыводящих путей и т. п.) регистрировались значительно реже (табл. 3).
На протяжении исследованного периода бактериемии составляли основную часть ПИО – 77,8–80,4%. Следует отметить, что бактериемии встречались как в изолированном виде, так и в сочетании с другими инфекционными осложнениями, при этом соотношение изолированных и сочетанных бактериемий менялось (табл. 4).
Сочетанные бактериемии в 2000–2004 гг. составляли 34,3%, в 2010–2012 гг. их доля увеличилась.
Интересные данные получены при анализе зависимости тяжести течения инфекции, рассчитанной по показателю смертности, от вида возбудителя бактериемии (табл. 5).
Как следует из представленных данных, из года в год в течение 12-летнего периода наблюдений тяжесть течения послеоперационных инфекций, вызванных грамотрицательной микрофлорой, существенно превышала показатели при инфекционных осложнениях, вызванных грамположительной микрофлорой. Так, смертность в группе пациентов, у которых возбудителями ПИО явились госпитальные штаммы грамотрицательной микрофлоры (n = 258), составила 48,1 %, а в группе пациентов с бактериемией, вызванной грамположительной флорой (n = 446) – 27,4%.
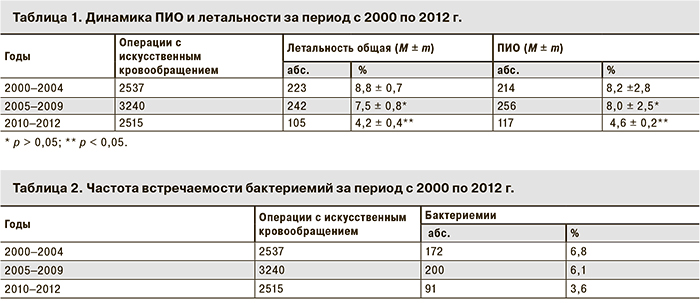
Анализ структуры возбудителей послеоперационных бактериемий показал преобладание (67,3%) грамположительной микрофлоры (рис. 1).
Первое место по частоте изоляции занимали коагулазоотрицательные стафилококки (CNS), составляя 42,9% от всех выделенных микроорганизмов. Среди грамотрицательной микрофлоры лидировали энтеробактерии и грамотрицательные неферментирующие бактерии (НГОБ). Среди семейства энтеробактерий клинически значимыми были штаммы клебсиелл и энтеробактеров. В группе НГОБ актуальными в плане клинической значимости явились ацинетобакторы (Acinetobacter spp.) – A. baumannii, A. woffii, реже – A. аnitratus.
Анализ антибиотикочувствительности основных патогенов, изолированных из крови, показал высокую резистентность изученных штаммов как грамположительной, так и грамотрицательной микрофлоры к используемым в клинике антибиотикам. В частности, штаммы CNS показали достаточно низкую чувствительность к карбапенемам (тиенаму, меропенему) и высокую – к тигацилу, моксифлоксацину, левофлоксацину, пиперациллину/тазобактаму. Энтерококки, с учетом их природной резистентности к ряду антибиотиков, показали высокую чувствительность к линезолиду, ванкомицину, тигацилу, рифампину.
В целом все изученные штаммы грамположительной микрофлоры оказались высокочувствительными к ванкомицину и линезолиду, грамотрицательной – к полимиксину и тигециклину (рис. 2, см. на вклейке).
Особый интерес представляют результаты анализа чувствительности к антибиотикам грамотрицательных бактерий – клебсиелл и неферментирующих микроорганизмов. Для штаммов клебсиелл наибольшая чувствительность среди изученной панели антибиотиков выявлена к полимиксину и тигацилу, средняя – к амикацину и меропенему, к остальным антибиотикам – низкая чувствительность или ее отсутствие. Штаммы ацинетобакторов отличались множественной устойчивостью к антибиотикам. В целом для выделяемых неферментирующих микроорганизмов достаточно высокая чувствительность показана в отношении полимиксина, тигацила, цефепима и сульперазона.
 Проблема бактериемий, ассоциируемых с летальностью, является в настоящее время одной из тем, достаточно широко представленных в литературе, в частности, посвященной проблеме кардиоваскулярной хирургии [5]. Так, A. Trethon и соавт. [7] (Венгерский центр сердечной хирургии) констатировали, что инфекции крови у больных после аортокоронарного шунтирования в 2,4 раза увеличивают риск смертности по сравнению с неинфицированными пациентами. Аналогичные данные были опубликованы в работе М.А. Olsen и соавт. [8]. На примере 4515 пациентов показано, что смертность после оперативного вмешательства была значительно выше у пациентов с инфекциями кровотока, чем без них. При этом инфекции кровотока, вызванные грамотрицательными бактериями, ассоциированы с более высоким риском смертности по сравнению с бактериемиями, при которых были изолированы грамположительные бактерии. Согласно данным M. Garrouste-Orgeas и соавт. [9], увеличение числа случаев бактериемий в отделениях реанимации и интенсивной терапии соответствовало увеличению риска госпитальной смертности. При этом случаи инфекций крови, связанные с выделением в качестве возбудителя CNS, не влияли на смертность пациентов. Испанские исследователи обратили внимание на штаммы E. coli, продуцирующие БЛРС при бактериемиях. Проанализированы нозокомиальные инфекции крови, вызванные этими микроорганизмами, в 13 клиниках. Эти инфекции составляли 16% всех ПИО, из них 2% были вызваны БЛРС-продуцирующими E. coli. Наиболее часто их выявляли при трансплантации органов. С ними была связана важная этиологическая причина нозокомиальных инфекций крови и смертность [10].
Проблема бактериемий, ассоциируемых с летальностью, является в настоящее время одной из тем, достаточно широко представленных в литературе, в частности, посвященной проблеме кардиоваскулярной хирургии [5]. Так, A. Trethon и соавт. [7] (Венгерский центр сердечной хирургии) констатировали, что инфекции крови у больных после аортокоронарного шунтирования в 2,4 раза увеличивают риск смертности по сравнению с неинфицированными пациентами. Аналогичные данные были опубликованы в работе М.А. Olsen и соавт. [8]. На примере 4515 пациентов показано, что смертность после оперативного вмешательства была значительно выше у пациентов с инфекциями кровотока, чем без них. При этом инфекции кровотока, вызванные грамотрицательными бактериями, ассоциированы с более высоким риском смертности по сравнению с бактериемиями, при которых были изолированы грамположительные бактерии. Согласно данным M. Garrouste-Orgeas и соавт. [9], увеличение числа случаев бактериемий в отделениях реанимации и интенсивной терапии соответствовало увеличению риска госпитальной смертности. При этом случаи инфекций крови, связанные с выделением в качестве возбудителя CNS, не влияли на смертность пациентов. Испанские исследователи обратили внимание на штаммы E. coli, продуцирующие БЛРС при бактериемиях. Проанализированы нозокомиальные инфекции крови, вызванные этими микроорганизмами, в 13 клиниках. Эти инфекции составляли 16% всех ПИО, из них 2% были вызваны БЛРС-продуцирующими E. coli. Наиболее часто их выявляли при трансплантации органов. С ними была связана важная этиологическая причина нозокомиальных инфекций крови и смертность [10].
Согласно опубликованным результатам исследования изолятов, выделенных в 13 клиниках у пациентов с нозокомиальными инфекциями крови, основную часть (76,8%) всех патогенов составили штаммы грамотрицательной микрофлоры. Авторами отмечена множественная резистентность штаммов Acinetobacter baumannii к антибиотикам. Выделенные штаммы были чувствительны только к полимиксину B [12]. Опасность возрастания лекарственной резистентности нозокомиальных патогенов, что особенно характерно для отделений реанимации и интенсивной терапии, подтверждают многие авторы [13–15].
Таким образом, представленные в современной литературе материалы согласуются с результатами наших исследований частоты развития бактериемий и их роли в развитии ПИО за период с 2000 по 2012 г. Выявлена связь тяжести клинического течения инфекций кровотока с фенотипическими особенностями возбудителей. Изучение микробного пейзажа крови у пациентов с бактериемией выявило преобладание CNS на фоне общего доминирования грамположительной микрофлоры. Ввиду резистентности изученных штаммов госпитальной микрофлоры к бета-лактамным антибиотикам и полирезистентности грамотрицательной неферментирующей флоры практически ко всем используемым в клинике антибиотикам, за исключением полимиксина, тигацила, цефепина, представляется важным проведение в качестве рутинного анализа оценки структуры грамотрицательной флоры.


